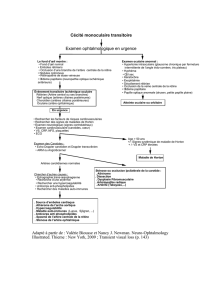
Lire l'article complet

Rétinopathie de stase veineuse
et occlusion carotidienne
■La rétinopathie de stase veineuse
est le premier signe du syndrome
d’ischémie oculaire compliquant les
occlusions carotidiennes. Elle est le plus
souvent asymptomatique, dépistée lors
d’un examen systématique du fond d’œil,
et associe dilatation des veines rétiniennes
et hémorragies profondes en moyenne
périphérie rétinienne. Elle est secondaire à
une hypoperfusion chronique de la rétine
et est réversible en cas de reperfusion
oculaire. Elle peut se compliquer d’un
syndrome d’ischémie oculaire dont le pro-
nostic est catastrophique. Au cours du syn-
drome d’ischémie oculaire, des néovais-
seaux apparaissent sur la rétine, le disque
optique, l’angle irido-cornéen et l’iris,
produisant des douleurs oculaires, un
glaucome néovasculaire, des hémorragies
intraoculaires, une cataracte et un œdème
cornéen conduisant à une baisse irréver-
sible d’acuité visuelle.
Dans cette étude, les auteurs ont systéma-
tiquement examiné le fond d’œil de
110 patients ayant une occlusion caroti-
dienne symptomatique. Une rétinopathie
de stase veineuse était présente chez
32 patients (29 %), notamment chez ceux
ayant des symptômes neurologiques
évoquant un mécanisme hémodynamique
(RR 2,4 ; IC 95 % : 1-5,9). Les patients
ayant une rétinopathie de stase veineuse
avaient un débit sanguin cérébral plus bas
que ceux sans rétinopathie de stase vei-
neuse. Après 29 mois de suivi en
moyenne, seulement 4 patients avaient des
symptômes oculaires suggérant un syn-
drome d’ischémie oculaire.
Commentaires. Cette étude est impor-
tante car elle confirme la forte préva-
lence de rétinopathie de stase veineuse
(1/3) chez les patients ayant une occlu-
sion carotidienne provoquant une isché-
mie chronique. Ces patients, qui ont un
débit sanguin cérébral diminué, sont à
risque de déveloper un accident isché-
mique cérébral hémodynamique et ont
également un risque de syndrome d’is-
chémie oculaire irréversible. Un examen
ophtalmologique systématique permet de
dépister ces patients lorsqu’une occlu-
sion carotidienne est découverte. Cette
étude ne permet aucune conclusion quant
à la prise en charge thérapeutique des
patients ayant une occlusion caroti-
dienne symptomatique, mais il est pos-
sible qu’une revascularisation cérébrale
et oculaire précoce améliore leur pronostic.
Il faut également mentionner que cette
étude n’a évalué que les patients ayant
une occlusion carotidienne sympto-
matique, alors que la rétinopathie de
stase veineuse et le syndrome d’ischémie
oculaire surviennent souvent chez des
patients n’ayant aucun symptôme neuro-
logique, révélant ainsi l’occlusion caroti-
dienne.
V. Biousse, unité de neuro-ophthalmologie,
université Emory, États-Unis.
Spectre de l’atteinte
des nerfs périphériques
dans la sarcoïdose
■Said et al. rapportent une série
rétrospective de 11 patients atteints
de neuropathies sarcoïdosiques prouvées
histologiquement. Profil clinique : 6 neuro-
pathies focales ou multifocales, dont un
patient qui s’est présenté comme une neu-
ropathie avec blocs de conduction et un
autre comme une neuropathie multifocale
axonale, 4 atteintes symétriques et distales
et un patient qui s’est présenté comme un
Guillain-Barré avec une diplégie faciale et
une défaillance respiratoire. ECA : élevée
chez 2 patients ; IDR à la tuberculine : néga-
tive chez 10 patients. Histologiquement :
granulomes dans l’épinèvre et la périnèvre
sur toutes les biopsies nerveuses ; infiltrat
inflammatoire dans l’endonèvre, le tissu
conjonctif et les vaisseaux chez 5 patients ;
cellules géantes multinucléées chez
8 patients et vascularite nécrosante chez
7 patients. Sur 10 biopsies musculaires :
infiltrats inflammatoires et granulomes
chez 9 patients et vascularite nécrosante
chez 2 patients. Les cellules infiltrantes
étaient en majorité des lymphocytes CD4+
et des macrophages (réaction d’hypersen-
sibilité retardée). Tous les patients avaient
un autre tissu ou organe atteint : muscle
(9), poumons et/ou ganglions thoraciques
(8), peau (3), arthrite (2), ganglion péri-
phérique (1), œil (1), estomac (1). Seuls
2 patients avaient un diagnostic de sarcoï-
dose avant les manifestations neurolo-
giques. La plupart des patients ont été
améliorés par les corticoïdes.
Commentaires. Cette étude illustre le
spectre large de l’atteinte sarcoïdosique
avec deux présentations inattendues et
jamais rapportées dans la littérature : les
cas mimant la neuropathie avec blocs et le
Guillain-Barré.
D. Dimitri,
hôpital Sainte-Anne, Paris.
Homocystéine plasmatique
et démence
■Pour étudier la relation entre l’ho-
mocystéine plasmatique et le déve-
loppement d’une démence, 1 092 sujets
non déments (âge moyen 76 ans) ont été
suivis de manière prospective. Le taux
d’homocystéine de base a été mesuré et
celui effectué 8 ans plus tôt. Une analyse
multivariée avec ajustement à l’âge et au
sexe a inclus le génotypage de l’ApoE,
les autres facteurs de risque cardio-
vasculaires, et des dosages vitaminiques
(folates, B12 et B6). Après une période
médiane de suivi de 8 ans, 111 sujets ont
développé une démence dont 83 de type
Alzheimer. Le risque relatif de démence,
était de 1,4 (1,1 à 1,9) pour chaque éléva-
tion d’1 DS de la valeur de l’homocys-
téine exprimée en log, que ce soit à la
mesure de base ou 8 ans avant. Le risque
relatif de DTA était de 1,8 (1,3 à 2,5)
pour l’élévation d’1 DS de la valeur de
base et de 1,6 (1,2 à 2,1) pour l’élévation
d’1 DS 8 ans plutôt. Pour un taux
d’homocystéine à 14 µmol/l, le risque de
DTA double.
Commentaires. Cette analyse permet
d’identifier une association forte et indé-
pendante entre l’hyperhomocystéinémie et
le développement d’une démence (DTA
ou non). L’hyperhomocystéinémie a été
associée également à une augmentation du
risque d’accident vasculaire cérébral,
d’athérosclérose carotidienne et à l’aug-
mentation du risque de décès après un
infarctus du myocarde et un AVC. Le lien
de causalité entre hyperhomocystéinémie
et démence reste à établir. Une stratégie de
prévention par supplémentation folique
pourrait être alors mise en place.
D.D.
REVUE DE PRESSE
Dirigée par le Pr P. Amarenco
La Lettre du Neurologue - n° 4 - vol. VI - avril 2002 139
✔ Said et al. Nerve granulomas and vasculitis in
sarcoid peripheral neuropathy. A clinicopathologi-
cal study of 11 patients. Brain 2002 ; 125 : 264-75.
✔ Seshari et al. Plasma homocysteine as a risk fac-
tor for dementia and Alzheimer disease. NEJM
2002 ; 346 : 476-83.
✔
Klijn CJM, Kappelle J, van Schooneveld MJ et al.
Retinopathy in symptomatic carotid artery occlu-
sion. Prevalence, cause, and outcome. Stroke
2002 ; 33 : 695-701.
Maq avril 04/06/02 10:02 Page 139

Syndrome parkinsonien
guadeloupéen : une tauopathie
PSP-like ?
■Une fréquence inhabituellement
importante de syndrome parkinsonien
atypique a été récemment rapportée en
Guadeloupe. Les auteurs rapportent les don-
nées de 220 patients guadeloupéens consé-
cutifs, adressés pour syndrome parkinsonien
(par des médecins généralistes dans 75 %
des cas) entre septembre 1996 et mai 2001.
Selon les critères de diagnostic clinique,
seuls 50 patients présentaient une maladie de
Parkinson typique, 58 (26,5 %) présentaient
un tableau compatible avec une probable
paralysie supranucléaire progressive (PSP)
et 96 (43,8 %) étaient classés en syndrome
parkinsonien indéterminé. Celui-ci compre-
nait un syndrome akinétorigide symétrique,
à prédominance axiale, une atteinte cogni-
tive précoce fréquente, des signes d’atteinte
frontale, un syndrome pseudo-bulbaire, une
absence de réponse à la dopa à long terme et
une absence d’atteinte oculomotrice. Trois
patients classés PSP ont été autopsiés. Dans
l’un de ces cas, le tableau neuropathologique
était inhabituel avec des filaments tau+ très
abondants constituant la lésion principale.
Les mêmes caractéristiques histologiques,
évocatrices de “tauopathies”, ont été décrites
dans la FTDP-17, due à une mutation du
gène tau qui n’a pas été retrouvée dans les
cas rapportés ici. Les études biochimiques
ont révélé un doublet majeur de protéines tau
à 64 et 69 kDa, comme observé dans la PSP.
Tous les cas étaient homozygotes pour l’ha-
plotype tau H1.
Commentaires. La fréquence de syndromes
parkinsoniens atypiques en Guadeloupe
(globalement 3,4 fois plus de PSP et de
syndromes parkinsoniens atypiques que de
maladies de Parkinson) et la ressemblance
avec l’association démence-syndrome par-
kinsonien-SLA de l’île de Guam posent la
question de l’intervention d’un facteur
environnemental tel que les toxines alka-
loïdes (inhibiteurs du complexe mitochon-
drial I) contenues dans les feuilles de thé
et/ou les fruits tropicaux. Des études
pathologiques complémentaires sont
nécessaires pour confirmer que ce syn-
drome parkinsonien “guadeloupéen” est
bien une tauopathie identique ou très
proche de la PSP.
P. Favrolle, Service de neurologie,
hôpital Saint-Antoine, Paris.
Lévodopa ou agoniste
en première intention ?
■Cette étude veut démontrer que
l’agoniste dopaminergique prami-
pexole ralentit la progression de la mala-
die de Parkinson par comparaison à la
L-dopa. L’hypothèse est que les agonistes
seraient moins toxiques que la L-dopa
pour les neurones dopaminergiques rési-
duels (environ 50 % au début de la mala-
die), ce qui expliquerait qu’ils retardent la
survenue des dyskinésies chez ces
patients. Les auteurs évaluent la progres-
sion du Parkinson avec le [123I]-ß-CIT, un
ligand pour le SPECT qui se fixe sur le
transporteur de la dopamine, mesurant
ainsi la densité des terminaisons striatales.
Des parkinsoniens débutants (n = 82, ran-
domisés en bras pramipexole et L-dopa)
sont examinés avec ce traceur à l’entrée
puis 2, 3 et 4 ans plus tard. À chaque exa-
men, la diminution de fixation striatale du
traceur est significativement moins rapide
chez les patients sous pramipexole que
chez ceux sous L-dopa : à 4 ans, elle
atteint – 16 % sous pramipexole (n = 32)
contre – 26 % sous L-dopa (n = 33,
p<0,01). La L-dopa est plus efficace
contre les signes parkinsoniens, mais
l’évolution du score UPDRS total à 4 ans,
mesuré après au moins 12 heures d’arrêt
des médicaments, était similaire dans les
2groupes (pramipexole + 4,1 ; L-dopa
+4,0). Les auteurs concluent que la mort
des neurones dopaminergiques nigro-
striataux est plus lente sous pramipexole
que sous L-dopa.
Commentaires. Première étude montrant
que le choix du traitement initial a un effet
sur la progression de la mort neuronale dans
le Parkinson, même si on ignore si la mala-
die est accélérée par la L-dopa ou ralentie
par le pramipexole. L’imagerie évite que
l’effet “protecteur” soit obéré par l’effet
symptomatique du pramipexole. Et à 4 ans,
65 malades suffisent pour le démontrer !
P. Rémy,
hôpital Henri-Mondor, Créteil.
Dirigée par le Pr P. Amarenco
La Lettre du Neurologue - n° 4 - vol. VI - avril 2002
140
REVUE DE PRESSE
✔
Caparros-Lefebvre D, Sergeant N, Lees A et al.
Guadeloupean parkinsonism : a cluster of progres-
sive supranuclear palsy-like tauopathy. Brain 2002 ;
125 (Pt 4) : 801-11.
✔
Parkinson Study Group. Dopamine transporter
brain imaging to assess the effects of pramipexole
vs levodopa on Parkinson disease progression.
JAMA 2002 ; 287 : 1653-61.
Maq avril 04/06/02 10:02 Page 140
1
/
2
100%