Lire l'article complet

Correspondances en Métabolismes Hormones Diabètes et Nutrition - Vol. XIII - n° 5 - septembre-octobre 2009
174
Échos des congrès
L
e diabète de type 1 découle d’une destruction
auto-immune des cellules bêta, directement
responsable de l’hyperglycémie. À l’heure
actuelle, de nombreux laboratoires se tournent vers
des stratégies visant soit à remplacer les cellules bêta
endommagées soit à améliorer la fonction des cellules
bêta résiduelles, une approche qui pourrait à terme
également concerner le diabète de type 2. Ces der-
nières années ont été marquées par les résultats d’un
essai clinique cherchant à valider l’intérêt de la gree
d’îlots de Langerhans provenant de donneurs cadavé-
riques à des patients diabétiques de type 1 (Shapiro et
al., 2000). Cette technique a permis à ces patients de
retrouver une glycémie normale indépendamment de
toute injection d’insuline pendant la première année
postgree. Cependant, les promesses de cette stratégie
sont largement contrebalancées par la faible disponi-
bilité des greons humains. En eet, on estime que,
avec le nombre d’îlots disponibles dans les conditions
actuelles, on ne pourrait greer que 0,5 % des patients
diabétiques de type 1. Par conséquent, l’identication
de nouvelles sources de cellules bêta est indispensable
dans la perspective d’élargir les possibilités de grees.
Au cours du dernier congrès de l’ADA (La Nouvelle-
Orléans, 2009), de nombreuses avancées ont été pré-
sentées concernant la néogenèse et la biologie des
cellules bêta, et nous revenons ci-dessous sur leurs
possibilités d’application clinique.
Dérivation de cellules bêta à partir
de cellules souches humaines
(d’après le symposium du Dr E. Kroon)
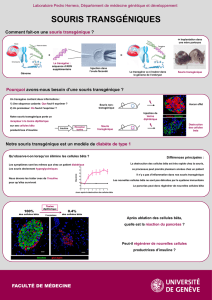
Les cellules souches dérivent de la masse cellulaire
interne d’un blastocyste. Elles peuvent se répliquer
indéniment en conservant leurs propriétés. On parle
alors “d’autorenouvellement”. Ces cellules sont dites
“multipotentes”, car elles peuvent, en théorie, se dié-
rencier dans tous les types cellulaires. Pour orienter la
diérenciation de ces cellules vers un type cellulaire
donné, il est nécessaire de dénir des conditions de
culture appropriées. Le Dr Kroon a présenté des don-
nées qui montrent qu’il est possible, à partir de cellules
souches humaines, de dériver de l’endoderme pancréa-
tique. Lorsque l’endoderme pancréatique obtenu in
vitro est greé sous la capsule rénale de la souris, des
cellules produisant de l’insuline humaine se dévelop-
pent dans le greon. Cela est démontré par le fait que
l’insuline humaine est détectée dans le sang des souris
greées lorsqu’on leur injecte du glucose. De plus, plus
le temps postgree est allongé, plus la tolérance au
glucose des souris s’améliore. Ces données indiquent
donc que cette méthode permet de dériver des cellules
bêta humaines fonctionnelles. An d’évaluer l’intérêt
thérapeutique potentiel de ce protocole, les auteurs
ont greé l’endoderme pancréatique généré in vitro
chez des souris rendues préalablement diabétiques
par l’injection d’une toxine, la streptozotocine. La gree
d’endoderme pancréatique a corrigé le diabète induit
expérimentalement chez ces souris. Cette approche
s’avère donc très intéressante pour le traitement du
diabète. Néanmoins, il existe encore une limite majeure :
dans un grand nombre de cas, des tératomes se for-
ment à plus ou moins long terme dans les greons.
E. Kroon et al. ont indiqué qu’en triant préalablement
les cellules sur la base de l’expression d’un marqueur
membranaire spécique, ils diminuent considérable-
ment le développement des tumeurs dans les greons.
Vu l’importance des retombées potentielles d’un tel
travail, ils ont souhaité garder l’identité de ce marqueur
condentielle pour le moment.
Ces expériences démontrent que l’utilisation de cellules
souches humaines pourrait être à l’avenir une possi-
bilité pour traiter le diabète. Toutefois, comme c’est le
cas dans les essais visant à traiter d’autres maladies, le
Des nouvelles de l’American Diabetes Association
(ADA) 2009
Cellules souches, différenciation
et biologie des cellules bêta
La Nouvelle-Orléans, 9 juin 2009
Bertrand Duvillié*
* Chargé de recherches CR1,
U845/E0363 INSERM,
faculté Necker-Enfants
malades, Paris.
© Vladimir Khirman

Correspondances en Métabolismes Hormones Diabètes et Nutrition - Vol. XIII - n° 5 - septembre-octobre 2009
175
Cellules souches, diérenciation et biologie des cellules bêta
problème majeur de l’utilisation des cellules souches
est leur pouvoir cancérigène, qui doit absolument être
contrôlé.
Induction de la néogenèse
des cellules bêta à partir du foie
(d’après K. Ozer, abstract OR141)
Depuis quelques années, on sait que l’expression forcée
de facteurs de transcription impliqués dans le dévelop-
pement peut induire l’expression d’insuline dans d’autres
types cellulaires que les cellules bêta. Notamment,
S. Ferber, en Israël, avait montré que l’expression du
gène Pancreatic Duodenal Homeobox Factor 1 (Pdx1)
pouvait entraîner l’expression d’insuline dans le foie.
Au cours du congrès de l’ADA, K. Ozer et al. ont mon-
tré que l’infection de souris avec un adénovirus qui
exprime à la fois le gène proendocrine neurogénine 3
(Ngn3) et le gène de la bêtacelluline induit également
la production d’insuline par certaines cellules du foie.
En eet, lorsqu’un tel virus est injecté dans le sang de la
souris, il est retenu en majorité par le foie, et l’expression
concomitante des gènes Ngn3 et bêtacelluline induit
une diérenciation de cellules du foie en cellules bêta.
Les auteurs ont remarqué que l’une des limites de cette
approche réside dans le fait qu’elle est irréalisable chez
une souris Non Obese Diabetic (NOD), ce type de souris
présentant une réaction auto-immune similaire à celle
observée dans un diabète de type 1. Pour y remédier,
K. Ozer et al. ont combiné l’expression des gènes Ngn3
et bêtacelluline avec l’expression de l’interleukine 10,
un modulateur du système immunitaire. Avec cette
construction, des souris NOD diabétiques infectées
par l’adénovirus Ad-Ngn3-BTC/IL-10 retrouvent une
glycémie normale ainsi qu’une sécrétion d’insuline en
réponse au glucose satisfaisante. Cette étude, qui avait
pour but d’induire la néogenèse de cellules bêta, a l’ori-
ginalité de prendre en compte les dicultés liées à la
réaction auto-immune qui se déclenche lors du diabète
de type 1. Les futurs développements d’une médecine
régénératrice devront certainement s’inspirer de tels
protocoles, combinant le remplacement des cellules
bêta et la modulation de l’immunité.
Évolution de la fonction de la cellule bêta
au cours de la vie
(d’après le symposium de S. Bonner-Weir)
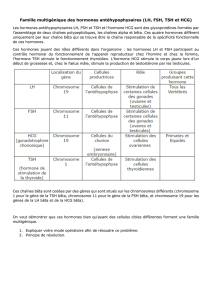
Le laboratoire du Dr S. Bonner-Weir a comparé la sécré-
tion d’insuline en réponse au glucose d’îlots provenant
de rats âgés de 7, 14 et 21 jours ou de rats adultes. La
sécrétion d’insuline en réponse au glucose augmentait
avec l’âge des îlots, indiquant qu’il existe une évolu-
tion fonctionnelle des îlots au cours de la vie. An de
déterminer quels gènes sont responsables d’une telle
maturation, ces auteurs ont étudié le transcriptome
des îlots par la technique de micro-array. Ils ont ainsi
trouvé que certains gènes étaient sur- ou sous-exprimés
dans les îlots adultes par rapport aux nouveau-nés.
Parmi eux, le gène MafA – qui intervient normalement
dans la maturation des cellules bêta au cours du déve-
loppement embryonnaire – avait une expression plus
élevée chez l’adulte. An de connaître l’importance de
MafA dans l’évolution fonctionnelle de la cellule bêta,
l’équipe du Dr S. Bonner-Weir a transfecté des îlots de
nouveau-nés avec un adénovirus surexprimant le gène
MafA. Ils ont alors obtenu une sécrétion d’insuline en
réponse au glucose identique dans les îlots de nouveau-
nés surexprimant MafA et dans les îlots adultes. Ces
résultats montrent donc que MafA est responsable de la
maturation fonctionnelle de la cellule bêta au cours de
la vie postnatale. De façon intéressante, S. Bonner-Weir
et al. ont trouvé que des îlots provenant d’individus
atteints de diabète de type 2 avaient également des
défauts de l’expression de MafA. Les données générées
à partir de l’étude biologique de la cellule bêta pour-
raient donc être transférées maintenant à l’homme
pour comprendre les mécanismes impliqués dans le
diabète de type 2.
Épigénétique et vieillissement
de la cellule bêta
(d’après le symposium de S. Dhawan)
S. Dhawan et al. ont comparé les capacités de prolifé-
ration des cellules bêta au cours de la vie de l’individu.
Au cours de la vie embryonnaire, les cellules bêta se
diérencient, et leur prolifération augmente pendant la
vie périnatale. La prolifération atteint alors un pic pen-
dant les premiers jours après la naissance, puis décroît
chez l’adulte. Cela correspond à un vieillissement de
la cellule. S. Dhawan et al. ont trouvé que l’expression
de p16Ink4a, un inhibiteur du cycle cellulaire, aug-
mente avec l’âge, lorsque la prolifération des cellules
bêta décroît. Au contraire, l’expression de l’oncogène
Bmi1, un régulateur négatif de p16Ink4a, diminue au
cours du temps. Bmi1 est un membre du complexe
Polycomb, impliqué dans le contrôle de la structure de
la chromatine. An de déterminer le rôle de Bmi1 au
cours du vieillissement de la cellule bêta, ces auteurs
ont invalidé le gène Bmi1 chez la souris. Ils ont alors

Correspondances en Métabolismes Hormones Diabètes et Nutrition - Vol. XIII - n° 5 - septembre-octobre 2009
176
Échos des congrès
observé une élévation très importante de l’expression
de p16Ink4a et une diminution de la prolifération des
cellules bêta. Cela prouve que la signalisation par Bmi1/
p16Ink4a joue un rôle important dans le vieillissement
des cellules bêta, et en particulier dans leur capacité à
proliférer. La voie Bmi1/p16Ink4a pourrait représenter
un outil important pour contrôler la prolifération des
cellules bêta au cours du diabète de type 2.
Quelles sont les capacités de régénération
du pancréas humain ?
(d’après le symposium de J.J. Meier)
Comme décrit précédemment chez la souris, J.J. Meier
et al. ont trouvé que les capacités de prolifération des
cellules bêta diminuent avec l’âge des individus. Les
auteurs ont cherché à savoir si de potentielles similitudes
existent entre les capacités de régénération du pancréas
de rongeurs et celles du pancréas humain. Ils ont trouvé
que, chez un patient âgé de 89 ans et atteint d’un diabète
de type 1 tardif, quelques cellules bêta proliféraient,
suggérant des possibilités de régénération. Chez la souris
NOD, l’injection de gastrine et d’epidermal growth factor
(EGF) induit un certain niveau de régénération. La gas-
trine est une hormone sécrétée par la partie inférieure
de l’estomac, le duodénum et le jéjunum. Elle favorise la
sécrétion acide, mais aussi le renouvellement cellulaire
de l’épithélium stomacal et intestinal. Sa sécrétion est
stimulée par l’EGF. Son mécanisme d’action est inconnu
à l’heure actuelle. De façon surprenante, J.J. Meier et
al. ont trouvé une hyperplasie des îlots à proximité de
gastrinomes chez l’homme. Ces données suggèrent que
la gastrine pourrait avoir un rôle dans l’amplication
de la masse des cellules bêta chez l’homme. Enn, les
auteurs ont comparé les capacités de régénération du
pancréas de souris et du pancréas humain lors d’une
pancréatectomie partielle. Chez la souris, la pancréatec-
tomie partielle entraîne une régénération des cellules
bêta, presque totale à 15 jours postpancréatectomie.
J.J. Meier et al. ont pu suivre des patients ayant subi deux
pancréatectomies partielles successives et ont analysé
des biopsies. À la diérence de la souris, ils ont observé
une diminution de la surface des cellules bêta et une
hyperglycémie. En conclusion, les capacités de régéné-
ration du pancréas humain sont faibles par rapport à
celles de la souris, mais elles pourraient être stimulées,
par exemple par la gastrine.
Conclusion
Les avancées récentes concernant les grees d’îlots
et la néogenèse des cellules pancréatiques bêta nous
autorisent à penser qu’à long terme, le remplacement
des cellules bêta endommagées représente une straté-
gie thérapeutique curative envisageable. En attendant
de tels succès, l’amélioration des traitements médi-
camenteux devrait permettre d’optimiser le contrôle
glycémique et le bien-être des patients.
■
Abonnez-vous en ligne !
Bulletin d’abonnement
disponible page 207
www.edimark.fr
1
/
3
100%