Shigella DES - Pôle de Biologie Pathologie Génétique

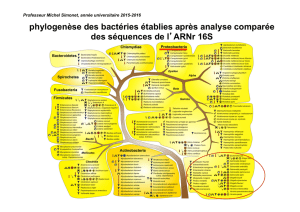
phylogenèse des bactéries établies après analyse comparée
des séquences de l’ARNr 16S (horloge évolutionnaire)
Professeur Michel Simonet, année universitaire 2013-2014

entérobactéries
arbre établi à partir des séquences du facteur d’élongation Tu
(International Journal of Systematic & Evolutionary Microbiology, 2005)
! des bacilles aérobies-anaérobies
! sans exigence culturale particulière
! cytochrome oxydase -
! catalase +
! nitrate-réductase +
! fermentant le glucose
γ-proteobactéries

Klebsiella pneumoniae
des diplobacilles entourés d’une capsule
Escherichia coli
des bacilles polymorphes à coloration bipolaire
des bactéries à Gram négatif

Klebsiella pneumoniae
Escherichia coli Proteus mirabilis
Serratia marcescens

Enterobacter cloacae
Klebsiella pneumoniae
Serratia marcescens
VP+
+
-
+ - - - -- + + +
+ -
+ -- - -- + + +
+
-
+ -- - - + + + +
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
1
/
35
100%



![Télécharger la fiche technique [120.43 Ko PDF]](http://s1.studylibfr.com/store/data/000674177_1-17ee923c1234f9f2353ebcf5ad682c82-300x300.png)






