Cycle de l’acide citrique Cycle des acides tricarboxyliques Cycle de Krebs L Bermont

Cycle de l’acide citrique
ou
Cycle des acides tricarboxyliques
ou
Cycle de Krebs
Biochimie Métabolique
2
è
Année Pharmacie
UFR Sciences Médicales et Pharmaceutiques Besançon
L Bermont

Introduction
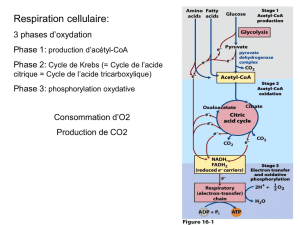
Ce cycle rend compte de la majeure partie de l’oxydation :
- des glucides
- des acides gras
- des acides aminés
Il est amphibolique, i.e qu’il intervient à la fois dans :
- des réactions cataboliques et,
- des réactions anaboliques
Il est constitué d’une suite de réactions qui oxydent le groupement
acétyle de l’acétyl-CoA en 2 molécules de CO
2
, selon un processus
permettant de récupérer l’énergie libre disponible pour la synthèse
d’ATP
Cycle de l’acide citrique

Introduction
Le précurseur immédiat de l’acétyl-CoA lors de la dégradation des
glucides est le pyruvate, produit de la glycolyse
Dans des conditions anaérobies, le NADH formé au cours de la
glycolyse, est réoxydé avec le réduction concomitante de pyruvate
en lactate (dans le muscle)
Cycle de l’acide citrique

Introduction
Dans des conditions aérobies, le NADH est réoxydé dans la chaîne
respiratoire mitochondriale
Le pyruvate peut alors entrer dans la mitochondrie via un système
symport pyruvate-H
+
et subir une oxydation plus poussée
L’oxydation des acides gras et de certains acides aminés peut
également conduire à la formation d’acétyl-CoA
Ainsi, l’acétylCoA est un véritable carrefour métabolique
intégrant le catabolisme des glucides, des acides gras et des acides
aminés
Cycle de l’acide citrique

I- Passage à l’oxydation aérobie du pyruvate
1.1 La Pyruvate DésHydrogénase
La décarboylation oxydative du pyruvate conduit à l’acétyl-CoA,
réaction catalysée par la Pyruvate DésHydrogénase (PDH,
mitochondrie
)
La PDH est un complexe multienzymatique composé de 3 enzymes :
- la pyruvate déhydrogénase (E1)
- la dihydrolipoyle transacétylase (E2)
- la dihydrolipoyle déshydrogénase (E3)
Chez les eucaryotes la PDH est un complexe de structure
dodécaédrique (12 faces)
de 10 000 kDa composé à partir de :
- 30 dimères E1
- 60 dimères E2
- 6 dimères E3
Intérêts : - Augmentation des interactions E-S et de la vitesse
- Guidage des substrats au sein du complexe
- Régulation coordonnée des activités enzymatiques
Cycle de l’acide citrique
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
1
/
33
100%