Le système réglementaire français: mutations et sanctions

10
Réglementation
DeviceMed France | Juillet/Août 2012 | www.devicemed.fr
Le système réglementaire
français: mutations et sanctions
Le champ réglementaire français des dispositifs médicaux a connu récemment
d’importantes remises en cause suite aux affaires Médiator et PIP. Un climat
de méfiance s’est développé envers le système français de police sanitaire et
le secteur industriel. Le point sur les grands axes de ces futures mutations.
Antoine Disset, AD-DM Consulting et Faraj Abdelnour, ACIDIM
L
a mise sur le marché étant une
procédure européenne, des exi-
gences nationales ont été annoncées
par la loi n°2011-2012 du 29 dé-
cembre 2011 sur le renforcement de
la sécurité sanitaire du médicament
et des produits de santé dite « Loi
Bertrand », bien que l’Europe n’ait
pas été consultée de ces futurs chan-
gements.
De plus, la loi de finances de la
Sécurité sociale 2012 (LFSS 2012)
renforce ces exigences réglemen-
taires par des dispositions écono-
miques qui tendent à amplifier la
barrière existante en ce qui concerne
l’arrivée sur le marché de certains
dispositifs médicaux dits à haut
risque. La FDA (Food and Drug Ad-
ministration) s’invite au débat par
une récente publication faisant part
de quelques dispositifs médicaux
approuvés et utilisés sur les patients
en Europe alors que la FDA ne s’est
pas prononcée sur leur sécurité,
voire leur efficacité (cf http://www.
elsevierbi.com/~/media/Supporting
%20Documents/The%20Gray%20
Sheet/38/20/FDA_EU_Devices_Re-
port.pdf)
Un sujet qui fait couler
beaucoup d’encre
Le nouveau paysage français résulte
des différents travaux dont le rapport
SAUVE du 26 janvier 2011 sur les
conflits d’intérêt, les rapports de
l’IGAS (Inspection Générale des Af-
faires Sociales) des 15 Janvier et 21
Juin 2011 et les discussions et rapport
des « Assises du Médicament » du 23
Juin 2011 agrémentés de trois mis-
sions parlementaires dont celles:
• A l’Assemblée nationale sur l’or-
ganisation de la pharmacovigilance,
présidée par le député Gérard Bapt et
dont le rapporteur est le député Jean-
Pierre Door ;
• Au Sénat sur l’évaluation et le
contrôle des médicaments, présidée
par le sénateur François Autain et
dont la rapporteur est la sénatrice
Marie-Thérèse Hermange (28 juin
2011) ;
• A l’Assemblée nationale sur le
système des agences de sécurité sani-
taire, présidée par le député Yves Bur.
Une évolution selon trois
grandes orientations
Les futures mutations du système fran-
çais s’orientent autour de trois axes :
• la gouvernance couvrant l’orga-
Bild: iStock/onurdongel

11
Réglementation
www.devicemed.fr | Juillet/Août 2012 | DeviceMed France
nisation des agences sanitaires avec une
réforme des autorités concernées et de
leurs responsabilités ;
• la transparence des liens d’intérêt
et surtout les relations avec les profes-
sionnels de santé ; et enfin
• le cadre spécifique de la publicité
dans le domaine des dispositifs médi-
caux.
Ces nouvelles dispositions, qui de-
vront être confirmées par des décrets en
Conseil d’Etat, s’accompagnent de
sanctions pénales et financières à l’égard
des industriels et des professionnels de
santé. Enfin, le renforcement de toutes
ces mutations / dispositions est com-
plété par des exigences supplémen-
taires, dictées par la LFSS 2012 et mo-
difiant les règles de prise en charge /
remboursement de certains dispositifs
médicaux.
La gouvernance de la
nouvelle agence sanitaire
Trois sénateurs et trois députés siègeront
désormais au Conseil d’administration
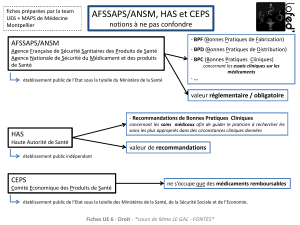
de la nouvelle agence, l’ANSM (Agence
Nationale de Sécurité du Médicament
et des produits de santé), qui succède à
l’AFSSaPS mise en cause notamment
dans sa dépendance. La nouvelle gou-
vernance dessinée par la loi Bertrand a
pour but de renforcer le contrôle par le
pouvoir législatif des orientations et des
travaux de l’ANSM. Cette agence dis-
posera également d’un nouveau conseil
scientifique qui veillera à la cohérence
de la stratégie scientifique qu’elle
adoptera et donnera des avis sur les
orientations et la programmation
scientifique de ses travaux.
«La publicité, définie d’une manière plus
large, inclut tous les médias ayant une visée
promotionnelle.»
Faraj Abdelnour, Président de l’ACIDIM
b

12
Réglementation
DeviceMed France | Juillet/Août 2012 | www.devicemed.fr
Le décret relatif à l’ANSM traite
d’autres aspects de la gouvernance et
modifie la dépendance financière de
l’Agence. Les paiements, taxes et rede-
vances de l’Agence sanitaire doivent
être réglés dorénavant à l’Etat. A l’ave-
nir, l’Etat versera une allocation à
l’ANSM pour la réalisation de ses res-
ponsabilités et travaux en fonction des
demandes enregistrées et délivrera un
reçu à l’industriel, en contrepartie des
travaux réalisés par l’Agence comme
par exemple le visa de publicité d’un
dispositif médical ou bien l’autorisation
de mise sur le marché d’un médicament.
La transparence des liens
d’intérêt
La déclaration des liens d’intérêt des
professionnels sollicités pour une ex-
pertise auprès d’une autorité publique
(e.g. ANSM, HAS, etc.) existe déjà mais
serait structurée sous forme d’une Dé-
claration Publique d’Intérêt (DPI). Dans
la nouvelle disposition de la loi Ber-
trand, ces DPI devraient être rendues
publiques ; cette même loi élargit le
champ de ces déclarations aux étu-
diants, organismes de formation et as-
sociations de patients. Rendue doréna-
vant obligatoire et rétroactive sur 5 ans,
cette disposition devrait être explicitée
par des décrets en Conseil d’Etat et im-
pose la mise à jour, dès lors qu’une évo-
lution intervient. Des sanctions pénales
et financières seront appliquées le cas
échéant (5 ans d’emprisonnement et
75000 euros d’amende).
De plus, à l’instar des dispositions
du texte américain « Physician Payment
Sunshine Act » de 2010, les industriels
seront tenus de publier sur un site in-
ternet tous leurs liens avec les profes-
sionnels de santé, associations, sociétés
savantes, organismes de formation, mé-
dias du secteur de la santé etc. Enfin,
le texte prévoit que les conventions et/
ou avantages soient publiés dans leur
intégralité sur ce site, sans limitation de
montant et à partir de 1 euro. Le cas
échéant, des sanctions financières de
l’ordre de 10% HT du CA associées de
sanctions pénales pour les personnes
physiques seront appliquées.
La publicité pour les DM
La législation autour de la publicité
pour les dispositifs médicaux n’est pas
une nouveauté. Cependant, la loi intro-
duit une modification de celle-ci et im-
pose des conditions basées sur celles du
médicament. La publicité, définie d’une
manière plus large, inclut tous les mé-
dias ayant une visée promotionnelle.
Ne sont pas concernés l’étiquetage et la
notice d’instruction, la correspondance
en réponse à une question précise, les
informations sur une mise en garde, les
précautions d’emploi et les informa-
tions institutionnelles (sans référence,
même indirecte à un DM). Il y a une
interdiction de principe de la publicité
pour les DM remboursables à l’excep-
tion des DM évalués comme présentant
un faible risque pour la santé publique.
Pour le DM non remboursable présen-
tant un risque important pour la santé,
une autorisation préalable devra être
sollicitée auprès de l’ANSM, renouve-
lable tous les 5 ans. Le Ministère de la
Santé publiera par arrêtés les listes des
dispositifs médicaux assujettis à cette
« déclaration a priori » de publicité.
Des sanctions administratives finan-
cières et pénales (deux ans d’emprison-
nement et 30000 euros d’amende)
pourront être appliquées si une entre-
prise ne respecte pas cette obligation.
Principaux textes
redéfinissant le champ
réglementaire français
• Loi n°2011-2012 du 29
décembre 2011 «Renforcement
de la sécurité sanitaire du
médicament et des produits de
santé »
• Décret n° 2012-597 du 27 avril
2012 relatif à l‘Agence natio-
nale de sécurité du médica-
ment et des produits de santé
• Décret du Président de la
République en date du 1er mai
2012, le Professeur Dominique
Maraninchi, ancien directeur
général de l’Afssaps, est
nommé directeur général de
l’ANSM
• Décret n° 2012-743 du 9 mai
2012 relatif à la publicité pour
les dispositifs médicaux
• Décret n° 2012-744 du 9 mai
2012 relatif à la publicité pour
les dispositifs médicaux de
diagnostic in vitro
• Décret n° 2012-745 du 9 mai
2012 relatif à la déclaration
publique d‘intérêts et à la trans-
parence en matière de santé
publique et de sécurité sanitaire
«La législation autour de la publicité pour
les dispositifs médicaux n’est pas une
nouveauté. Cependant, la loi introduit une
modification de celle-ci et impose des condi-
tions basées sur celles du médicament.»
Antoine Disset, AD-DM Consulting

13
Réglementation
www.devicemed.fr | Juillet/Août 2012 | DeviceMed France
AD-DM Consulting
F-34000 Montpellier
www.ad-dmconsulting.com
Nouvelles missions
d’évaluation des DM pris
en charge par l’assurance
maladie
La loi Bertrand a ajouté deux nouvelles
missions d’évaluation des dispositifs
médicaux pris en charge par l’assurance
maladie.
D’une part, elle attribue des mis-
sions complémentaires à l’ANSM, lui
permettant de vérifier (directement ou
par organismes compétents) l’exacti-
tude des éléments fournis sur un DM
quant à son adéquation avec la descrip-
tion d’une ligne générique de la LPPR
(article L.165-1 du Code de la Sécurité
Sociale). Dans le cas où un dispositif ne
réponde pas exactement à la descrip-
tion de la ligne générique, le nouvel
article L165-1-2 du Code de la Sécu-
rité Sociale prévoit des peines allant
jusqu’à 10% du chiffre d’affaires réa-
lisé par l’entreprise en France pour le
DM désigné. Cette entreprise peut ain-
si être contrainte de rembourser les
sommes perçues illégalement.
D’autre part, elle entérine la mission
d’évaluation des dispositifs médicaux
utilisés dans les hôpitaux dans le cadre
de la tarification à l’activité (T2A - éva-
luation intra-GHS). Cette mission avait
été initiée en 2009 par le Pr Dubernard
(président de la CNEDiMTS) suite au
constat selon lequel un dispositif pou-
vait être pris en charge financièrement
dans le cadre d’un GHS sans avoir été
évalué par la CNEDiMTS. Les deux
premières évaluations sur les colles et
hémostatiques à usage chirurgical et les
systèmes de cicatrisation par pression
négatives ouvrent un champ d’évalua-
tion gigantesque. Reste à connaître
comment le service d’évaluation des
DM de la HAS –SED, Service d’évalua-
tion des dispositifs- va organiser ces
deux nouvelles missions.
A la lecture des lois et des quelques
décrets d’application décrits ci-dessus,
il apparaît que les dispositions demeu-
rent incomplètes pour être appliquées.
Un certain nombre de décrets et d’arrê-
tés restent en effet à publier. Cette si-
tuation est rendue plus complexe par la
nouvelle « gouvernance » au Ministère
la santé induite par le changement élec-
toral. Les orientations en matière de
sécurité sanitaire du nouveau Ministre
des Affaires Sociales et de la Santé Ma-
dame Marisol Touraine demeurent à
confirmer. La loi Bertrand, destinée à
introduire plus de vertu et de transpa-
rence, a entraîné une situation de blo-
cage et de méfiance. Les dispositions
décrites semblent rappeler l’époque de
l’homologation française où des listes
décidées par un pouvoir central dic-
taient le choix d’un DM aux spécialistes
utilisateurs ; cette époque semblait
révolue, mais l’avenir nous en dira
davantage…
1
/
4
100%