Diagnostic et prise en charge de la dysplasie au cours

32 | La Lettre de l’Hépato-gastroentérologue • Vol. XIV - n° 1 - janvier-février 2011
MISE AU POINT
Cancer colorectal sporadique
Cancer colorectal associé aux maladies
inammatoires chroniques de l’intestin
APC
APC
Muqueuse
normale
Absence
de dysplasie Dysplasie
indénie Dysplasie
de bas grade Dysplasie
de haut grade
Adénome
précoce Adénome
intermédiaire Adénome
avancé Carcinome
Carcinome
p53
p53 Mut.
p53 LOH
DCC/DPC4
DCC/DPC4
MSI
K-ras
K-ras
APC : Adenomatous polyposis coli ; DCC : deleted in colorectal cancer ; DPC4 : deleted in pancreatic cancer 4.
Figure 1. Altérations génétiques contribuant au développement du cancer colorectal
sporadique (haut) et du cancer colorectal associé aux maladies inflammatoires chroniques
de l’intestin (bas). La perte de la fonction APC survient précocement au cours de la carcino-
genèse du cancer sporadique, alors que l’altération du gène p53 survient tardivement.
Dans le cas de la carcinogenèse associée aux maladies inflammatoires chroniques de
l’intestin, l’altération du gène p53 survient précocement, avant l’apparition de la dysplasie,
alors que la mutation du gène APC survient tardivement (d’après Itzkowitz, et al. [6]).
Diagnostic et prise en charge
de la dysplasie au cours
des maladies inflammatoires
chroniques de l’intestin
Diagnosis and management of dysplasia in patients
with inflammatory bowel diseases
Abderrahim Oussalah, Laurent Peyrin-Biroulet*
* Inserm U954, université Henri-
Poincaré, Nancy 1, service d’hépato-
gastroentérologie, CHU de Nancy,
Vandœuvre-lès-Nancy.
L
e cancer colorectal (CCR) représente l’une des
complications les plus redoutées des maladies
inflammatoires chroniques de l’intestin (MICI).
Depuis la publication par Morson et al., en 1967, d’une
étude ayant suggéré que la présence d’une dysplasie sur
une biopsie non dirigée de la muqueuse rectale était
associée à la présence d’un cancer invasif dans le reste
du côlon (1), les experts ont recommandé la surveillance
endoscopique au cours des MICI, avec la réalisation de
biopsies coliques systématiques dans le but de recher-
cher une dysplasie de la muqueuse colique (2). Les MICI
sont relativement rares dans la population générale, et
moins de 1 % de tous les cas de CCR sont attribués à une
MICI (3). Néanmoins, les MICI représentent l’une des
trois conditions à haut risque de CCR, avec la polypose
adénomateuse familiale et le syndrome de Lynch (4).
Il en découle que le CCR au cours des MICI représente
une problématique majeure aussi bien du point de vue
du patient que de celui du médecin.
Cette revue envisage les différents aspects de l’épidé-
miologie, de la biologie moléculaire, du diagnostic, du
traitement, de la chimioprévention et de la surveillance
de la dysplasie et du CCR au cours des MICI.
Biologie moléculaire
du cancer colorectal au cours
des maladies inflammatoires
chroniques de l’intestin
Le mécanisme exact par lequel l’inflammation
conduit à la carcinogenèse au cours des MICI n’est
pas clairement élucidé. L’inflammation persistante
entraîne une prolifération cellulaire et un stress
oxydatif menant à la dysplasie (5). Les différentes
altérations génétiques observées au cours du CCR
sporadique le sont également dans le CCR sur MICI,
mais avec une séquence et une fréquence diffé-
rentes (4). Ces événements incluent l’instabilité
des microsatellites, l’inhibition des gènes par hyper-
méthylation du promoteur et la perte de fonction
des gènes APC (adenomatous polyposis coli), p53 et
K-ras (figure 1) [6].

La Lettre de l’Hépato-gastroentérologue • Vol. XIV - n° 1 - janvier-février 2011 | 33
Points forts
»Le consensus ECCO
(European Crohn’s and Colitis Organisation)
recommande la réalisation d’une colo-
scopie de surveillance chez tous les patients ayant une RCH, 8 à 10 ans après le début des symptômes.
»
Il est actuellement recommandé que les patients avec une MC colique atteignant plus d’un tiers du côlon
bénéficient d’un programme de surveillance endoscopique à partir de la 8
e
année d’évolution de leur maladie.
»
Les biopsies systématiques aux 4 quadrants, tous les 10 cm ainsi que sur toutes les lésions visibles,
doivent être réalisées au cours de la coloscopie de surveillance. Dans les mains d’un endoscopiste entraîné,
la chromoendoscopie au bleu de méthylène ou à l’indigo carmin est une alternative supérieure aux biopsies
systématiques.
»Le consensus ECCO recommande, en l’absence de contre-indication, l’utilisation de la mésalazine chez
tous les patients présentant une RCH, dans le cadre de la chimioprévention du CCR.
Mots-clés
Dysplasie
Cancer colorectal
Coloscopie
de surveillance
Chimioprévention
Rectocolite
hémorragique
Maladie de Crohn
Maladies
inflammatoires
chroniques
de l’intestin
Keywords
Dysplasia
Colorectal cancer
Surveillance colonoscopy
Chemoprevention
Ulcerative colitis
Crohn’s disease
Inflammatory bowel diseases
Facteurs de risque du cancer
colorectal au cours
des maladies inflammatoires
chroniques de l’intestin
Facteurs de risque étudiés au cours
de la rectocolite hémorragique
La durée et l’étendue de la colite sont des facteurs
de risque bien établis pour le développement d’un
CCR au cours de la rectocolite hémorragique (RCH).
Les patients ayant une durée de la maladie supé-
rieure à 10 ans et ceux avec une pancolite présentent
le risque le plus élevé de CCR. Le taux d’incidence
du CCR augmente avec chaque décade d’évolution
de la MICI, avec des probabilités cumulées de 2 %
à 10 ans, 8 % à 20 ans et 18 % à 30 ans (7). Néan-
moins, des données récentes (8-11) sug gèrent que
les taux d’incidence issus de la méta-analyse de
J.A. Eaden (7) surestiment le risque réel. L’étendue
de la colite représente un facteur de risque reconnu
du CCR (7, 12). Dans une étude suédoise, les ratios
d’incidence standardisés de CCR étaient de 1,7
(IC
95
: 0,8-3,2) chez les patients avec une proctite
et de 2,8 (IC95 : 1,6-4,4) en cas de colite gauche, et
augmentaient jusqu’à 14,8 (IC
95
: 11,4-8,9) chez les
patients avec une pancolite (12). Les autres facteurs
de risque récemment identifiés de CCR au cours de
la RCH sont les suivants : un âge jeune au diagnostic
de la MICI (< 20 ans) [12], un antécédent familial
de CCR (13-16) et le degré de sévérité de l’inflam-
mation histologique (17, 18). Bien qu’une étude
ancienne (19) ait démontré un lien entre l’iléite de
reflux (backwash ileitis) et le CCR, une étude récente
n’a pas confirmé cette association (20).
Facteurs de risque étudiés au cours
de la maladie de Crohn
Le risque de CCR au cours de la MC pancolique
est identique à celui observé au cours de la RCH
pancolique (21, 22). L’étude de la cohorte suédoise
d’Uppsala de 1 655 patients a démontré un risque
relatif (RR) de CCR de 5,6 en cas de MC colique,
de 3,2 en cas d’iléocolite et de 1,0 en cas d’iléite (23).
Une méta-analyse sur 12 études, incluant des études
de population et des séries de centres référents, a
démontré un surrisque de CCR au cours de la MC
(RR = 2,5 ; IC
95
: 1,3-4,7) [24]. Il est actuellement
recommandé que les patients avec une MC colique
atteignant plus d’un tiers du côlon bénéficient d’un
programme de surveillance endoscopique à partir de
la huitième année d’évolution de leur maladie (25).
Cas particulier : la cholangite
sclérosante primitive associée
aux maladies inflammatoires
chroniques de l’intestin
Dans une méta-analyse ayant inclus 11 études, la
coexistence d’une cholangite sclérosante primitive
(CSP) avec une MICI expose à un risque 4 fois plus
élevé de CCR chez les patients avec une RCH que
chez les patients sans CSP (OR = 4,09 ; IC95 : 2,89-
5,76) [26]. Du fait du risque très élevé de CCR en cas
de CSP associée à la MICI, une surveillance endosco-
pique annuelle est recommandée dès le diagnostic
de CSP (6). Les patients avec un diagnostic initial
de CSP sans symptômes digestifs associés doivent
bénéficier d’une coloscopie avec biopsies afin de
rechercher une colite.
Le consensus ECCO (European Crohn’s and Colitis
Organisation) retient les facteurs suivants comme
étant associés à un risque élevé de CCR : une panco-
lite (niveau de preuve [NP] 2), un âge au diagnostic de
la MICI inférieur à 20 ans (NP 2), une CSP associée
(NP 2), une inflammation colique persistante (NP 3),
et un antécédent familial de CCR (NP 3).
Diagnostic de la dysplasie
colique au cours des maladies
inflammatoires chroniques
de l’intestin
La dysplasie est une néoplasie épithéliale n’ayant
pas franchi la lame basale (sans aucune invasion de
la lamina propria) [27]. La dysplasie représente une
phase prémaligne au cours de laquelle une inter-
vention pourrait prévenir ou minimiser le risque de

34 | La Lettre de l’Hépato-gastroentérologue • Vol. XIV - n° 1 - janvier-février 2011
MISE AU POINT Diagnostic et prise en charge de la dysplasie au cours des MICI
cancer invasif (4). D’un point de vue endoscopique,
la dysplasie peut être plane ou surélevée. La dysplasie
plane peut être uni- ou multifocale. La dysplasie en
muqueuse plane est classiquement considérée comme
endoscopiquement invisible, et sa détection repose
sur les biopsies systématiques. Le CCR sur MICI se
développe selon la séquence inflammation chronique-
dysplasie de bas grade (DBG)-dysplasie de haut grade
(DHG)-cancer. Pour cette raison, les patients sont
intégrés dans un programme de surveillance endo-
scopique dans le but de détecter l’apparition de la
dysplasie avant celle du CCR. La fiabilité du système
de surveillance repose sur trois piliers : le gastro-
entérologue, l’anatomo-pathologiste, le patient (2).
Rôle du gastroentérologue
Le gastroentérologue doit : 1. identifier les patients
MICI qui nécessitent une surveillance ; 2. examiner la
muqueuse colorectale à la recherche d’une dysplasie ;
3. adapter la prise en charge de chaque patient en
fonction des données de l’étude anatomopatho-
logique ; 4. veiller au suivi endoscopique du patient
(2). La conférence de consensus de la CCFA (Crohn’s
and Colitis Foundation of America) sur la surveillance
du CCR au cours des MICI a recommandé la réalisa-
tion d’au moins 32 biopsies lors de chaque coloscopie
de surveillance, en pratiquant 4 biopsies en quadrant
tous les 10 cm (25). Chaque groupe de 4 biopsies doit
être placé dans un tube séparé, ainsi que les biopsies
réalisées sur les lésions surélevées ou suspectes (25).
Afin de pallier les insuffisances de l’échantillonnage,
de nouvelles techniques d’endoscopie ont été déve-
loppées. L’amélioration de la technologie des puces
vidéo a entraîné une identification plus fréquente des
lésions polypoïdes associées aux MICI. La chromo-
endoscopie, au bleu de méthylène ou à l’indigo
carmin, permet d’améliorer la détection des lésions
subtiles de la muqueuse colique en augmentant la
sensibilité de l’examen endoscopique (2, 4, 28-31). De
nouvelles techniques d’endoscopie pourraient faci-
liter l’identification des lésions de dysplasie : parmi
elles, on retrouve le narrow-band imaging (NBI) [32]
et l’endomicroscopie confocale (33).
Rôle de l’anatomopathologiste
Selon Riddell et al., le diagnostic histologique de
dysplasie est classé en trois catégories : 1. absence
de dysplasie ; 2. présence d’une dysplasie (DBG ou
DHG) ; 3. dysplasie indéfinie (27). Cette classifica-
tion souffre d’un manque de concordance entre les
anatomopathologistes experts et non experts (34).
Le consensus de la CCFA et la U.S. Multisociety Task
Force recommandent la réalisation d’un second examen
des biopsies par un anatomopathologiste indépendant
avant la prise de décision définitive (25, 35).
Considérations liées au patient
Le rôle du patient dans la surveillance du CCR au
cours des MICI est le plus critique et le moins étudié.
Dans le contexte d’une MICI, le patient doit adhérer
au programme de surveillance endoscopique et
prendre en compte les options de prise en charge
proposées par le gastroentérologue (2). Dans une
enquête utilisant un questionnaire auto-administré
et menée sur 199 patients avec une RCH évoluant
depuis plus de 8 ans, 60 % des patients refusaient
la colectomie élective en cas de dysplasie, malgré
un risque encouru de CCR de l’ordre de 20 % (36).
L’analyse des données de cette étude a démontré
que les patients n’acceptaient la réalisation d’une
colectomie élective que si le risque de CCR encouru
dépassait 73 % (36). Cette étude, bien que menée sur
un échantillon relativement faible, démontre la diffi-
culté d’application d’un programme de surveillance
du CCR au cours des MICI.
Prise en charge de la dysplasie colique
au cours des maladies inflammatoires
chroniques de l’intestin
L’appellation de DALM (dysplasia-associated lesion or
mass) a été utilisée pour décrire des lésions dyspla-
siques surélevées en endoscopie (2). Les DALM qui
présentent un aspect endoscopique similaire à celui
des adénomes sporadiques sont appelées adenoma-
like DALM. Les non-adenoma-like DALM sont des
lésions qui ne sont pas résécables endoscopique-
ment et dont la prise en charge est chirurgicale (2).
Contrairement aux non-adenoma-like DALM, les
adenoma-like DALM peuvent être traitées par une
polypectomie, avec des biopsies réalisées autour de
la muqueuse plane en circonférence de la lésion suré-
levée (37). Si la lésion est complètement reséquée et
que la muqueuse environnante en circonférence ne
comporte pas de dysplasie, une surveillance rappro-
chée par coloscopie est indiquée. La mise en évidence
d’une dysplasie dans la muqueuse plane avoisinante
à la lésion surélevée impose la colectomie, compte
tenu du risque élevé de progression vers le cancer.

La Lettre de l’Hépato-gastroentérologue • Vol. XIV - n° 1 - janvier-février 2011 | 35
MISE AU POINT
Absence
de dysplasie Dysplasie
indénie Dysplasie
en muqueuse plane
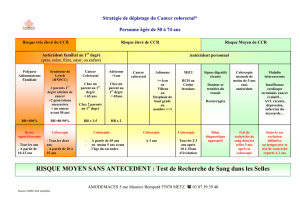
Première coloscopie de surveillance après 8 ans d’évolution d’une colite
Biopsie aux 4 quadrants tous les 10 cm en muqueuse plane
Résection de toutes les lésions surélevées, biopsies sur la base
des lésions reséquées et sur la muqueuse colique environnante
DALM
Bas grade Haut grade Non-adenoma-
like DALM Adenoma-like
DALM
Unifocale Multifocale
Traiter
l’inammation
Coloscopie
dans 1 à 2 ans Coloscopie
dans 3 à 6 mois Coloscopie
dans 6 mois
Proctocolectomie
Dysplasie
sur la muqueuse
adjacente
Polypectomie
Absence
de dysplasie
sur la muqueuse
adjacente
Figure 2. Algorithme décisionnel chez un patient présentant une dysplasie au cours d’une
maladie inflammatoire chronique de l’intestin (d’après Zisman et al. [39]).
Adenoma-like dysplasia-associated
lesion or mass
La prise en charge des adenoma-like DALM dépend
de la taille, de l’aspect et de la résécabilité complète
de la lésion par l’endoscopie interventionnelle. Odze
et al. ont démontré que la résection endoscopique
des adenoma-like DALM par les techniques standard
avait un faible risque de dégénéréscence (37).
Le consensus ECCO et l’AGA (American Gastroen-
terological Association) recommandent, en l’ab-
sence de dysplasie entourant la lésion surélevée, la
réalisation d’une résection endoscopique (ECCO :
NP 2b, grade B ; AGA : grade A) [28]. Si la résection
endoscopique n’est pas possible ou si la dysplasie
est mise en évidence autour de la lésion surélevée, la
proctocolectomie est recommandée (ECCO : NP 2b,
grade B ; AGA : grade A) [figure 2] (28, 38).
Dysplasie de haut grade
en muqueuse plane
Dans une revue systématique, 42 % des patients
présentant une DHG avaient un CCR sur la pièce de
colectomie (40). Ces données indiquent clairement
que la colectomie représente le traitement de choix
des patients présentant une DHG, qu’elle soit résé-
quée incomplètement ou bien mise en évidence sur un
examen histopathologique de biopsies non dirigées.
Le consensus ECCO et l’AGA recommandent la
réalisation d’une proctocolectomie en cas de DHG
en muqueuse plane (ECCO : NP 2, grade B ; AGA :
grade A) [figure 2] (28, 38).
Dysplasie de bas grade
en muqueuse plane
Une méta-analyse récente a conclu que les patients
présentant une DBG avaient un risque douze fois
plus élevé (OR = 11,9 ; IC
95
: 5,2-27) de développer
une lésion colique avancée que les patients sans
dysplasie (41). Néanmoins, une variation significative
est retrouvée dans les taux de progression de la DBG
vers la DHG ou le CCR (38).
En cas de DBG en muqueuse plane, le consensus
ECCO recommande soit la réalisation d’une procto-
colectomie, soit la réalisation d’une coloscopie après
3 à 6 mois (NP 2b, grade B) [28]. L’AGA recommande
dans ce cas de figure une décision au cas par cas
et en concertation entre gastroentérologues et
chirurgiens (38). Si la DBG en muqueuse plane est
détectée sur plusieurs coloscopies, si elle est multi-
focale (plusieurs sites sur la même coloscopie), ou
si elle est découverte au moment de la première
coloscopie de surveillance, la colectomie paraît
légitime (38). Il est primordial dans cette situation
que l’avis d’un pathologiste expert en pathologie
digestive soit pris (figure 2) [38].
Dysplasie indéfinie
Au cours des processus inflammatoires coliques, la
réparation de l’épithélium peut entraîner des modi-
fications histopathologiques mimant la dysplasie :
c’est la dysplasie indéfinie (42). Ullman et al. ont
rapporté un taux de progression à 5 ans de l’ordre de
9 % sur une série de 56 patients avec un diagnostic
de dysplasie indéfinie (43).
Le consensus ECCO recommande, en cas de
dysplasie indéfinie confirmée par un anatomopa-
thologiste expert, la réalisation d’une coloscopie de
contrôle après 3 à 6 mois, avec une optimisation du
traitement de la RCH (28). Le consensus de la CCFA
recommande, dans cette situation, une surveillance
annuelle (figure 2) [25].
Absence de dysplasie
Les patients avec une MICI qui ne présentent pas
de dysplasie ont un faible risque de progression vers
le CCR (43).

36 | La Lettre de l’Hépato-gastroentérologue • Vol. XIV - n° 1 - janvier-février 2011
MISE AU POINT Diagnostic et prise en charge de la dysplasie au cours des MICI
Dans cette situation, le consensus de la CCFA suggère
une coloscopie de surveillance tous les un à deux ans
(25). Le consensus ECCO recommande, en cas de
pancolite, une surveillance à raison d’une colo-
scopie tous les deux ans jusqu’au 20
e
anniversaire
de la MICI, puis une surveillance annuelle (NP 2b,
grade B) [28].
Chimioprévention du cancer
colorectal au cours
des maladies inflammatoires
chroniques de l’intestin
Une méta-analyse ayant inclus 334 cas de CCR,
140 cas de dysplasie et un total de 1 932 patients
(3 cohortes, 6 études cas-témoin) a démontré que
les dérivés salicylés (5-ASA) étaient associés à une
réduction du risque de CCR (OR = 0,51 ; IC95 : 0,37-
0,69) ou d’un critère combinant le CCR à la dysplasie
(OR = 0,51 ; IC95 : 0,38-0,69) [44].
Compte tenu de la moindre toxicité de la mésala-
zine en comparaison de celle de la sulfasalazine, et
considérant que le nombre nécessaire de patients
à traiter pour prévenir un CCR était de 7 (needed to
treat, NNT) [45] chez les patients ayant une maladie
évoluant depuis 30 ans, le consensus ECCO suggère,
en l’absence de contre-indication, l’utilisation de la
mésalazine chez tous les patients présentant une
RCH, dans un but prophylactique (NP 2, grade B ;
AGA : grade B) [28].
Une étude ayant suivi des patients avec une RCH et
une CSP, préalablement inclus dans un essai contrôlé
randomisé, a démontré que l’acide ursodésoxycho-
lique était associé à une réduction significative du
risque de CCR (RR = 0,26 ; IC95 : 0,06-0,92) [46].
Le consensus ECCO et l’AGA recommandent l’utili-
sation de l’acide ursodésoxycholique chez tous les
patients présentant une CSP associée à une RCH,
dans le cadre de la chimioprévention du CCR (ECCO :
NP 1b, grade B ; AGA : grade A) [28].
Programmes de surveillance
endoscopique de la dysplasie
et du cancer colorectal au cours
des maladies inflammatoires
chroniques de l’intestin
À l’heure actuelle, malgré l’absence d’essai contrôlé
randomisé, la coloscopie de surveillance reste le
meilleur outil pour détecter une dysplasie ou un
CCR chez les patients suivis pour une MICI.
Le consensus ECCO recommande la réalisation
d’une coloscopie de surveillance chez tous les
patients avec une RCH, 8 à 10 ans après le début
des symptômes, et ce afin d’évaluer l’étendue de
la maladie (NP 5, grade D, avis d’experts). En cas
de pancolite, la surveillance doit débuter après la
coloscopie de screening et devra être réalisée un an
sur deux pendant 20 ans, puis tous les ans (NP 2,
grade B) [28]. En cas de colite gauche ou de colite
distale, la surveillance doit débuter après 15 ans
d’évolution de la RCH (28). Les patients avec une
rectite ne nécessitent pas de surveillance particu-
lière en rapport avec leur RCH (NP 2, grade B) [28].
En cas de CSP associée, la coloscopie de surveillance
doit être réalisée tous les ans (NP 3, grade B) [28].
Les biopsies systématiques aux 4 quadrants, tous les
10 cm et sur toutes les lésions visibles doivent être
réalisées au cours de la coloscopie de surveillance
(NP 2b, grade B) [28]. La chromoendoscopie au
bleu de méthylène ou à l’indigo carmin est une
alternative supérieure aux biopsies systématiques
dans les mains d’un endoscopiste entraîné (NP 1b,
grade B) [28]. ■
Conflit d’intérêts. Le Pr L. Peyrin-Biroulet déclare avoir perçu des
honoraires en qualité de conseiller pour les laboratoires Ferring.
 6
6
 7
7
1
/
7
100%