Lire l'article complet

Images en Ophtalmologie
•
Vol. VII
•
n
o
4
•
juillet-août 2013
98
✔
Mots-clés. Culture bactérienne • Endophtalmie
•Humeur aqueuse• PCR• Vitré.
✔
Keywords. Endophthalmitis• Culture• Panbacterial
PCR• Microorganisms• Bacteria.
Focus
Diagnostic microbiologique des endophtalmies aiguës
Microbiological diagnosis of acute endophthalmitis
C. Chiquet1, P.L. Cornut2, M. Maurin3
(1 Service d’ophtalmologie, hôpital Michallon, université J. Fourier, CHU de Grenoble ;
2 INSERM, U851, Lyon ; université Lyon 1, centre national de référence des staphylocoques, faculté Laennec, Lyon ; laboratoire de bactériologie, centre
de biologie et de pathologie Est, Hospices civils de Lyon, Bron ;
3 Laboratoire de bactériologie, hôpital Michallon, université J. Fourier, CHU de Grenoble)
L’ endophtalmie peut être définie comme
une réponse inammatoire à une invasion
bactérienne, fongique ou parasitaire
de l’œil. Elle est principalement d’origine exogène
(postopératoire dans 62 % des cas ou post-traumatique
dans 20 % des cas), et plus rarement d’origine endogène
(8 % des cas). Étant donné la gravité de l’infection et
de l’évolution rapide des lésions, il paraît indispensable
d’en faire le diagnostic dans les meilleurs délais.
L’ecacité et la rapidité des nouvelles techniques
de diagnostic microbiologique devraient, à l’avenir,
guider l’ophtalmologiste et lui permettre d’adapter
la prise en charge thérapeutique.
Quand prélever, quoi et comment ?
Les prélèvements conjonctivaux et ceux réalisés au niveau de
la cicatrice n’ont que peu de valeur, car ils ne sont que le reflet
de la flore conjonctivale au moment de leur réalisation, et non
lors de la contamination endoculaire.
Ce sont les prélèvements endoculaires
(figure1)
qui doivent
être réalisés en urgence, si possible avant toute anti bio thérapie.
Réalisée dans un contexte d’urgence, la prise en charge théra-
peutique de l’endophtalmie aiguë implique que le patient puisse
bénéficier au moins d’une injection intravitréenne d’antibio-
tiques dans les meilleurs délais. Si le patient n’est pas à jeun,
une prémédication par hydroxyzine dichlorhydrate (100mg en
1prise pour un adulte de 70kg) est administrée, et agira le
temps que le patient descende au bloc opératoire. Une anes-
thésie locale sera réalisée : instillation d’anesthésiques locaux
(oxybuprocaïne, tétracaïne), injection sous-conjonctivale de
lidocaïne chlorhydrate monohydrate 2 % et/ ou injection sous-
ténonienne de lidocaïne 2 % (à l’aide d’une boutonnière conjonc-
tivale). Le geste peut être en pratique douloureux chez certains
patients d’emblée hyperalgiques. Pour l’analgésie, la morphine
ou ses dérivés peuvent être utilisés : morphine 0,1 mg/ kg en
perfusion de 15mn ou nalbuphine 0,2 mg/ kg en perfusion de
15mn, en association avec du paracétamol (15 mg/ kg, en pra-
tique 1g chez l’adulte). Si le patient est à jeun, que son état
général le permet et qu’il existe un tableau algique d’emblée
majeur, une anesthésie générale peut être proposée, toujours
dans un délai compatible avec l’urgence de la prise en charge
thérapeutique.
La ponction de la chambre antérieure peut se faire avec une
aiguille calibrée de 25, 27 ou 30gauge(G), montée sur une
seringue à tuberculine. Ce geste n’est pas douloureux, sauf
s’il conduit à une hypotonie oculaire importante. Cette ponc-
tion est réalisée soit en cornée claire, soit éventuellement
au travers de la cicatrice si celle-ci est ouverte. Un prélève-
ment au niveau du sac capsulaire est possible. En pratique,
un volume de 100 à 200µl peut être prélevé. Cependant, le
prélèvement peut être rendu impossible par la densité du pus
intraoculaire.
Le vitré peut être prélevé par ponction vitréenne à l’aiguille
(25G ou 23G)
[figure1]
ou lors d’une vitrectomie. La ponction
à l’aiguille peut être douloureuse et nécessiter une anesthésie
locorégionale ou générale si la douleur spontanée du patient
est déjà très importante. Cette technique ne présente pas plus
de risque rétinien que celui retrouvé après biopsie vitréenne
au vitréotome. La ponction à l’aiguille permet habituellement
de prélever 200 à 300µl. Le prélèvement vitréen est égale-
ment possible lors d’une vitrectomie, en s’assurant de purger
la tubulure du vitréotome (afin de ne pas diluer le prélèvement
dans le volume de BSS
[Balanced Salt Solution]
de la tubulure)
[figure1c]
; l’aide opératoire aspirera alors le vitré, habituelle-
ment à l’aide d’une seringue de 2,5ml. Ce prélèvement de vitré
doit être réalisé sans perfusion de liquide endoculaire (vitré
pur, voie d’infusion fermée) ou simultanément à une injection
d’air (visualisation à l’aide d’une lentille de type quadrasphé-
rique) ou de BSS (vitré dilué). Ce prélèvement de vitré pur est
à l’origine d’une hypotonie qu’il faut limiter en ne prélevant
pas plus que 500µl.

1a
1c
1b
1d
Figure 1. Prélèvements oculaires lors d’une endophtalmie : ponction de vitré à l’aiguille (a) ; fl acon d’hémocultures pédiatriques et microtube
pour la PCR (b) ; prélèvement lors d’une vitrectomie à la pars plana (c) ; aspect du vitré infecté dans des seringues de 2,5 ml lors d’une vitrec-
tomie (d) .
Images en Ophtalmologie
•
Vol. VII
•
n
o
4
•
juillet-août 2013
99
Si vous avez accès à la PCR
(Polymerase Chain Reaction)
panbactérienne, l’obtention de vitré dilué peut remplacer le
vitré pur car l’utilisation de la PCR donne le même rendement
diagnostique
(1)
. Une vitesse de coupe du vitréotome élevée
(jusqu’à 1 500cpm) ne modifi e pas le résultat des cultures
bactériologiques. L’utilisation des systèmes de vitrectomie
transconjonctivale peut être utile, notamment chez les patients
glaucomateux
(2)
. En pratique, dans les situations d’endoph-
talmie grave, ces systèmes ne sont pas toujours adaptés du fait
de la longueur limitée du trocart d’infusion, de la nécessité d’une
tunnelisation sclérale (pour le 23G) chez les patients présentant
déjà un chémosis parfois hémorragique et un épaississement
choroïdien, et du débit limité de la vitrectomie (notamment en
25G, avec un temps de vitrectomie très long en raison de l’orga-
nisation importante du vitré). L’utilisation d’un endoscope peut
s’avérer très utile en cas d’opacité cornéenne importante.
Par ailleurs, une collaboration étroite avec les micro biologistes
permet d’adresser au laboratoire la cassette de vitrec-
tomie
(3,4)
dont le contenu sera fi ltré puis mis en culture.
Cettetechnique permet d’obtenir des résultats très intéres-
sants sur le vitré dilué (49 % de positivité). Lorsque l’analyse
porte sur le vitré pur et la cassette de vitrectomie, l’identifi ca-
tion bactérienne est réalisée dans 57 % (vitré pur : 44 % ; vitré
pur et dilué : 36 %), ce qui suggère une complémentarité des
analyses de vitrés pur et dilué
(3)
.
Cultures bactériologiques et PCR
L’isolement des micro-organismes en culture est la méthode
diagnostique de référence pour déterminer l’étiologie infec-
tieuse de l’endophtalmie. En pratique, 50 à 200µl de prélève-
ment d’humeur aqueuse ou de vitré sont mis en culture. Ilest
préférable d’ensemencer les prélèvements intraoculaires au
bloc opératoire
(fi gure2)
. Si le volume de prélèvement est
suffisant (en pratique, il s’agit de prélèvements vitréens),
environ 20µl de prélèvement sont étalés sur une lame stérile
(chauffée). Cet étalement est coloré par la coloration de Gram.
L’examen direct microscopique pourra révéler la présence de

Figure 2. Conditionnement des prélèvements endoculaires au bloc
opératoire.
Après coloration
(si quantité suffi sante)
PCR
100 μl (30 à 50 μl au minimum)
Conservation à + 4 °C
Bouillon
et/ou
gélose
Flacon
d’hémoculture
pédiatrique
Culture
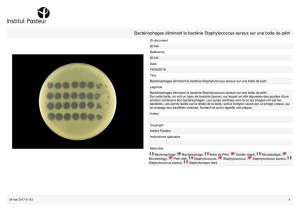
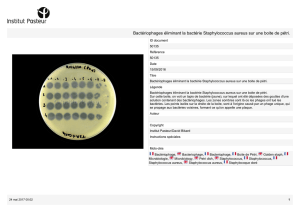
Figure 3. Colonies de
S. aureus
(a) et de
S. epidermidis
(b) sur gélose
Columbia au sang de mouton.
a b
Figure 4a. Principes de la PCR.
Synthèse du brin d’ADN complémentaire
Amorces
ADN polymérase
ADN cible recherché
(séquence connue, n copies)
dN TP
(dATP, dCTP, dGTP, dTTP, dUTP)
1. Dénaturation
2. Hybridation
3. Élongation
ADN amplifi é
(2n copies)
N cycles
2nN
Figure 4b. Représentation graphique de l’ADNr 16S (1 500 nucléo-
tides). Alternance de séquences nucléo tidiques conservées chez
les eubactéries et de séquence divergentes, spécifi ques de genres
ou d’espèces bactériennes.
2. Séquençage du produit de PCR (régions divergentes)
3. Interrogation des banques de données pour identifi cation
bactérienne
➔ Identifi cation si pourcentage d’identité ? 99 %
0 200 400 600
91E
(916-935)
91E
13BS
(1401-1384)
13BS
800 1 000
1 000
1 200
1 200 1 400
1 400 1 500
1. Amplifi cation non spécifi que d’un fragment de 475 paires de base
Images en Ophtalmologie
•
Vol. VII
•
n
o
4
•
juillet-août 2013
100
Focus
leucocytes, et éventuellement de bactéries (cocci ou bacilles
à Gram positif ou à Gram négatif), de levures ou de fi laments
mycéliens, en précisant leur quantité. Le volume réduit du
prélèvement intraoculaire et le faible inoculum bactérien
présent initialement font que cet examen direct est très souvent
négatif. Dans l’EVS
(Endophthalmitis Vitrectomy Study)[5]
, un
résultat positif a été obtenu dans 18,9 % des cas. Il demeure
toutefois intéressant, car sa positivité indique une infection
probable. Les prélèvements doivent être systématiquement
ensemencés sur des milieux permettant la culture des micro-
organismes le plus souvent en cause au cours des endoph-
talmies. Plusieurs types de milieux de culture peuvent être
utilisés. Le plus souvent mentionné dans la littérature est le
milieu “cœur-cervelle”
(Brain Heart Infusion [BHI])
. L’incon-
vénient majeur du tube BHI est le risque de contamination du
prélèvement lors des manipulations requises au moment de
l’ensemencement puis de la mise en culture de ces tubes. Il est
également possible d’injecter le prélèvement directement dans
un fl acon d’hémoculture (de préférence un fl acon pédiatrique
du fait du volume réduit du prélèvement)
[fi gure1b]
. Cette
technique présente l’avantage d’une plus grande sensibilité
et d’un risque moindre de contamination lors de la manipu-
lation du prélèvement au laboratoire. Ces milieux de culture
permettent l’isolement des bactéries aérobies (staphylocoques,
streptocoques, entérobactéries, etc.) ou anaérobies préféren-
tielles
(Propionibacterium acnes)
et des levures
(Candidaspp)
.
La gélose de Sabouraud, à laquelle est ajouté du chloram-
phénicol, permet l’isolement spécifi quement des levures. Un
antibiogramme sera ensuite réalisé
(fi gure3)
.
Ces dernières années, le diagnostic microbiologique direct
s’est enrichi des techniques de la biologie moléculaire
(6)
, en
particulier de techniques reposant sur la PCR
(fi gure4)
. La
PCR permet d’amplifi er l’ADN des micro-organismes direc-
tement à partir des prélèvements cliniques sans nécessiter
de culture préalable de ces agents infectieux. La PCR a été
appliquée au diagnostic étiologique des endophtalmies. Il est

Figure 4d. Séquence d’ADN : chromatogramme obtenu par séquençage automatique de l’ADN. Chaque fragment d’ADN est complémen-
taire de l’ADN matrice et diff ère en longueur par addition d’un nucléotide qui porte un fl uorophore diff érent pour chacune des 4 bases.
Ces fragments sont séparés par électrophorèse en gel d’acrylamide et le nucléotide terminal est détecté.
Figure 4c. Migration des produits de PCR par électrophorèse en gel
d’agarose.
Contrôle positif
Marqueur linéaire
Contrôle négatif
Extrait ADN
≃
475 paires de bases
Images en Ophtalmologie
•
Vol. VII
•
n
o
4
•
juillet-août 2013
101
possible d’amplifi er l’ADN de toutes les bactéries (en ciblant le
gène codant l’ARNr 16S) ou de tous les mycètes (en ciblant le
gène codant pour l’ARNr 18S). Après amplifi cation d’un frag-
ment de ces gènes cibles, une identifi cation d’espèce peut être
réalisée par séquençage de l’ADN amplifi é. Cette technique
est appelée “amplifi cation universelle”. Plus récemment,
des PCR ciblées sur certains pathogènes particuliers ont été
développés. Il est possible d’amplifi er spécifi quement l’ADN
des staphylocoques
(Staphylococcus aureus)
, des strepto-
coques
(Streptococcus pneumoniae)
, des mycobactéries ou
encore de
Candida albicans
et d’
Aspergillus fumigatus
. Ces
techniques peuvent être mises en œuvre directement sur les
prélèvements intraoculaires et sont réalisables en quelques
heures. L’identifi cation d’un micro-organisme particulière-
ment virulent par PCR
(S. aureus, S. pneumoniae)
pourrait
conduire plus rapidement le chirurgien à une décision de
vitrectomie thérapeutique.
Les PCR spécifi ques ont l’avantage d’être plus sensibles
(50à300éléments détectés) que la PCR universelle, et
d’être plus rapides et plus spécifi ques que les cultures pour
les germes à croissance lente. Il n’existe pas d’interférence
avec des bactéries contaminantes. Un de leurs inconvénients
est la nécessité d’un diagnostic orienté (recherche a priori
d’une bactérie)
[7]
. Les avantages de la PCR universelle sont
représentés par une approche large, donc sans a priori, du
germe et par la réalisation d’une seule PCR pour toutes les
bactéries. Leurs inconvénients sont les contaminations pos-
sibles à toutes les étapes (prélèvement, réactifs, manipula-
tions), l’interprétation qui requiert une confrontation clinique
et microbiologique, la diffi culté d’identifi cation de bactéries
génétiquement proches et le délai de rendu de l’examen
(3jours environ). Par ailleurs, les prélèvements multi-
organismes peuvent être à l’origine de séquences nucléoti-
diques ininterprétables.
✔
Résultats obtenus en pratique
Dans les endophtalmies bactériennes postopératoires
aiguës
(6)
, la culture des prélèvements oculaires, humeur
aqueuse et vitré, reste limitée : de l’ordre de 22 à 30 % pour
l’humeur aqueuse et de 40 à 69 % pour le vitré. Il existe une
nette prédominance des germes à Gram positif : 94,1 % dans
l’étude américaine EVS
(8-11)
et 97 % dans l’étude multi-
centrique du groupe français FRIENDS
(12)
. Parmi les germes
à Gram positif, nous retrouvons le
Staphylococcus epider-
midis
(en tête avec 45 à 50 % de cas), suivi des streptocoques
(24à37,7 %) et de
S. aureus
(7,5 à 11,5 %). Les germes à
Gram négatif
(Proteus, Escherichia coli, Pseudomonas aeru-
ginosa, Klebsiella, Serratia)
représentent 3 à 15 % des germes.
En pratique une co-infection est rare dans ce type d’endoph-
talmie postopératoire.

Figure 4e. Rendu de résultat de l’analyse de séquence (arbre
phylogénétique). L’ADN séquence est analysé dans les banques
de données qui rendent des alignements de séquence avec un
taux de similitude et qui proposent les arbres phylogénétiques
regroupant les séquences selon leurs similitudes.
Staphylococcus_croceolyticus~?~T~AY953148
Staphylococcus_aureus~v~N~DQ997833
Staphylococcus_aureus~v~N~DQ997835
Staphylococcus_lugdunensis~v~N~AY903258
Staphylococcus_pasteuri~v~T~AB009944
Staphylococcus_pasteuri~v~N~AF532915
Staphylococcus_pasteuri~v~N~AF532916
Staphylococcus_pasteuri~v~N~AF532917
Staphylococcus_pasteuri~v~T~AF041361
Staphylococcus_pasteuri~v~N~AB269765
Staphylococcus_pasteuri~v~N~AY857685
Staphylococcus_pasteuri~v~N~AJ717376
Staphylococcus_warneri~v~N~L37603
Staphylococcus_pasteuri~v~N~EF127830
Staphylococcus_schleiferi~v~N~DQ991033
Staphylococcus_schleiferi~v~N~D83372
Staphylococcus_piscifermentans~v~T~AB009943
Staphylococcus_lugdunensis~v~N~AY903256
05032128
Staphylococcus_lugdunensis~v~T~AB009941
Staphylococcus_lugdunensis~v~N~AY903257
Staphylococcus_lugdunensis~v~N~DQ923427
Staphylococcus_lugdunensis~v~N~DQ923433
Staphylococcus_lugdunensis~v~N~DQ923428
Staphylococcus_lugdunensis~v~N~DQ923430
Staphylococcus_lugdunensis~v~N~DQ923431
Staphylococcus_lugdunensis~v~N~DQ923432
Staphylococcus_lugdunensis~v~N~DQ923429
Staphylococcus_lugdunensis~v~N~DQ923434
Staphylococcus_aureus~v~N~L37598
Staphylococcus_auricularis~v~T~D83358
0,002
Images en Ophtalmologie
•
Vol. VII
•
n
o
4
•
juillet-août 2013
102
Focus
injection intravitréenne d’anti biotiques, la PCR panbactérienne
permet à elle seule de détecter l’agent bactérien dans 72 %
des cas.
Dans les endophtalmies bactériennes, la technique de PCR
présente les avantages suivants : technique adaptée pour
les échantillons de faible volume, ce qui est souvent la règle
en ophtalmologie, grande sensibilité (possibilité de détecter
un nombre faible de copies d’ADN, dans notre expérience,
la sensibilité de la technique de PCR panbactérienne est de
500pathogènes), et une excellente spécificité. Cette technique
ne requiert pas la présence d’organismes viables. Le délai
d’obtention des résultats (3jours actuellement) doit cepen-
dant être amélioré.
En pratique, comment optimiser la détection
des micro-organismes ?
Afin d’optimiser la détection des micro-organismes respon-
sables d’endophtalmies, il est préférable de prélever du vitré
initialement et d’appliquer sur ce prélèvement une culture
conventionnelle et une technique de biologie moléculaire (PCR
panbactérienne, par exemple), les 2approches étant complé-
mentaires
(6)
. Pour la culture standard, il est utile de disposer
au bloc opératoire de milieux de culture de type BHI ou hémo-
cultures pédiatriques. Pour les prélèvements lors de la vitrec-
tomie postérieure, il est non seulement intéressant d’analyser le
vitré pur mais également le vitré dilué présent dans la cassette
de vitrectomie. Les techniques de biologie moléculaire, de
type PCR panbactérienne, sont plus efficaces que les cultures
pour l’identification de bactéries à croissance lente ou difficile
(Granuli catella, Moraxella, P.acnes)
et pour l’identification
bactérienne après antibiothérapie intravitréenne.
II
C.Chiquet déclare ne pas avoir de liens d’intérêts.
Les autres auteurs n’ont pas déclaré leurs éventuels liens d’intérêts.
Références bibliographiques
1.
Chiquet C, Maurin M, Thuret G et al.; French Institutional Endophthalmitis
Study (FRIENDS) group. Analysis of diluted vitreous samples from vitrectomy
is useful in eyes with severe acute postoperative endophthalmitis. Ophthalmo-
logy 2009;116(12):2437-41.
2.
Almanjoumi A, Maurin M, Romanet J, Chiquet C. La prise en charge des
endophtalmies aiguës par vitrectomie transconjonctivale. SFO 2009: abstr. 559.
3.
Sharma S, Jalali S, Adiraju MV, Gopinathan U, Das T. Sensitivity and
predictability of vitreous cytology, biopsy, and membrane filter culture in
endophthalmitis. Retina 1996;16(6):525-9.
4.
Donahue SP, Kowalski RP, Jewart BH, Friberg TR. Vitreous cultures in suspected
endophthalmitis. Biopsy or vitrectomy? Ophthalmology 1993;100(4):452-5.
5.
Barza M, Baum J, Birkby B, Weinstein L. Intraocular penetration of carbe-
nicillin in the rabbit. Am J Ophthalmol 1973;75(2):307-13.
L’utilisation de la PCR panbactérienne dans le contexte d’endoph-
talmies aiguës ou à début retardé, postopératoires
(1,6,12-14)
,
associée aux méthodes conventionnelles de cultures bactério-
logiques, conduit à augmenter le taux d’identification bacté-
rienne dans l’humeur aqueuse (47 %) ou dans le vitré (68 %).
Cette technique ne permet pas, en routine, de s’affranchir des
cultures, qui ont également l’avantage de pouvoir être asso-
ciées à des antibiogrammes. Par ailleurs, après traitement par
Retrouvez l’intégralité
des références bibliographiques
sur www.edimark.fr
 6
6
1
/
6
100%