Le stress, un ennemi de la plasticité neuronale participe

S 622
L’Encéphale, 2006 ;
32 :
622-7, cahier 5
Le stress, un ennemi de la plasticité neuronale participe
à la pathologie du vieillissement
T.-M. JAY
(1)
(1) INSERM, U796, Physiopathologie des Maladies Psychiatriques, Université Paris Descartes, Faculté de Médecine Paris Descartes, Hôpital
Sainte Anne, 2ter, rue d’Alésia, Paris F-75014.
Rewriter I. Fabre.
Le terme stress a deux sens différents :
Il signifie à la fois
1) Réactions de défense d’un organisme à un change-
ment de l’environnement (de nature physique : t˚ ambiante
chaude ou froide ; de nature physiologique : par exemple
des altérations métaboliques ou endocriniennes) ou psy-
chologique (par exemple joie, peur, colère)
2) Le stress signifie aussi le changement même c’est-
à-dire la capacité (force) de générer les réponses physio-
logiques et les conséquences pathologiques qui se mani-
festent chez l’organisme stressé.
ET La capacité de résister au stress représente le
mécanisme indispensable à la survie de l’individu.
Après le concept central du stress (stabilité du milieu
intérieur) issu des travaux du physiologiste C Bernard,
c’est l’endocrinologue canadien Hans Selye qui en 1948
décrit le rôle important de l’axe hypothalamo-hypophyso-
surrénalien dans la médiation et la coordination des répon-
ses de l’organisme au stress capables d’assurer la stabi-
lité de l’organisme (homéostasie).
D’après Selye les réponses au stress seraient groupées
en trois phases :
Une phase initiale pendant laquelle les mécanismes de
défense réagissent d’une façon rapide et maximale (réac-
tion d’alarme).
Une période pendant laquelle la capacité d’adaptation
est augmentée (stade de résistance).
Une perte de la capacité d’adaptation (stade d’épuise-
ment)
Les réponses au stress seraient donc responsables des
maladies ainsi nommées maladies d’adaptation.
Hans Selye (1950) définit le stress comme un proces-
sus pas nécessairement négatif, cela dépendra de la
façon dont vous allez le percevoir. Par exemple le stress
perçu lors d’une réussite personnelle professionnelle sera
bénéfique alors que le stress ressenti lors d’un échec sera
plutôt délétère.
Mais depuis ces années, un grand nombre de travaux
ont été réalisés dans ce domaine et on a vu les idées chan-
ger progressivement. Aujourd’hui on ne voit plus le stress
comme un ami mais plutôt comme un ennemi qui aurait
des effets cumulatifs délétères sur le système nerveux
central, plus particulièrement sur sa capacité d’apprendre
et de se souvenir.
Kim et Yoon (1998) : Définition stress : toute condition
qui perturbe l’homéostasie physiologique et psycholo-
gique
: allant de l’anxiété au syndrome de stress post-trau-
matique (PTSD).
Comment résumer : La
réponse au stress
serait donc
un mécanisme nécessaire à la survie mais un stress pro-
longé pourrait avoir des conséquences sévères qui peu-
vent aller des déficits dans l’apprentissage et la mémoire
jusqu’à la mort cellulaire. L’exposition à des stress répétés
mais modérés augmenterait la capacité d’adaptation tan-
dis que l’exposition à des stress sévères résulterait en un
excès d’hormones glucocorticoïdes.
CIBLES DU STRESS
Le stress cible spécifiquement les aires du cerveau
impliquées dans la coordination de la cognition et de
l’émotivité : l’hippocampe, le cortex préfrontal et l’amyg-
dale. Ceci est vrai chez l’homme et l’animal.
Ces aires à risque sont celles où l’on va retrouver une
atrophie et un dérèglement fonctionnel au cours du
vieillissement
. Les aires à risque (hippocampe, cortex
cingulaire inférieur) sont les zones finales de l’intégration
de la cognition et de l’émotion.

L’Encéphale, 2006 ;
32 :
622-7, cahier 5 Le stress, un ennemi de la plasticité neuronale participe à la pathologie du vieillissement
S 623
L’Hippocampe
Ces dix dernières années, de nombreux travaux ont
montré que le stress produit des déficits dans des formes
de mémoire dépendante de l’
hippocampe
.
Des résultats similaires reproductibles ont montré chez
l’animal qu’une exposition à différents paradigmes de
stress (social, contention, présence d’un prédateur) pro-
duit des déficits dans différentes tâches de mémoire spa-
tiale (labyrinthe à huit bras, Luine
et al.
, 1994), le labyrinthe
en Y (Conrad
et al.
, 1996), labyrinthe aquatique (Diamond
et al.
, 1999) et la piscine de Morris (Sandi
et al.
, 2003).
ET dans ces études le stress perturbe toutes les diffé-
rentes composantes de la mémoire : acquisition, stockage
et rappel de l’information.
Parallèlement, de nombreuses études électrophysiolo-
giques
in vitro
,
in vivo
ont également montré que le stress
et les hormones du stress bloquent ou en tout cas atténue
la
plasticité synaptique
ou PLT (potentialisation à long
terme) et au contraire facilitent la DLT (dépression à long
terme).
Juste quelques rappels sur ces formes de plasticité :
On définit la PLT comme une augmentation durable de
l’efficacité synaptique, suite à l’application d’une stimula-
tion tétanique brève des fibres afférentes à la structure
enregistrée. La DLT est le phénomène inverse c’est-à-dire
une diminution durable de l’efficacité synaptique que l’on
va induire avec des protocoles de stimulation bien définis
et différents de ceux avec lesquels on induit la PLT.
Donc,
les effets du stress ne sont pas limités à la PLT.
Des études récentes ont montré que le stress et les hor-
mones du stress ont un effet opposé sur la PLT et DLT
ceci au niveau de la région CA1 de l’hippocampe. Le stress
semble donc modifier l’équilibre de la balance physiologi-
que nécessaire à une bonne efficacité synaptique
Ces effets du stress sur la plasticité synaptique sont
médiés entre autres par l’activation des récepteurs aux
glucocorticoïdes (nombreux travaux) et très récemment,
Yang et al (2005) ont montré une corrélation linéaire signi-
ficative négative entre le taux de corticostérone plasma-
tique et l’expression de la PLT dans CA1 et une corrélation
linéaire positive pour la DLT.
Cependant les changements des niveaux de corticos-
térone ne sont pas suffisants pour expliquer les modifica-
tions de plasticité après le stress. Les effets du stress sont
bien plus complexes et impliquent d’autres régions céré-
brales et d’autres systèmes de neurotransmetteur qui con-
trôlent directement ou indirectement les glucocorticoïdes.
La
plasticité structurale
de l’hippocampe est égale-
ment affectée par le stress.
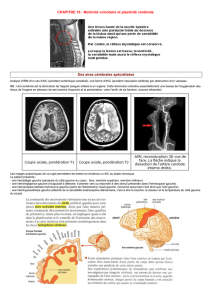
Ce sont les travaux de McEwen (1999) qui montrent
qu’à la suite d’un stress chronique, les neurones de la
région CA3 sont remodelés au niveau de leurs dendrites.
On voit une diminution de la longueur et du nombre de
branches dendritiques. Un stress chronique (contention
ou stress social) produit une rétraction des dendrites et
ce remodelage des dendrites est également observé avec
différents stress.
La neurogenèse dans le gyrus denté est également blo-
quée par le stress. (stress psychosocial chez le « tree
shrew » voir Gould
et al.
, 1997).
La plupart des travaux concernant l’étude des effets du
stress sur la plasticité neuronale se sont concentrés sur
l’hippocampe depuis la découverte des récepteurs gluco-
corticoïdes (GR) en 1968. Ce n’est que récemment que
l’on a vu ces études s’étendre à d’autres régions corticales
et sous-corticales.
En réponse à un stress, c’est le système hypothalamo-
hypophyso-surrénalien (HHA) qui va orchestrer la produc-
tion du CRF (cortico-releasing factor) à partir de l’hypo-
thalamus, de l’ACTH (adreno-corticotrophine hormone),
à partir de l’hypophyse et des corticoïdes à partir des sur-
rénales.
Ceci dans le but de maintenir des niveaux hormonaux
homéostasiques.
Mais en plus de ce rétrocontrôle négatif, on connaît
aussi l’importance directe de certaines régions cérébrales
dans la régulation directe de l’axe HHA : l’hippocampe qui
est la première région où l’on a mis en évidence les récep-
teurs GRs. Mais au-delà de l’hippocampe, le cortex pré-
frontal (CPF) et aussi l’amygdale jouent un rôle important
sur la régulation de l’axe HHA.
Le cortex préfrontal
Le stress affecte particulièrement la performance des
animaux dans des tâches de mémoire de travail qui est
une forme de mémoire dépendante du cortex préfrontal.
La mémoire de travail est une forme unique de mémoire
à court terme qui permet le maintien actif et la manipulation
de l’information afin de réaliser des tâches cognitives, ces
informations n’étant disponibles que de manière tempo-
raire. La région qui est nécessaire à la mémoire de travail
est le
cortex préfrontal
.
Une épreuve de stress comportemental aigu chez le rat
est capable de bloquer durablement la
plasticité synap-
tique
induite sur le circuit hippocampe – cortex préfrontal
(Rocher
et al.
, 2004) et ce blocage de plasticité préfrontale
dépend des glucocorticoïdes (Spedding
et al.
, 2004). On
n’observe pas de blocage de la PLT par le stress si l’on
administre à l’animal un antagoniste des récepteurs GR
mifépristone.
Sur le plan morphologique, les travaux de 2 équipes ont
récemment montré (Cook et Wellman, 2004 ; Radley
et al.
, 2004) que l’exposition de rats à un stress chronique
(contention), entraîne une réorganisation de l’arbre den-
dritique des cellules pyramidales des régions du CPF
médian (prélimbique et cingulaire antérieur). Les auteurs
observent une réduction de la longueur totale et du nom-
bre des épines dendritiques au niveau des dendrites api-
caux mais pas au niveau des dendrites basaux. La perte
des épines dendritiques s’accompagne d’une perte des
synapses axo-dendritiques. Les groupes de Wellman

T.-M. Jay L’Encéphale, 2006 ;
32 :
622-7, cahier 5
S 624
(Brown
et al.
, 2005) et de Sousa (Cerqueira
et al.
, 2005)
ont également montré que 3 h de stress par jour pendant
3 semaines ou une injection de corticostérone par jour
pendant 3 ou 4 semaines produisent un remodelage des
dendrites des cellules pyramidales de la couche 2 dans
différentes régions du CPF.
L’amygdale
L’exposition au stress peut induire des effets importants
sur la cognition mais aussi sur l’
émotion
.
Lorsque l’on est en proie à l’émotion, notre capacité à
conserver les souvenirs dans notre mémoire épisodique
se renforce. En d’autres termes, nous oublions beaucoup
plus vite les événements émotionnellement neutres alors
que des souvenirs d’événements émotionnels forts sont
plus tenaces. Ceci n’est cependant pas vrai dans le cas
d’un stress intense ou prolongé. La réaction émotionnelle
peut alors nuire à la performance épisodique.
L’amygdale joue un rôle majeur dans la régulation
des processus émotionnels.
Elle intervient dans la
per-
ception
et
l’expression des émotions
. Elle permet égale-
ment d’associer émotions et perceptions sensorielles,
participant ainsi à une certaine forme de mémoire.
L’amygdale est le support de l’acquisition et de la com-
mande de la réponse de peur. Elle contrôle de manière
critique le conditionnement à la peur.
Les effets du stress sur la plasticité et les fonctions de
l’amygdale sont différents comparés à l’hippocampe ou au
CPF.
Chez l’animal, le stress potentialise le conditionnement
à la peur ou conditionnement aversif qui résulte de l’asso-
ciation de deux événements bien distincts : un stimulus
conditionnel (par exemple un son ou un contexte) et un
événement qui produit toujours une réaction de peur (un
choc électrique).
L’association de ces deux événements ne fait pas inter-
venir l’hippocampe. Par contre l’association entre l’envi-
ronnement (contexte) et le choc électrique dépend de
l’hippocampe.
Les rats exposés au stress (aigu ou chronique) mon-
trent une augmentation de la réponse de peur à la fois au
son et au contexte.
L’exposition au stress et les hormones de stress aug-
mentent la réponse de peur
(Cordero
et al.
, 2003 ; Conrad
et al.
, 2004). On sait depuis les travaux de Ledoux que le
conditionnement de la peur ou conditionnement aversif
implique l’amygdale basolatéral. Un stress répété produit
aussi des modifications de performance dans des tâches
relevant de l’amygdale mais les résultats sont une aug-
mentation et non pas un déficit de mémoire comme dans
les tâches impliquant l’hippocampe. Les effets du stress
sur la plasticité synaptique au niveau de l’amygdale sont
aussi inverses par rapport à l’hippocampe. Vouimba
et al.
(2004) ont démontré que le stress facilite la PLT dans le
noyau basolatéral de l’amygdale. Enfin, à l’inverse de l’hip-
pocampe où l’on observe une atrophie dendritique au
niveau de la région CA3 à la suite d’une exposition à un
stress chronique, ce même stress provoque une hyper-
trophie des dendrites dans le noyau basolatéral de l’amyg-
dale (Vyas
et al.
, 2002).
Notons que ces modifications de plasticité structurale
et synaptique de même que les déficits de performance
observées dans les différentes tâches de mémoire suite
à une exposition de stress sont réversibles. Par exemple,
l’atrophie vue sur les dendrites apicaux de la région CA3
de l’hippocampe est réversible 7 à 10 jours après cessa-
tion du stress. Ceci est aussi retrouvé pour la plasticité
synaptique et la mémoire.
Pour résumer
, nous avons aujourd’hui la preuve que le
stress influence de manière générale les performances
cognitives
chez l’homme et l’animal
.
Les études chez les rongeurs ont montré que les glu-
cocorticoïdes augmentent la consolidation de la mémoire
mais la consolidation d’une mémoire émotive et induisent
des déficits dans les rappels de l’information mnésique.
On retrouve des résultats similaires chez l’homme.
Le groupe de McGaugh en Californie et Wolf en Alle-
magne et probablement d’autres montrent que le stress
et les hormones du stress entraînent des déficits au niveau
du rappel pour ce qui est de la mémoire déclarative (i.e.
mémoire des événements conscients et recollection
d’événements préalablement appris : faits et événe-
ments) qui implique les régions de l’hippocampe, les
régions parahipppocampiques et le cortex entorhinal.
Le groupe de Wolf montre que l’on se rappelle mieux
d’événements à connotation émotionnelle que d’événe-
ments neutres. Cette forme de mémoire fait appel à
l’amygdale puis au circuit amygdale/cortex frontal.
La
sénescence
ou le processus physiologique du
vieillissement est un phénomène naturel.
Le vieillissement cérébral
normal
présente des carac-
téristiques différentes de celles du vieillissement
patholo-
gique
mais il existe cependant de nombreuses similitudes.
Ainsi, la perte de neurones chez une personne âgée
saine (on entend par saine une personne exempte de
maladie déclarée) est minime et s’accompagne de phé-
nomènes de compensation.
Cependant cette perte de neurones est aujourd’hui
remise en question.
La perte de neurones est en revanche massive, irré-
versible et sélective chez une personne souffrant de mala-
dies d’Alzheimer ou de Parkinson.
Cependant, les sujets atteints de troubles cognitifs
légers sont susceptibles de développer une démence.
Cela laisse à penser que le cerveau vieillissant se pré-
sente (dans certains cas) comme un terrain propice au
développement de maladies dégénératives. Environ 40 %
des personnes âgées souffrant de troubles cognitifs légers
– principalement les troubles de la mémoire – développe-
raient une démence au bout de trois ans.
On sait que le
vieillissement normal
s’accompagne
principalement de déficits de mémoire à court terme, défi-

L’Encéphale, 2006 ;
32 :
622-7, cahier 5 Le stress, un ennemi de la plasticité neuronale participe à la pathologie du vieillissement
S 625
cits dans les fonctions exécutives (mémoire de travail et
mémoire épisodique) et d’un apprentissage plus difficile
des choses nouvelles auquel on ajoute une augmentation
de la fréquence des oublis.
Perte de neurones et vieillissement ?
Le dogme de la perte progressive de neurones avec
l’âge a été remis en question par la découverte de la neu-
rogenèse c’est-à-dire la capacité de créer de nouveaux
neurones à l’âge adulte.
Les premiers travaux dans les années 70/80 (Brody,
1970) qui parlaient d’une perte importante de neurones
jusqu’à 49 % dans plusieurs régions corticales sont à l’ori-
gine de cette corrélation entre perte de neurones et déclin
cognitif au cours du vieillissement normal. Par la suite les
résultats ont été discutés et il semblerait que la taille plutôt
que le nombre des neurones soit diminuée chez le sujet
âgé en comparaison au sujet jeune.
Avec l’arrivée de la stéréologie (nouvelles méthodes de
quantification des neurones plus rigoureuses), sur 94 cer-
veaux (entre 20 et 90 ans) on observe une perte de 10 %
des neurones du néocortex (Pakkenberg et Gundersen,
1997). D’autres études montrent qu’il n’y a pas de perte
de neurones dans le cortex entorhinal et temporal alors
que chez un patient AD, on observe une perte de 30 %.
Pour l’hippocampe, c’est la même chose, on a cru pendant
longtemps qu’il y avait une perte de neurones dans l’hip-
pocampe. À l’inverse on observe une augmentation des
astrocytes, de la microglie.
Aujourd’hui il semble que lorsque l’on a une perte de
neurones on a à faire à une pathologie mais pas à un effet
de l’âge.
Par contre la taille et les épines dendritiques du néo-
cortex sont fortement perturbées avec l’âge (Peters
et al.
,
1998, 2001) avec comme conséquences une perte de
densité des synapses plus particulièrement au niveau du
néocortex (perte 20 % frontal, Gibson, 1983).
Ce sont donc des modifications de la quantité et de la
qualité des connexions entre neurones qui sont observées
avec une atteinte plus particulière des circuits efférents et
afférents au cortex frontal.
Vieillissement et déficits de mémoire
Chez les sujets âgés sains, on observe des troubles de
mémoire explicite alors que la mémoire implicite (séman-
tique) reste intacte. Chez des sujets âgés sains avec trou-
bles cognitifs, les données en imagerie structurale et fonc-
tionnelle montrent des changements majeurs dans le
cortex préfrontal : une réduction du volume dans différen-
tes régions frontales (latérale, orbito-frontale) et une dimi-
nution d’activité fonctionnelle (Raz
et al.
, 2005). Selon
Rajah et D’Esposito (2005), il existerait une compensation
fonctionnelle entre les différentes régions du cortex frontal
c’est-à-dire une réorganisation fonctionnelle du cortex
préfrontal au cours de la mémoire de travail et de la
mémoire épisodique avec une augmentation et une dimi-
nution dans les différentes régions du lobe frontal. Le cor-
tex préfrontal reste une région plus vulnérable que le reste
du cerveau avec l’âge. En effet, seul des changements
mineurs sont observés dans le lobe temporal médian chez
les sujets âgés sains (Raz
et al.
, 2004).
Cependant seules des études longitudinales avec une
observation des patterns d’activité dans les différents cir-
cuits pourront éclaircir ces différents points.
Bien que les causes à l’origine des déficits de mémoire
chez le sujet âgé ne sont pas clairement démontrées, on
soupçonne que des modifications de plasticité sont à l’ori-
gine du déclin des fonctions cognitives avec l’âge.
Différentes plasticités cérébrales sont perturbées au
cours du vieillissement :
–
Plasticité structurale
: changements au niveau des
dendrites et cellules gliales.
–
Plasticité vasculaire
: plusieurs études ont montré
une raréfaction des microvaisseaux dans différentes
régions cérébrales qui s’accompagne d’un changement
dans la structure des vaisseaux restants. Les vaisseaux
vont perdre leur capacité de répondre de manière appro-
priée aux changements métaboliques et donc les diminu-
tions du débit sanguin cérébral vont réduire l’apport méta-
bolique nécessaire aux signaux des neurones et plus
particulièrement dans les structures où le niveau d’activité
neuronale est élevée.
– Une perturbation de la neurogenèse qui est aussi
régulée de façon coordonnée avec la croissance capil-
laire.
–
Plasticité synaptique
: diminution de la communi-
cation entre neurones.
De plus, l’activation de l’axe HHA peut représenter un
point de départ physiopathologique de la perte de
mémoire chez le sujet âgé. Plusieurs auteurs ont récem-
ment suggéré que le stress participe à la pathologie du
vieillissement. Les réactions de stress importantes pour
la survie des individus mobilisent un certain nombre de
structures cérébrales et peuvent dans certaines condi-
tions devenir pathogènes et délétères. Le stress et les glu-
cocorticoïdes empêchent la plasticité dans certaines
zones du cerveau spécifiquement : l’hippocampe et le cor-
tex préfrontal et, à long terme, peuvent induire une atro-
phie et un dérèglement fonctionnel. Ces aires à risque sont
les zones finales de l’intégration de la cognition et de
l’émotion.
Les travaux de Lupien
et al.
(1998) ont montré que le
cortisol plasmatique mesuré pendant une période de 24 h
chez des sujets de plus de 50 ans pendant 5 à 6 années
permet de dissocier des sujets avec déficits cognitifs
(mémoire immédiate, avec délai, spatiale dans labyrinthe)
présentant des élévations prolongées de cortisol de sujets
ne présentant aucun déficit cognitif et des taux normaux
de cortisol. Des diminutions de volume au niveau de l’hip-
pocampe ont par ailleurs été mesurées chez les sujets
avec déficits cognitifs et les auteurs observent une forte
corrélation entre le niveau d’augmentation du cortisol plas-
matique, le degré d’atrophie de l’hippocampe et le niveau

T.-M. Jay L’Encéphale, 2006 ;
32 :
622-7, cahier 5
S 626
de performance dans un test de mémoire déclarative. Ces
données indiquent donc que l’élévation du niveau de cor-
tisol basal peut causer la détérioration de l’hippocampe
et les déficits cognitifs. Les auteurs montrent aussi qu’une
élévation de cortisol basal affecte plus la mémoire de tra-
vail que la mémoire déclarative. Des travaux comparables
chez le rat montrent qu’une forte concentration de gluco-
corticoïdes induit à long terme des déficits cognitifs (Lan-
dfield
et al.
, 1978) et une atrophie de l’hippocampe (Lan-
dfield
et al.
, 1981) similaires à ceux observés chez le rat
âgé (Issa
et al.
, 1990). À l’inverse, chez des rats surréna-
lectomisés (pas de sécrétion de glucocorticoïdes) d’âge
moyen, l’administration de faibles doses de glucocorticoï-
des qui permet à l’animal d’être maintenu en vie va empê-
cher l’émergence de troubles cognitifs et d’une atrophie
de l’hippocampe observés chez le rat âgé.
Les glucocorticoïdes augmenteraient la vulnérabilité
des neurones aux effets dommageables de l’âge. Dans
des conditions normales, l’hippocampe inhibe la libération
de l’hormone corticotrope (ACTH) au niveau du système
hypothalamo-hypophysaire qui contrôle la production de
cortiscostéroïdes. L’hypothèse est que l’hippocampe sup-
posé altéré chez le sujet âgé ne pourrait plus inhiber la
sécrétion d’ACTH et cette levée d’inhibition entraînerait un
emballement du système, une augmentation du niveau de
glucocorticoïdes circulants et une détérioration plus
rapide de l’hippocampe mais aussi d’autres régions céré-
brales. Une exposition prolongée à une libération de cor-
tisol ou de corticostérone par la surrénale réduirait la capa-
cité des neurones à résister aux différents stimuli.
Plusieurs questions se posent sur les interactions possi-
bles entre stress et vieillissement (Porter et Langfield,
1998). Ces hormones du stress agissent-elles direc-
tement soit de manière permissive ou active pour accélé-
rer le vieillissement ? Sont-elles additives aux effets de
l’âge ou agissent-elles en parallèle pour induire une
vulnérabilité ? Le mécanisme d’action des glucocorticoï-
des au niveau cellulaire est encore peu connu. Il est impor-
tant de connaître comment s’exerce l’action à court terme
des corticostéroïdes sur les neurones mais aussi leurs
conséquences pathologiques à long terme. L’hypothèse
actuelle est qu’une exposition prolongée au stress ou aux
hormones du stress augmenterait la susceptibilité de cer-
taines cellules à l’apoptose et diminuerait l’excitabilité neu-
ronale, ces effets étant plus prononcés sur des neurones
âgés.
Ainsi, une hyperactivité de l’axe l’HHA ou de la réponse
endocrine au stress ne serait pas un simple épiphéno-
mène du vieillissement, mais jouerait plutôt un rôle essen-
tiel dans la pathogenèse du vieillissement. Le stress peut
être considéré comme régulateur, positif ou négatif, de la
longévité. Il nous reste à mieux comprendre le mécanisme
des réactions physiologiques et pathologiques au stress
afin de mieux intervenir dans le maintien des effets béné-
fiques et dans la prévention et le traitement des consé-
quences pathologiques. Le vieillissement cérébral va
dépendre de notre capacité à nous adapter au stress ou
pour reprendre une expression d’Hans Selye « le proces-
sus de vivre est de réagir au stress ».
Références
1. ARBEL I, KADAR T, SILBERMANN M
et al.
The effects of long-term
corticosterone administration on hippocampal morphology and
cognitive performance of middle-aged rats. Brain Res 1994 ; 657 (1-
2) : 227-35.
2. BODNOFF SR, HUMPHREYS AG, LEHMAN JC
et al.
Enduring
effects of chronic corticosterone treatment on spatial learning, syn-
aptic plasticity, and hippocampal neuropathology in young and mid-
aged rats. J Neurosci 1995 ; 15 (1 Pt 1) : 61-9.
3. BRODY H. Structural changes in the aging nervous system. Inter-
disciplin Top Gerontol 1970 ; 7 : 9-21.
4. BROWN SM, HENNING S, WELLMAN CL. Mild, short-term stress
alters dendritic morphology in rat medial prefrontal cortex. Cereb
Cortex 2005 ; 15 (11) : 1714-22.
5. CERQUEIRA JJ, PEGO JM, TAIPA R
et al.
Morphological correlates
of corticosteroid-induced changes in prefrontal cortex-dependent
behaviors. J Neurosci 2005 ; 25 (34) : 7792-800.
6. CONRAD CD, GALEA LA, KURODA Y
et al.
Chronic stress impairs
rat spatial memory on the Y maze, and this effect is blocked by tianep-
tine pretreatment. Behav Neurosci 1996 ; 110 (6) : 1321-34.
7. CONRAD CD, MacMILLAN DD 2nd, TSEKHANOV S
et al.
Influence
of chronic corticosterone and glucocorticoid receptor antagonism in
the amygdala on fear conditioning. Neurobiol Learn Mem 2004 ; 81
(3) : 185-99.
8. COOK SC, WELLMAN CL. Chronic stress alters dendritic morpho-
logy in rat medial prefrontal cortex. J Neurobiol 2004 ; 60 (2) : 236-48.
9. CORDERO MI, VENERO C, KRUYT ND
et al.
Prior exposure to a
single stress session facilitates subsequent contextual fear condi-
tioning in rats. Evidence for a role of corticostérone. Horm Behav
2003 ; 44 (4) : 338-45.
10. DAMOND DM, PARK CR, HEMAN KL
et al.
Exposing rats to a pre-
dator impairs spatial working memory in the radial arm water maze.
Hippocampus 1999 ; 9 (5) : 542-52.
11. GIBSON PH. EM study of the numbers of cortical synapses in the
brains of ageing people and people with Alzheimer-type dementia.
Acta Neuropathol (Berl) 1983 ; 62 (1-2) : 127-33.
12. GOULD E, McEWEN BS, TANAPAT P
et al.
Neurogenesis in the
dentate gyrus of the adult tree shrew is regulated by psychosocial
stress and NMDA receptor activation. J Neurosci 1997 ; 17 (7) :
2492-8.
13. KIM JJ, YOON KS. Stress : metaplastic effects in the hippocampus.
Trends Neurosci 1998 ; 21 (12) : 505-9.
14. LANDFIELD PW, WAYMIRE JC, LYNCH G. Hippocampal aging and
adrenocorticoids : quantitative correlations. Science 1978 ; 202
(4372) : 1098-102.
15. LANDFIELD PW, BASKIN RK, PITLER TA. Brain aging correlates :
retardation by hormonal-pharmacological treatments. Science
1981 ; 214 (4520) : 581-4.
16. LUINE V, VILLEGAS M, MARTINEZ C
et al.
Repeated stress causes
reversible impairments of spatial memory performance. Brain Res
1994 ; 639 (1) : 167-70.
17. LUPIEN SJ, DE LEON M, DE SANTI S
et al.
Cortisol levels during
human aging predict hippocampal atrophy and memory deficits. Nat
Neurosci 1998 ; 1 (1) : 69-73.
18. ISSA AM, ROWE W, GAUTHIER S
et al.
Hypothalamic-pituitary-
adrenal activity in aged, cognitively impaired and cognitively unim-
paired rats. J Neurosci 1990 ; 10 (10) : 3247-54.
19. McEWEN BS. Stress and hippocampal plasticity. Ann Rev Neurosci
1999 ; 22 : 105-22.
20. PAKKENBERG B, GUNDERSEN HJ. Neocortical neuron number
in humans : effect of sex and age. J Comp Neurol 1997 ; 384 (2) :
312-20.
21. PETERS A, SETHARES C, MOSS MB. The effects of aging on layer
1 in area 46 of prefrontal cortex in the rhesus monkey. Cereb Cortex
1998 ; 8 (8) : 671-84.
22. PETERS A, MOSS MB, SETHARES C. The effects of aging on layer
1 of primary visual cortex in the rhesus monkey. Cereb Cortex 2001 ;
11 (2) : 93-103.
23. PORTER NM, LANDFIELD PW. Stress hormones and brain aging :
adding injury to insult ? Nat Neurosci 1998 ; 1 (1) : 3-4.
 6
6
1
/
6
100%