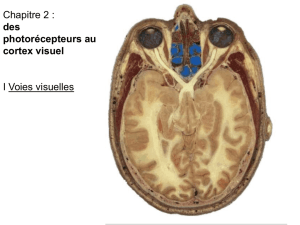
UNIVERSITE DU QUEBEC

UNIVERSITE
DU
QUEBEC
ETUDE
ANATOMO-FONCTIONNELLE
DES
AFFERENCES
INTRACORTICALES
DES
AIRES
VISUELLES
17/18,
SUPRASYLVIENNE
LATERALE
ET
ECTOSYLVIENNE
ANTERIEURE,
CHEZ
LE
CHAT
ADULTE
ET
LE
CHATON
PAR
CARMEN
DrONNE
MEMOIRE
PRESENTE
A
L'UNIVERSITE
DU
QUEBEC
A
TROIS-RIVIERES
COMME
EXIGENCE
PARTIELLE
DE
LA
MAITRISE
EN
PSYCHOLOGIE
AOUT
1989

Université du Québec à Trois-Rivières
Service de la bibliothèque
Avertissement
L’auteur de ce mémoire ou de cette thèse a autorisé l’Université du Québec
à Trois-Rivières à diffuser, à des fins non lucratives, une copie de son
mémoire ou de sa thèse.
Cette diffusion n’entraîne pas une renonciation de la part de l’auteur à ses
droits de propriété intellectuelle, incluant le droit d’auteur, sur ce mémoire
ou cette thèse. Notamment, la reproduction ou la publication de la totalité
ou d’une partie importante de ce mémoire ou de cette thèse requiert son
autorisation.

Table
des
matières
Introduction...
..
... ... ...
..
.
... ... ...
....
...............
............
1
Chapitre
premier
-
Contexte
théorique
et
expérimental................
4
Description
des
aires
visuelles..................................
5
Interconnexions
corticales
visuelles.............................
8
Organisation
laminaire...........................................
9
Développem
ent
des
structures
visuelles
cérébrales................
10
Réorganisation
corticale
après
ou
déprivations
sensorielles
•.•
lésions
14
Chapitre
II
-
Description
de
l'expérience............................
18
Sujets
...........................................................
19
Techniques
opératoires...........................................
22
Chapitre
III
-Analy
se
et
présentation
des
résultats.................
39
Méthodes
d'analyse.
40
Résul
tats
.................................................
. 40
Chapitre
IV
-
Interprétation
des
résultats
et
discussion.............
79
Chats
adultes
normaux
••.••.••••••.•.•.•.•...•.
. '
.................
.
80
Jeunes
cha
tons.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 82
Chats
lésés......................................................
84
Discussion.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 85
Périodes
critiques
pour
les
différentes
composantes
du
système
visuel..
.
...................................
.
100
Critique
de
la
méthode
..........................................
.
102

Conclusion
..........................................................
. 106
Références
..........................................................
. 110

Sommaire
L'objet
de
la
présente
étude
est
de
mettre
en
évidence
l'or-
ganisation
du
système
visuel,
son
développement
ainsi
que
sa
réorganisation
subséquente
à
des
lésions
précoces.
Un
certain
nombre
d'interconnexions
entre
les
aires
corticales
visuelles
(les
aires
17, 18,
19,
20, 21,
l'aire
suprasylvienne
latérale
et
l'aire
ectosylvienne
antérieure)
sont
comparées
chez
trois
groupes
de
chats.
Les
groupes
expérimentaux
se
répartissent
ainsi:
4
chats
adultes
normaux, 6
chatons
âgés
de
15
à
20
jours
et
3
chats
adultes
ayant
subi
des
lésions
entre
3
et
15
jours
postnataux
quasi
complètes
unilatérales
ou
bilatérales
de
certaines
aires
visuelles.
Les
résultats
obtenus
grâce
à
la
technique
de marquage
cellulaire
rétrograde
multiple
en
fluocescence
et
sa
très
haute
résolution
révèlent
des
différences
dans
la
quantité
de marquage
cellulaire
fluorescent,
son
étendue
et
sa
distribution
pour
les
trois
groupes
ci-dessus
mentionnés.
Tout
d'abord,
nous
confirmons
la
notion
largement
répandue
énonçant
une
décrois-
sance
substantielle
du nombre de
neurones
durant
la
période
postnatale.
On
observe
chez
le
groupe
de
jeunes
chatons,
en
rapport
avec
les
connexions
observées,
une
majorité
de
connexions
présentant
un marquage
plus
important
que chez
le
groupe de
chats
adultes.
Un
certain
nombre de
projections
retrouvées
chez
le
jeune
animal
sont
même
inexistantes
chez
l'adulte.
Parmi
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
1
/
126
100%