Chapitre 4 - Génétique des hémoglobinopathies Introduction

Chapitre 4 - Génétique des hémoglobinopathies
19
Chapitre 4 - Génétique des hémoglobinopathies
Introduction
La drépanocytose est une maladie génétique à transmission autosomique récessive. De nombreuses hémoglobines
humaines, structurellement anormales, sont responsables de maladies hémolytiques, certaines produites dans des
situations génétiques déterminées. Leurs possibilités de polymérisation sont responsables de la déformation en
croissant (en faucille) des globules rouges (Desai et al., 2004). L'identification de la mutation qui modifie la structure
primaire de l’hémoglobine s’est faite par étapes. Une mutation structurale a remplacé un acide aminé porteur d'une
charge ionique par un autre, neutre ou porteur d'une charge inverse. La mutation entraînera un changement de mobilité
électrophorétique par rapport à l’HbA normale.
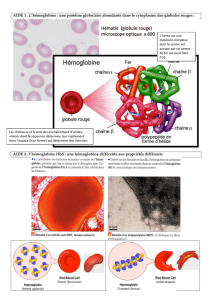
Ces hémoglobines résultent d'une mutation du gène β globine et/ou α globine, dont seules certaines ont une
répercussion clinique (Huehns, 1970). La plupart des hémoglobinopathies sont le résultat du remplacement d'un
aminoacide dans les chaînes α ou β, désignées par les lettres de l'alphabet suivant l'ordre de leur découverte (HbC,
HbD, HbG... ), si ce n'est l’hémoglobine S (HbS). Alphabet épuisé, on a eu recours au nom de la localité (capitale,
district) où la découverte a été faite: Hb Norfolk, Hb Stanleyville; ou au nom du patient: Hb Lepore, Hb Beilisson
(IHIC, 1986; Van Ros et al., 1968).
Succession des hémoglobines du fœtus à l’adulte
La nature et les proportions des hémoglobines varient au cours de la vie embryonnaire et fœtale. Au début du
développement, l’érythropoïèse est extra-embryonnaire et siège essentiellement dans le sac vitellin. Les hémoglobines
embryonnaires Gower I: , Gower II: , Portland: prédominent. A partir de 6 semaines de gestation,
l’hémoglobine F (HbF) devient largement majoritaire. L’hémoglobine A augmente peu à peu, représentant moins de
10% de l’hémoglobine totale jusqu’à 32 semaines de gestation. L’érythropoïèse fœtale est principalement hépatique,
les érythrocytes ont un volume globulaire moyen très élevé. Au-delà de 32 semaines, la synthèse d’HbF décline plus
rapidement au profit de HbA. A la naissance, la proportion de HbF est de 70 à 85%; l’érythropoïèse est devenue
médullaire (Mehta et al., 2003, fig. 4-1). Il faut attendre 6 mois après la naissance pour que les proportions de HbA,
HbA2, et HbF de l’adulte s’équilibrent.
Figure 4-1: productions des différentes hémoglobines, pendant la période embryonnaire et après la naissance
(schéma selon Mehta et al., 2003)
La synthèse de HbF, restreinte chez l’adulte, concerne moins de 8% de la population érythrocytaire, à concentration de
HbF élevée. Le mécanisme de l’expression différente de HbF selon les cellules reste inconnu, en partie génétiquement
déterminé. La commutation des hémoglobines entre état fœtal et adulte s’intègre dans un ensemble de modifications
dont quelques unes sont connues: augmentation de l’anhydrase carbonique, changement des antigènes membranaires,
d’isoenzymes, de la taille du globule rouge et de sa durée de vie.
Formes génétiques
Les hémoglobinopathies sont des maladies héréditaires à transmission autosomale récessive liées à une anomalie
qualitative ou quantitative, d’une double mutation structurelle de l'hémoglobine. Nous nous basons sur le IHIC
(International Hemoglobin Information Center) pour définir les principales formations.
Sur 1372 hémoglobinopathies découvertes (Globin Gene Server, consulté le 15.12.2009), cinq l'ont été au laboratoire
du Centre Caribéen de la Drépanocytose et dans l’Unité INSERM de la Guadeloupe: les hémoglobines "Hekinan"
(trouvée simultanément au Japon et en Guadeloupe), "La Désirade", "Petit-Bourg", "Roseau-Pointe-à-Pitre", et
l’hémoglobine S Antilles, α2 β 6Glu -> Val, 23 Val -> Ile; Monplaisir et al., 1986).

Chapitre 4 - Génétique des hémoglobinopathies
20
3
Chromosome 11
LCR
35
5
Chromosome 16
2 1 AGδ
22
AA222
F22
Hémoglobine adulte
3
Chromosome 11
LCR
35
5
Chromosome 16
2 1 AGδ
3
Chromosome 11
LCR
35
5
Chromosome 16
2 1 AGδ
22
AA222
F22
Hémoglobine adulte
22
AA222
F22
Hémoglobine adulte
L’HbS Antilles a été mise en évidence par isoélectrofocalisation, chez un nouveau-né martiniquais au cours d’un
dépistage sur sang de cordon. Elle possède une double mutation: celle de HbS en position 6 et une autre caractérisée
par la substitution de la valine par l’isoleucine en position 23 sur la chaîne β (favorisant la polymérisation de
l’hémoglobine désoxygénée). Les patients HbS Antilles à l’état hétérozygote présentent les manifestations cliniques et
hématologiques des drépanocytaires SS.
L’homozygote SS est appelé "sicklanémique": le locus (emplacement sur un même chromosome) pour l’hémoglobine
est occupé par deux gènes mutés S qui vont coder pour la synthèse de l’HbS, alors présente dans 95% des
érythrocytes. Seuls les homozygotes présentent les manifestations de la maladie drépanocytaire (anémie), forme la
plus sévère. D’autres Syndromes Drépanocytaires Majeurs (SDM) existent sous formes hétérozygotes simples (AS
Antilles) ou hétérozygotes composites où l’HbS est associée à d’autres hémoglobines anormales (formes SC, SDPunjab,
SLepore, SE) ou à une β thalassémie à syndrome Sβ thalassémique.
L’hétérozygote AS est appelé "sicklémique": le locus pour l’hémoglobine est caractérisé par un gène normal A et un
gène muté S. Ils président la synthèse de deux types d’hémoglobines: HbA et HbS (codominance). La proportion de
chaque type d’hémoglobine majoritaire dans un globule rouge est la suivante: HbA (50 à 60%), HbS (30 à 40%). Elle
est due à une plus grande affinité de la chaîne αA pour la chaîne A que pour la chaîne βS. Les hétérozygotes sont
indemnes de toute manifestation pathologique sauf dans certaines conditions d’hypoxie lors des vols à haute altitude et
sans pressurisation (Itano, 1957; Bertrand, 2005), au cours de l'anesthésie (Firth., 2005), en cas de porteurs ASAntilles
(Monplaisir et al., 1986).
Génétique de la transmission de l’hémoglobine S
Un locus d’un chromosome peut être occupé par diverses formes d’un même gène appelées allèles. Des gènes allèles
gouvernent une même fonction. La différence entre les allèles d’un même gène résulte d’une mutation. Si les deux
allèles d’un couple sont différents (hétérozygotie), et conjuguent leurs effets pour exprimer un caractère "mixte"
intermédiaire, on parle de codominance. Si les deux allèles situés sur des locus de deux chromosomes sont identiques,
le sujet est appelé homozygote (abréviation SS, désignent un drépanocytaire homozygote). S’ils sont différents, le
sujet est hétérozygote (AS). La transmission du gène βS muté, obéit aux lois de Mendel et se transmet sous le mode
récessif et autosomique. La transmission du gène βS par les deux géniteurs détermine le génotype SS chez l’enfant.
Les gènes qui codent pour la synthèse des chaînes polypeptidiques de l’hémoglobine (α, β, γ et λ) sont autosomiques,
la transmission de l’anomalie est indépendante du sexe (Neel, 1949; Maniatis et al., 1980).
Les transmetteurs possèdent deux gènes globine codominants, le normal A, l’autre muté S. Chacun des gènes
codera pour la synthèse d’hémoglobine en quantité équivalente, une normale, une mutée. Dès lors, les hétérozygotes
pour une hémoglobine anormale ont deux hémoglobines différentes (Neel, 1949; Maniatis et al., 1980).
Drépanocytose et haplotypes
Un haplotype est à la base des différences héréditaires d´un individu à l´autre. Les haplotypes permettent aux
généticiens de chercher les gènes associés à une maladie (Chang et al., 1997). Au fil des générations, les segments de
chromosomes ancestraux se déplacent dans la population au gré des recombinaisons. Certains segments se présentent
comme des régions du génome, partagés par de nombreux individus. Les hémoglobines humaines sont constituées de
plusieurs chaînes dont les gènes sont situés sur 2 chromosomes. Sur le chromosome 11, on trouve les gènes qui codent
pour les chaînes globines , et . Sur le chromosome 16, on trouve les gènes qui codent pour les chaînes globines
1, 2, et (fig. 4-2).
Figure 4-2: les gènes de la globine se trouvent sur les chromosomes 16 et 11. Une région de contrôle (LCR)
régularise l’expression du gène de la globine (modifié de Mehta et al., 2003)

Chapitre 4 - Génétique des hémoglobinopathies
21
Dans les régions intergéniques du locus β globine (région du chromosome 11, ensemble des gènes de la famille β-
globine), des variations de la séquence nucléotidique, sans conséquence pathologique, sont fréquentes. Elles sont
désignées sous le terme de polymorphisme. Ces modifications portant sur des sites spécifiquement reconnus par
certaines endonucléases (enzymes de restriction), sont faciles à révéler par cartographie génique (polymorphisme de
taille des fragments de restriction). L'association de plusieurs polymorphismes définit un haplotype (Kan et al.,
1978b).
La procédure diagnostique réalisée par la technique du polymorphisme de restriction (RFLP: Restriction Fragment
Lengh Polymorphysm) pour cribler l'ADN humain à la recherche de gènes mutants a permis à Kan et al. (1978b) de
l’identifier en aval du gène β globine. Leurs travaux ont démontré l’existence d’un déséquilibre de liaison entre ce
polymorphisme et la mutation drépanocytaire (βS) chez des drépanocytaires afro-américains. Plus de 20
polymorphismes de restriction (RFLPs) ou haplotypes ont été mis en évidence dans ce groupe (cluster). Dans la
drépanocytose, quatre haplotypes liées au gène βS, à forte spécificité, ont été décrits en Afrique:
- Bénin, dans la région centrale de l’Afrique de l’Ouest;
- Sénégal, dans la région atlantique de l’Afrique de l’Ouest;
- Bantou, dans l’Afrique Centrale ou Equatoriale;
- Cameroun, dans le groupe ethnique Eton du Cameroun.
La maladie pour laquelle un avantage sélectif est décrit pour les porteurs de trait de l’HbS (hétérozygotes AS) vis-à-vis
de la malaria à Plasmodium falciparum. Par ailleurs, les haplotypes du cluster β globine présentent un intérêt
anthropologique par la possibilité de retracer l’histoire des migrations des populations dans le monde (Kéclard et al.,
1996).
Une étude réalisée en Guadeloupe, sur 700 patients drépanocytaires, a permis d’établir la distribution des haplotypes
liés au gène βS dans la population guadeloupéenne (Kéclard et al., 1996): haplotype Bénin (72,6%), haplotype Bantou
(13%), haplotype Sénégal (8%), haplotype Cameroun (2,5%), haplotype Arabo-indien (0,2%) et atypiques (3,7%).
Une répartition similaire a été décrite dans les populations des îles des petites et des grandes Antilles: Martinique et
Jamaïque. A Cuba et au Brésil, l’haplotype Bantou est prédominant (prévalence du gène βS; 10-12%; Kéclard et al.,
1996; Romana et al., 2001).
Drépanocytose et thalassémie
Groupe des hémoglobinopathies par insuffisance de production d'une chaîne α ou β
Les syndromes thalassémiques sont des affections génétiques, souvent transmises sur un mode récessif autosomique.
Ils altèrent la synthèse des chaînes α (α thalassémie) ou (β thalassémie). La thalassémie est reconnue par Cooley et
al. (1927), qui décrivent une anémie sévère avec splénomégalie et atteintes osseuses; ils suggèrent qu'il s'agirait d'un
syndrome individualisé: tous les enfants souffrant d'anémie sévère avec splénomégalie, quelle qu'en soit l'étiologie,
étaient classés dans un fourre-tout nommé "Anémie de Von Jaksch" (1889). La traduction clinique et biologique du
déséquilibre varie en fonction d'autres éléments génétiques, en particulier du nombre de chaînes complémentaires α ou
β, et du taux de synthèse des chaînes γ.
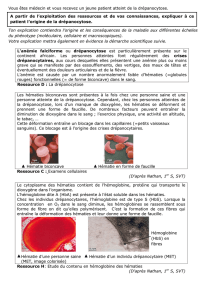
Les β thalassémies
Sont caractérisées par la diminution de synthèse des chaînes β (β+) ou par leur absence (°; Weatherall, 1997). Les
chaînes α restent célibataires, sous forme monomérique instable, précipitent en formant des inclusions sensibles aux
colorants vitaux. Cette précipitation est responsable de l’anémie hypochrome et microcytaire, caractérisée par
l’augmentation de la résistance osmotique des hématies et la présence de nombreuses cellules nucléées. Un point
frappant est l'origine italienne des malades. Cooley avait proposé que ce syndrome soit désigné "anémie
érythroblastique" ou "Méditerranéenne", le nom retenu fut "anémie de Cooley". Ultérieurement d'autres enfants
présentant le même syndrome seront décrits aux Etats Unis et en Europe. Whipple et al. (1936) ont désigné cette
anémie "thalassémie", utilisant la racine grecque (θάλασσα). Les sujets porteurs d'une discrète anémie microcytaire
sont nombreux dans le pourtour méditerranéen et peuvent être reconnus comme porteurs hétérozygotes de l'anémie de
Cooley (thalassémie "mineure") par opposition à la thalassémie "majeure" (forme homozygote). Le frottis sanguin
d'un malade thalassémique révèle une microcytose avec hypochromie anisocytose et nombreuses cellules cibles
(Cooley et al., 1927).
Les α thalassémies
Elles sont caractérisées par une diminution ou une absence de synthèse de la chaîne α entraînant un excédant de
chaînes γ chez le foetus, des chaînes β chez l’adulte (Kattamis et al., 1988; Galacteros, 2001). Fréquentes en Asie,
elles constituent une entité morbide qui existe sous deux formes:
-
° thalassémie: se caractérise par l’absence d’expression des deux gènes situés côte à côte sur le même
chromosome 16. Elle est due généralement à une délétion amputant la totalité des gènes . Chaque mutation
est caractéristique d’une population donnée. La plus grave est celle qui est responsable de l’anasarque fœtal
en Asie du Sud Est.

Chapitre 4 - Génétique des hémoglobinopathies
22
-
+ thalassémie: l’absence d’expression d’un seul des deux gènes contigus caractérise l’+ thalassémie.
Les lésions moléculaires des + thalassémies sont souvent des délétions de quelques kilobases (kb) amputant
un gène . Les délétions les plus fréquentes sont -3,7 et -4,2. Elles sont retrouvées en Asie, autour de la
Méditerranée, en Afrique, aux Antilles, aux Amériques. L’+ thalassémie peut être due également à une
mutation ponctuelle ou à une micro délétion aboutissant à une altération de la stabilité d’une chaîne mutée.
L’association β thalassémie et HbS (Sβ-thal) est un Syndrome Drépanocytaire Majeur (SDM), caractérisé
biologiquement par une anémie microcytaire accompagnée d’une augmentation de HbA2. L’association Sβ-thal°
(absence d’HbA) est de sévérité analogue à la drépanocytose homozygote alors que l’association Sβ-thal+ est moins
sévère (taux d'HbA plus ou moins élevé; Weatherall et al., 1981). Par ordre de sévérité décroissante, les formes
d’hétérozygote composite sont:
- les formes SDPunjab et SOArab (fréquentes en Asie);
- la forme SC (fréquente en Afrique occidentale);
- les associations thalassémique (β0 et β +).
Drépanocytose et hémoglobine foetale
L’association de l’hémoglobine fœtale (HbF) à la drépanocytose homozygote est connue, sa concentration intra-
érythrocytaire est variable (de 1 à 30%). Ces cellules à faible falciformation ont une durée de vie plus longue que les
falciformées (Conley et al., 1963; Huisman et al., 1981; Adachi et al., 2002).
La question se pose quant au rôle et à l’importance de l’HbF chez les drépanocytaires, si la production de HbF est liée
à des situations génétiques sur lesquelles on pourrait intervenir pour modifier le cours de la maladie. Deux types de
persistance de HbF sont connus: le type hétérocellulaire et le type pancellulaire des noirs. Ce dernier est une délétion
peu fréquente amputant le gène β globine. L’absence d'expression du gène β est compensée par l'expression presque
normale du gène γ restant. Chez l’hétérozygote composite S-Persistance Héréditaire d'Hémoglobine Foetale (S-PHHF
pancellulaire), HbF est répartie dans toutes les cellules à un taux de 15 à 35%. Le reste est constitué d'HbS et de HbA2.
Les hétérozygotes composites S-PHHF paraissent sains avec un hémogramme voisin de la normale. L'électrophorèse,
découvre 70% d'HbS et 30% d'HbF. Il s'agit d'un groupe particulier et limité de patients. Décrits au Moyen-Orient, en
Arabie Saoudite et en Inde, en Afrique, aux Antilles … Ils présentent un taux bas de morbidité et de mortalité (Conley
et al., 1963).
Drépanocytose et enzymopathie
Les enzymopathies du globule rouge les plus fréquentes touchent la glycolyse, dont le rôle est de fournir à la cellule la
majeure partie de l’ATP nécessaire à sa survie et de protéger contre les oxydations. Un déficit portant sur l’une des
enzymes de la voie principale de glycolyse (voie d’Embden-Meyerhof) où un shunt des pentoses-phosphates entraîne
un syndrome hémolytique parfois aigu, le plus souvent chronique: ce sont des déficits du Glucose-6-Phosphate-
Déshydrogénase (G6PD) et du déficit en 2,3-DiPhosphoGlycérate (Lian et al., 1971).
Déficit en 2,3-DiPhosphoGlycérate (2,3-DPG)
La glycolyse intervient dans la physiologie de l'hémoglobine. Parmi les produits intermédiaires de la glycolyse, le 2-3
DiphosphoGlycérate (2,3-DPG) métabolite spécifique, a une importance particulière du fait de son rôle dans l'affinité
de l'Hb pour l'oxygène. La liaison 2,3-DPG à l’hémoglobine favorise le passage de l'hémoglobine à la forme
désoxygénée. La baisse du taux de 2,3-DPG se traduit par une augmentation de l'affinité de l'Hb pour l'oxygène et une
polyglobulie réactionnelle. Son augmentation entraîne une diminution d'affinité de Hb pour l'oxygène. Chez le
drépanocytaire, dont le taux de 2,3-DPG est élevé, la diminution d'affinité résultante pour HbO2 tend à favoriser la
falciformation. On peut aussi penser que l'abaissement du taux de 2,3-DPG résultant d'une anomalie génétique ou
d'une médication appropriée pourrait améliorer l'état clinique des patients (Lian et al., 1971).
Déficit en Glucose-6-Phosphate Déshydrogénase (G6PD)
Le déficit en G6PD (favisme) est le plus fréquent des déficits enzymatiques érythrocytaires. La drépanocytose et le
déficit en G6PD sont deux anomalies génétiques responsables d’anémie hémolytique. Deux types sont décrits: le type
A (sujet originaire d'Afrique) et le type B (région méditerranéenne). Dans les deux cas, le début est caractérisé par un
ictère néo-natal (Lewis et al., 1966; Herz et al., 1970).
Chez le déficient A, les crises hémolytiques surviennent sur un fond d'apparence normale, chez les déficients de type
B, elles aggravent un état d'hémolyse chronique. Les causes des accès d'hémolyse sont diverses: infections, stress,
mais surtout ingestion de certains médicaments contre lesquels il est indispensable que le patient soit informé (Lewis
et al., 1966). Diop et al. (2002) rapportent une prévalence plus grande du déficit en G6PD chez les drépanocytaires par
rapport aux sujets indemnes d’hémoglobinopathie S. La plupart des études ne retrouvent pas l’influence du déficit en
G6PD sur la sévérité de la maladie (Steinberg et al., 1974). La présence de ce déficit confère aux drépanocytaires une
protection vis-à-vis du paludisme par phagocytose précoce des globules rouges parasités (Roth et al., 1983; Cappadoro
et al., 1998). La transmission génétique du déficit en G6PD est liée au sexe (gène porté par le chromosome X: les
hommes sont atteints, les femmes transmettent le gène anormal sans être affectées).

Chapitre 4 - Génétique des hémoglobinopathies
23
Le diagnostic du déficit se fait par dosage de l’activité de la G6PD par spectro-photométrie. En cas d’hyper-
réticulocytose, la technique de micro-centrifugation de Herz évite le risque de masquer un déficit réel par de jeunes
globules rouges (Herz et al., 1970).
Diagnostic d’une hémoglobinopathie
Diagnostic biologique
Il est basé sur l'électrophorèse de l’hémoglobine du sang prélevé sur une solution anticoagulante. Le diagnostic doit
être accompagné d’une enquête familiale du patient, des renseignements cliniques, d’un hémogramme récent à
distance de toute transfusion (Ingram, 1956, 1961; Siguret et al., 1997; Bardakdjian-Michau et al., 2003, fig. 4-3).
Figure 4-3: arbre décisionnel diagnostique (modifié de Bardakdjian-Michau et al., 2003)
Dans l’HbS, le remplacement par une valine de l’acide glutamique en position 6 de la chaîne introduit dans le
tétramère deux charges positives supplémentaires. Cette substitution élève le point isoélectrique de l’Hb de 6,95 à
7,25. Lors de l’électrophorèse à pH alcalin, l’HbS migre donc plus lentement que l’HbA vers l’anode (Ingram, 1956,
1961). Les hémoglobines A, A2, F sont différentiées par cette électrophorèse à PH alcalin (pH 9,6).
L’isoélectrofocalisation est l'examen qui permet de détecter bon nombre de types d'hémoglobine. Lors du passage du
courant électrique dans le gel, il s’établit un gradient de pH de la cathode à l’anode. Les hémoglobines se déplacent
dans le champ électrique jusqu’à leur pH isoélectrique (pHi, où les charges positives et négatives de l’hémoglobine
s’équilibrent). Cette technique permet de séparer des hémoglobines qui diffèrent de un centième d’unité pH.
L’isoélectrofocalisation permet de caractériser les hémoglobines F, S, C, D, Orabia et E. Le nouveau-né, l’enfant de
moins d’un an, ont une HbA et HbF, l’adulte normal possède une HbA et HbA2, chez l’homozygote SS, on ne trouve
pas l’hémoglobine A, chez l’hétérozygote AS ou AC, on trouve à la fois une HbA et HbS ou HbC. L’enfant
drépanocytaire possède une HbS et F (Ingram, 1956, 1961; Siguret et al., 1997; fig. 4-4).
Figure 4-4: détection des hémoglobines par isoélectrofocalisation, CCD (Saint Martin, 2005)
 6
6
 7
7
1
/
7
100%