p2-ue5-lebail-anapath-cardiovasc-2-27-09-16-pdf

1
UE5 – Anatomie cardiaque
Le Bail
Date : 27/09/2016 Plage horaire : 16h15-18h15
Promo : 2016-2017 Enseignant : LE BAIL
Ronéiste : Antoine DE CAUMIA BAILLENX
Anatomo-pathologie cardiovasculaire 2
I. Congestion active et passive
II. Hémorragie
III. Etat de choc
IV. Athérome et athéromatose
V. Thrombose
VI. Emboles
VII. Ischémie et infarctus - Infarcissement hémorragique
VIII. Vascularites - Artérites, maladie de Horton
IX. Illustrations pratiques : lames virtuelles
Vues au 1er cours.

2
VI. Embolie
Définition : migration d’un corps étranger dans le courant circulatoire et arrêt dans un vaisseau de calibre
trop étroit pour lui laisser passage, avec donc une sténose du vaisseau dont l’origine est plus en amont du
flux et non local.
Corps étranger endogène : produit par l’organisme = maladie thrombo-embolique (thrombus créé par
un défaut de coagulation à distance de la sténose)
Corps étranger exogène produit à l’extérieur de l’organisme (plus rare !)
1) Emboles endogènes
1 – Embolie fibrino-cruorique (mélange de fibrine, plaquette,
polynucléaire…)
Embole = thrombus (entier ou fragmenté) coincé après migration
Embolie pulmonaire liée à une thrombose de la
grande circulation (veines des MI, plexus pelviens)
Embolie artérielle systémique sur thrombose de
l'OG, du VG, de l'aorte et de ses divisions. AVC ++
2 – Embolie de cholestérol
= embolie athéromateuse
Matériel athéromateux libéré par ulcération de plaque d’athérome, ce qui
libère le contenu de la plaque.
Ici c’est un rein qui est touché.
3 – Embolie cellulaire
Migration de cellules cancéreuses à partir de la
tumeur primitive. Ici on a un amas de cellule épithéliales.
Mécanisme de formation des métastases

3
4 – Embolie graisseuse
Par fracture osseuse (fémur ++)
Migration de moelle hématopoïétique
Blocage dans les capillaires pulmonaires, le rein,
la peau, le SNC.
En clair : des adipocytes, et autour des
érythroblastes, des myélocytes…
Signe clinique : on peut voire des petites lésions rouge au
niveau des paupières qui sont des embolies graisseuses des
petits capillaires.
5 – Embolie amniotique (concerne la mère, et non le bébé)
Complication rare et grave des accouchements.
= Passage dans les veines utérines de liquide amniotique avec
squames (débris de peau),lanugo.
Oblitération des capillaires pulmonaires
6 – Embolie gazeuse
Accident de décompression en plongée, bulles d’air dans la circulation, qui vont grossir lorsque la pression
va diminuer et oblitérer le vaisseau.
=> Libération par les tissus de bulles de gaz sur lesquelles les plaquettes s'agrègent.
Traitement : caisson hyperbare.
2) Emboles exogènes
Embolie bactérienne / fungique :
Diffusion de l’infection
Bactériémie / fongémie
Forme grave d’embolie !!
Embolie aérique :
Après blessure accidentelle d’une grosse veine centrale : Bulles d’air (notamment lors d'injections IV).

4
On retiendra que les emboles fibrino-cruorique et de cholestérol sont les plus fréquents /!\
Ces schémas ne sont pas très importants, ils apportent des précisions.
Une embolie peut être directe : c'est-à-dire que l'embole suit le sens de la circulation sanguine.
Parfois les embolies peuvent être paradoxales, dans des territoires qui normalement ne devraient pas
être atteints. A ce moment là, il faut rechercher des anomalies notamment au niveau du cœur
(communication IC).
Exemple de trajet :
Pour une emboles fibrino-cruorique classique (embolies direct), elle vient la plupart du temps des
Membres Inférieurs, puis passe par :
- la veine cave inférieure,
- l'oreillette droite,
- le ventricule droit,
- l'artère pulmonaire où elle se bloque.
Ce type d’embolie fait partie des plus fréquentes et est favorisée par la stase, l’alitement, la
déshydratation, les lésions de l’endothélium des varices.
Si on a une communication dans le cœur (perforation…), on peut avoir une embolie Paradoxale car son
trajet est paradoxale comme le schéma ci-contre.
→ Conséquences des emboles
Conséquences locales :
– Embolie artérielle : nécrose ischémique → infarctus en aval (sauf si réseau vasculaire anastomotique ou de
suppléance)
Conséquences générales
– Embolie pulmonaire massive : mort subite ou insuffisance cardiaque droite aiguë grave

5
VII. Infarctus (Infarctus blanc/rouge)
Définition : foyer circonscrit (bien limité) de nécrose ischémique dans un viscère, en rapport avec
l’interruption complète et brutale de la circulation artérielle.
La nécrose est due à un problème vasculaire, c’est-à-dire l’interruption complète et brutale de la circulation
artérielle (qui induit la l’arrêt de l’apport en O2 = ischémie). La cellule est dépendante de l’O2, elle va donc
se nécroser.
Cette nécrose va être circonscrite et systématisée puisqu’elle va toucher le territoire, qui est irrigué par
l’artère qui est bouchée.
Si l’apport en O2 ne s’arrête pas brutalement, l’organe va s’adapter (ex : en créant des réseaux de
suppléance), les cellules s’atrophieront mais vont persistés.
Au sein de l’infarctus, de par leur aspect morphologique et leur constitution, on distingue 2 types :
Myocarde, cerveau, rein, rate
Circulation artérielle terminale
Poumon, intestin
Double circulation artérielle ou
circulation artérielle anastomotique
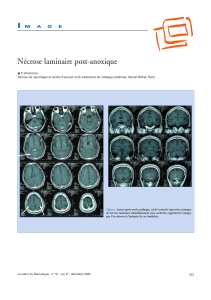
Infarctus blanc : on peut voir sur l’image la surface rénale, la médullaire, la corticale et une zone
circonscrite blanche. C’est un infarctus blanc ayant la caractéristique d’avoir une forme triangulaire, qui
correspond à la partie de l’organe qui était irriguée par l’artère bouché, avec une base au niveau de la
capsule et une pointe tournée vers l’artère. L’infarctus résulte de l’oblitération d’une petite artériole rénale
qui va cheminer dans le parenchyme et qui a dû se boucher. Tout le territoire que vous voyez en blanc, c’est
le territoire où normalement l’artère déverse son sang oxygéné donc tout ce territoire est nécrosé.
On peut aussi remarquer sur cette image (phase relativement précoce des infarctus) une petite couronne
(petit liseré rougeâtre) qui correspond à une hyperhémie, une congestion réactionnelle.
Cette image est typique pour nous les anatomo-pathologistes mais également pour les radiologues.
Ce type d’infarctus, on le voit typiquement au niveau du rein, cœur, cerveau, et la rate. C’est blanc car
toute circulation sanguine va s’interrompre dans ce territoire. L’artère est de type terminale, il n’y a pas de
collatéralités, aucun autre système vasculaire qui peut irriguer.
Les infarctus rouges ou hémorragiques (poumons, intestins). Ici aussi on observe une circulation
artérielle qui va s’interrompre, il va donc y avoir une nécrose ischémique des tissus en aval. Mais dans ces
organes en particulier, il y a souvent une double vascularisation, si bien que la 2eme voie de
vascularisation, qui n’est pas thrombosée, va déverser son volume sanguin dans les tissus nécrosés et va
conduire à cette couleur rouge.
Dans les poumons, c’est souvent le réseau bronchique qui va irriguer le poumon.
Dans les artères intestinales, vous savez qu’il y a différentes arcades vasculaires, si l’une est bouchée, l’autre
va continuer à déverser du sang, on aura cet aspect rougeâtre => donc de la nécrose et de l’hémorragie.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
1
/
29
100%