UE9- IMMUNOPATHOLOGIE Pr P.GASQUE

UE9-
IMMUNOPATHOLOGIE Pr
P.GASQUE
Date : 10/03/2017 Plage horaire : 10h45-12h45
Promo : DFGSM2 2016/2017 Enseignant : Pr GASQUE
Ronéistes :
BOYER Shânaa
DAMOUR Océane
LE SYSTEME CLEF DE L’IMMUNITE
INNEE: LE COMPLEMENT
I-L
‘immunité innée
A.
Immunité Innée et Immunité Adaptative
B. Qu'est-ce qu'un pathogène?
1- La reconnaissance sélective (concept 1)
2- Pathogène = microbes + débris dérivés de l'hôte (concept 2)
C.
Les mécanismes de reconnaissance
1- Introduction
2- Le rôle du PRR
(TLR4) 3- Le rôle du
LPS
4- Les différents PRR
D.
Un exemple de PRR: Les Toll Like Receptor (TLR)
II-
Système de défense contre les virus
III-
Système de défense contre les bactéries
A.
La phagocytose
B.
Le système du complément
1- Introduction, historique,
généralités 2- Les 3 voies
d'activation

Introduction
L'objectif de ce cours est de comprendre quel est le rôle de l'immunologie. De manière générale, son
rôle essentiel est de tuer les pathogènes.
Le mot «pathogène» devra être pris au sens le plus large possible, ça n'est pas qu'un microbe, ça peut
être une cellule cancéreuse ou une cellule apoptotique.
L'immunologie comprend deux grands volets :
-l'immunité innée (II) immunité naturelle mise en place dès qu'on sera infecté en contact avec un
élément pathogène (phase de minutes à heures)
-l'immunité adaptative (IA) ne peut se faire que si l'immunité innée a été instruite. L'objectif étant
de produire des anticorps, des cellules T, CD4, CD8 qui vont réagir beaucoup plus tardivement.
En d'autres termes, si votre II n'a pas lieu et que vous attendez l'IA, celle-ci ne pourra pas être efficace.
Vous serez déjà décédés de cette infection parce que votre système immunitaire (SI) aura mis trop de
temps à réagir contre l'agent infectieux.
L'II nous protège des éléments pathogènes tout en préservant nos cellules normales. Le système du
complément, pourtant très cytotoxique, va éliminer les pathogènes mais épargner nos propres
cellules.
L’II et l’IA sont extrêmement interconnectés. Sachant que c’est l’II qui doit s’installer dans un 1er
temps avant que puisse en tout état de cause s’installer et s’engager l’IA avec la réponse B, T. L’IA
est beaucoup plus spécifique que l’II.
D’une manière générale, le principal de l’II est d’éliminer les pathogènes, à savoir les éléments du
non soi. On peut naturellement penser à microbe de type bactérie, parasites ou encore champignons.
On verra que cette notion de pathogène est à élargir à sa complexité notamment incluant les facteurs
dérivés de l’hôte. Donc pathogène selon le professeur : illustration de quelque chose pouvant
induire la genèse d’une pathologie.
On verra que notre système immunitaire inné est capable de reconnaître les facteurs dérivés de
l’hôte tel que la protéine amyloïde, prions …
Cette élimination des pathogènes ne peut se faire qu’en préservant nos propres cellules. Si on a une
bactérie se baladant dans notre SNC. Il est clair que notre système immunitaire va lutter contre
celle-ci mais tout en préservant nos neurones, cela est vrai pour les hépatocytes dans le foie, les
myoblastes dans le muscle.
Il faut absolument que ce système de l’II soit suffisamment discriminant pour préserver les
éléments du soi (nos propres cellules) et éliminer les pathogènes.
Il peut y avoir des échecs à cela, dans le cadre de l’auto immunité, notre système immunitaire peut
être dirigé contre nos propres constituants. Ceci est la complexité des pathologies auto immunes.
I. L’immunité innée :
A.
Immunité Innée et Immunité Adaptative :
- Avant de rentrer dans les détails de l’II, un
élément concernant la séquence lors de l’entrée
d’un pathogène dans notre organisme pour la 1ère
fois : l’existence d’une dichotomie entre l’II et l’IA
(visible en haut de la diapositive), sachant que l’II
sera la 1ère. On ne pourra jamais avoir une IA
lymphocytes T, B si notre II ne s’est pas mise en

route.
En l’occurrence, cette II se mettant en route dès les premières minutes ou heures d’une infection aura pour
principe de reconnaître l’élément pathogène de manière sélective : attention on ne parle pas de
spécificité quand il s’agit de l’II (l’immunité spécifique est apportée par nos lymphocytes T, B), le
phagocyter (c’est-à-dire l’éliminer de la circulation dans le meilleur des cas), essayer de le lyser (en
second cas) et autre chose extrêmement importante : induire la production de facteurs ou molécules :
- soit anti-infectieuses (cas de l’interféron essayant de lutter contre des infections virus),
- soit par production de cytokines pro-inflammatoires qui auront pour objet d’activer nos cellules
immunitaires de type macrophages, neutrophiles pour qu’elles infiltrent le site infectieux et qu’elles
viennent lutter contre l’agent infectieux,
- soit le complément (plusieurs molécules dont l’objectif est de détruire cet élément pathogène que
ce soit une bactérie, un parasite ou un virus).
! L'II est la première à apparaître : les premières heures voire les premiers jours suite à une
infection. Elle comprend les phagocytes, les macrophages, les cytokines pro-inflammatoires
(TNFα), les interférons anti-virales α et β (les interférons γ concernent l'immunité lymphatique).
Puis il y aura séquentiellement activation du système immunitaire adaptatif avec la capacité de générer
spécifiquement des lymphocytes T dirigés contre des protéines virales, bactériennes, contre un constituant
parasitaire et générer des Ac mono et polyclonaux dirigés contre cet élément pathogène.
Il n’y a pas de mémoire dans l’II mais dans l’IA. C’est-à-dire que si demain vous avez à nouveau une
infection avec ce pathogène, vous n’aurez plus besoin de passer par l’étape II, il y aura une mobilisation
rapide de vos LT et de votre panel d’Ac dirigés contre ce pathogène. Il y aura une élimination extrêmement
rapide de cet élément pathogène. Le principe de la vaccination est de faciliter cette 1ère étape pour avoir
plus rapidement ces LT et ces Ac pour lutter contre cet élément pathogène.
-Inéluctablement, l'IA sera beaucoup plus tardive et ne pourra être établit que si l'II a joué son rôle.
Elle comprend les lymphocytes T et les lymphocytes B capables de produire une quantité
importante d'anticorps lorsqu'ils se différencient en plasmocytes.
(Partie infection approfondie par JJH)
Cells and molecules of immunity
Autre représentation de la dichotomie mais cette
fois-ci au niveau des cellules impliqués dans la
fonction des différents SI :
-Quand il s’agit de l’II, on a essentiellement
des cellules impliquées dans la
reconnaissance de ces éléments
pathogènes. D’où la présence de ces
cellules quand on parle de l’II :
macrophages, neutrophiles, éosinophiles
(défense anti parasitaire en allant s’agréger
aux parasites et par un mécanisme de
dégranulation, libérer de nombreuses
protéases responsables de la dégradation du
parasite), basophiles notamment impliqués
dans les mécanismes d’allergie (notamment
l’asthme).

Ne pas oublier qu’un allergène est un pathogène. Il y aura donc une capacité de ces cellules à réagir
contre cet allergène avec les problèmes chroniques de l’asthme, de la réaction allergique de manière
générale.
Il y a aussi les cellules NK pour natural killer jouant un rôle déterminant dans la reconnaissance des
éléments viraux notamment des cellules infectées par des virus ou encore des cellules cancéreuses.
-Au travers de ces cellules, il y a des constituants moléculaires (complément, interférons, cytokines,
chemokines) jouant un rôle déterminant dans cette II.
Ces cellules constituent les ‘cellules professionnelles du système immunitaire inné’ : c’est-à-dire celles
qui sont dans la circulation et qui peuvent être très rapidement mobilisées dans le tissu si il y a une infection
tissulaire. Les cellules de l'II ont des fonctions phagocytaires et de lyse (réaction allergique).
- Néanmoins, savoir que toutes nos cellules sont capables de réagir contre un élément pathogène.
Cela est fort heureusement le cas : ce n’est pas parce qu’on a l’absence de neutrophiles, cellules dendritiques
et un agent pathogène dans le cerveau que le cerveau ne virera pas le pathogène. C’est important que les
cellules du tissu telles que neurones, cellules gliales soient capables de reconnaître l’élément pathogène, car
si on attend qu’il y ait un recrutement de macrophages, cellules dendritiques, neutrophiles dans le cerveau,
vous pouvez essayer de lutter contre un agent infectieux de type viral : il y a de fortes chances que vous
soyez mort avant que cette réaction n’ait lieu.
Importance d’avoir intrinsèquement vos propres cellules capables de reconnaître ces éléments pathogènes.
(Abordés avec Gasque : essentiellement le rôle des macrophages, du complément, du neutrophile. Les
Natural Killer, les basophiles et les éosinophiles ne seront pas abordés, vu avec JJH).
-Cf cours de Lefèbvre : dans l'IA, on retrouve les lymphocytes T et B avec une production d'anticorps et
de CD8 cytotoxiques. L'activité cytotoxique est dépendante des CD8 et l'activité de lyse (neutralisation)
est dépendante des anticorps.
Dans le cas du Chikungunya ou du Zika, les Ac vont neutraliser le virus et l’empêcher de pénétrer dans
la cellule cible. Bloquer l'entrée du virus dans la cellule revient à bloquer son action puisque le virus est
dépendant de la cellule hôte pour se répliquer et se multiplier.
Cette diapo nous rappelle que
l'II est rapide (en heures) et
fait intervenir les
macrophages pour la
phagocytose, le système du
complément et les Natural
Killer qui permettent
d'éliminer les bactéries.
Cette première étape permet
de créer l'IA. On parle
d’interconnexion.

B.
Qu'est-ce qu'un pathogène?
1. La reconnaissance selective :
La question essentielle est la suivante : comment est-ce que les cellules sont capables de reconnaître et
d’éliminer un élément pathogène ?
1. Les cellules vont reconnaître l'élément pathogène et vont le cibler sélectivement par l’II.
Cette étape clé est la reconnaissance du non- soi: le système immunitaire discrimine nos cellules
normales à préserver des cellules cancéreuses/infectées qui se comportent comme un pathogène,
2. Lyser la cible (souvent le cas de la bactérie et du parasite qui sont des gros organismes),
3. Phagocyter (bactéries, cellules infectées par un virus).
Description schéma :
Le pathogène exprime un ligand appelé PAMP (Pathogen Associated Molecular Pattern), ex: LPS.
La cellule immunitaire (ici le macrophage) reconnaît sélectivement ce ligand via un récepteur appelé
PRR (Pattern Recognition Receptor), ex: Toll-like receptor.
Il est important qu’un macrophage puisse phagocyter une cellule infectée par un virus à la différence de
l’avoir lysé. S’il y a lyse d’une cellule infectée par un virus, le virus va se répandre alors qu’en phagocytant
une cellule infectée par un virus, la cellule infectée sera totalement phagocytée incluant les virus et ceux-ci
ne pourront plus se répandre. C’est pour cela que quand il y a un contexte infectieux de type viral, il est
préférable de faciliter la phagocytose plutôt que la lyse de la cellule infectée par les virus.
Le mécanisme mis en jeu est que les cellules jouant un rôle dans l’II, expriment des senseurs ou
sensors reconnaissant sélectivement un ligand exprimé par le pathogène. C’est l’interaction entre la
cellule immunitaire et le pathogène qui va faciliter la reconnaissance et l’élimination de ce pathogène.
" Concept 1 : les PRR reconnaissent sélectivement plusieurs ligands
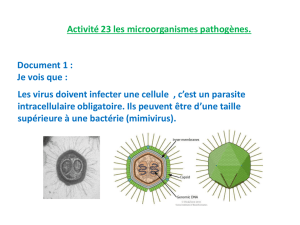
Malheureusement, il y a des pathogènes petits, des découvertes journalières (on n’entendait pas parler des
virus chikungunya et Sindbis il y a 10 ans de cela : aujourd’hui ils sont mieux connus, il y a une myriade
de ces pathogènes qui circule, tous ne sont pas nécessairement pathogènes mais peuvent acquérir une
pathogénicité).
Il est important de comprendre que le système immunitaire soit capable de reconnaître chacun des
différents éléments pathogènes qui pourraient exister sur cette planète. Ces pathogènes sont très
complexes : bactéries, virus, parasites. Le système immunitaire ne peut être complexe au point de
reconnaître chacun d’entre eux.
Il lui faut utiliser un mécanisme de reconnaissance suffisamment large et conservé pour reconnaître
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
1
/
38
100%