M aladies parodontales Thérapeutiques et prévention

Maladies parodontales
Thérapeutiques et prévention
Rapport établi à la demande de la
Mutuelle Générale de l'Education
Nationale
Expertise Collective
INSERM
© Les Editions INSERM, 1999
101 rue de Tolbiac
75013 PARIS
ISBN 2 85598-709-1
ISSN 1264-1782

Présentation de l'expertise collective
L'expertise collective INSERM est une modalité de partage et de transfert des connaissances
issues des résultats de la recherche. Elle fait le point, dans un domaine précis, sur les
connaissances scientifiques et médicales pour répondre à une question de santé publique
posée par les pouvoirs publics ou le secteur privé. L'INSERM réunit un groupe
pluridisciplinaire d'experts, scientifiques et médecins, qui analysent la littérature scientifique
internationale et en synthétisent les points essentiels. Ils élaborent ensuite des
recommandations afin d'aider le demandeur dans sa prise de décision.
Les dents, comparables à la partie visible de l'iceberg, sont l'objet de multiples soins et
attentions, mais malheureusement il n'en va pas de même du parodonte, leur point d'ancrage et
soutien indispensable. Quoi de plus banal en effet qu'un saignement survenant lors du
brossage quotidien ? Il ne déclenche bien souvent aucune inquiétude ni demande de
consultation. Il s'agit pourtant là d'un des signes cliniques les plus évidents de la « maladie
parodontale » (recouvrant en réalité un ensemble de pathologies complexe et multiforme
désigné par le terme de « parodontopathies ») qui affecte, à des degrés divers, pratiquement
90 % de la population en France dans toutes les tranches d'âge et cause la perte de 30 à 40 %
des dents.
Si l'étiologie infectieuse des parodontopathies ne fait aucun doute, il est encore difficile
aujourd'hui d'attribuer un rôle déterminant à un germe précis en raison de la richesse de la
flore buccale et de la complexité des réponses inflammatoires face à l'agression.
L'antibiothérapie simple ou composée est donc d'une efficacité limitée elles perspectives d'une
protection par voie vaccinale classique, encore lointaines. Quels sont actuellement le ou les
choix thérapeutiques et leur prise en charge ?
Afin de faire le point sur les modalités de traitements et leur suivi, sur les stratégies de
prévention et de prise en charge des maladies parodontales, la Mutuelle générale de
l'éducation nationale a demandé à l'INSERM de mener une expertise collective. Un groupe
international pluridisciplinaire, composé d'une vingtaine d'experts, cliniciens, universitaires et
chercheurs spécialisés dans les domaines allant de l'immunologie la plus fondamentale à
l'économie de la santé, a analysé plus de 2 000 publications de la littérature internationale
pertinente des cinq dernières années.
Face à ce véritable problème de santé publique deux types de réponse sont possibles: en
priorité, la prévention sous toutes ses formes puis, lorsque la maladie est déclarée, le recours à
l'arsenal des thérapeutiques les mieux adaptées aux différentes formes de parodontites et au
niveau de destruction du parodonte. Mais il faut souligner que la protection des résultats
acquis au prix des techniques les plus performantes est complètement dépendante d'un étroit
partenariat entre la patient et le spécialiste dans le cadre d'un protocole très élaboré de
maintenance, déjà fonctionnel dans certains pays européens. Voici donc les trois maître-mots
de la lutte contre ces maladies.

Daniel VAN STEENBERGHE, Professeur, Université Catholique de Louvain, Belgique
Equipe INSERM
Marie-Francoise GOURDIN, Chef de projet
Hélène CARTERON, Documentaliste
Paul JANIAUD, Directeur du Service d expertise collective (SC 15)
Denise GALY, Chargée de la recherche documentaire
Mireille BAUDOIN, Chargée de la recherche documentaire.

Groupe d'experts
Le groupe d'expertise collective réuni à l'initiative de l'INSERM comportait:
Pr Michel GOLDBERG, Président, Professeur, Faculté de chirurgie dentaire Paris V
Dr Jean-Luc ARDOUIN, Exercice libéral, Nantes
Dr Yann BARRANDON, Directeur de recherche INSERM, ENS Paris
Pr Jean-Pierre BERNIMOULIN, Professeur, Humblot Universität, Berlin, Allemagne
Pr Martine BONNAURE-MALLET, Professeur, Faculté de chirurgie dentaire, Rennes
Dr Jean-Pierre BOUVET, Directeur de recherche INSERM, Institut Pasteur, Paris
Pr Monique BRION, Professeur, Paris V
Dr Guy DACULSI, Directeur de recherche INSERM, CJF 93-05
Michael DARD, Merck Biomaterial Research, Darmstadt, Allemagne
Dominique KAISERLIAN, Chargée de recherche INSERM, U 404 INSERM, Lyon
Dr Jean-Paul KLEIN, Directeur de recherche INSERM, U 392 INSERM, Strasbourg
Thérèse LEBRUN, Chargée de Recherche INSERM, CRESGE, Lille
Pr Joëlle OGIER-DIRRIG, Professeur, Faculté de chirugie dentaire, Strasbourg, U 424
INSERM
Pr Bernard PELLAT, Professeur, Faculté de chirurgie dentaire, Paris V
Michel Saxon, Maître de conférences, Faculté de chirurgie dentaire, Toulouse
Personnalités auditionnées
Le groupe a auditionné au cours de ses travaux:
Jean MEYER, Maître de conférences, Faculté de chirurgie dentaire, Paris V
Neal MILLER, Professeur, Faculté de chirurgie dentaire, Nancy
Jean-Louis SAFFAR, Professeur, Faculté de chirurgie dentaire, Paris V
Henri TENENBAUM, Professeur, Faculté de chirurgie dentaire, Strasbourg

SYNTHESE
Synthèse et recommandations
Au terme d'une année de ce travail du groupe d'expertise, une somme de connaissances a été
dégagée de la littérature scientifique. Nous donnons dans un premier chapitre une synthèse
des connaissances actuelles. Certaines recommandations en découlent, d'une part, en termes
de pistes à explorer, car de nombreuses questions restent ouvertes, d'autre part, en termes de
propositions visant à améliorer ce problème de santé publique. Sur chacun des points de cette
synthèse, le lecteur pourra se reporter au chapitre qui lui est respectivement consacré dans la
partie Analyse.
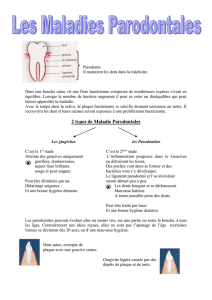
Les parodontopathies correspondent à un ensemble de pathologies qui aboutissent à la
destruction du parodonte, tissus incluant la gencive et les structures d'ancrage de la dent:
ligament alvéolo-dentaire, cément et os alvéolaire. En première approximation, ce sont
essentiellement des maladies d'origine bactérienne. Elles passent par deux stades distincts: les
gingivites, lésions confinées au rebord gingival et les parodontites, maladies destructrices des
tissus de soutien de la dent.
Parodontopathies et santé publique
La majeure partie des dépenses de santé publique concernant les maladies bucco-dentaires a
pour double origine les lésions carieuses et les parodontopathies. En France, une étude récente
sur les causes d'extraction des dents démontre que 50 à 60 % des extractions sont dues aux
conséquences de la carie, tandis que 30 à 40 % sont dues aux conséquences des parodontites.
Les autres pathologies de la sphère buccale ne constituent de fait qu'une part mineure dans ces
dépenses. Les conséquences de ces deux pathologies entraînent des reconstitutions et des
restaurations prothétiques quand on peut encore conserver l'organe dentaire. Quand les dents
sont irrémédiablement perdues et doivent être remplacées, cela entraîne la réalisation de
prothèses fixes ou amovibles. Les parodontopathies sont donc une source majeure de
dépenses directes et indirectes pour la CNAM et les mutuelles. Il faut ajouter à ces données
que dans une population de plus de 50 ans, la tendance s'inverse et plus de dents sont perdues
du fait de parodontopathies que de caries.
Selon une étude épidémiologique récente, 93 % des sujets examinés présentent une gingivite
et une perte d'attache de plus de 1 mm, et parmi eux 40 % ont perdu plus de 3 mm d'attache.
Quinze pour cent de ces sujets présentent une perte d'attache de plus de 5 mm, donc des
lésions très sévères avec des signes associés. Soixante-trois pour cent des personnes
examinées présentent des saignements gingivaux, signe révélateur d'une déviation
pathologique par rapport à la normale où la gencive ne saigne pas. Ces données obtenues sur
une population nord-américaine sont probablement transposables à la population française,
qui présente un niveau socio-culturel et des habitudes alimentaires et d'hygiène relativement
voisines. Afin de définir plus précisément les besoins réels, il serait souhaitable que des
recueils d'Information organisés soient lancés par région et à intervalles réguliers, afin
éventuellement de pouvoir suivre les effets de campagnes de prévention.
Pour le moment, ces chiffres indiquent que la quasi-totalité des patients (90 % au moins) ont
besoin de soins mineurs (contrôle de la plaque dentaire essentiellement), tandis que 15 % de
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
1
/
31
100%