3_Bistabilite dans la glycolyse - ESI

Université de Montréal
Faculté de Médecine
Département de biochimie
3. Bistabilité dans la glycolyse
Rôle des isoenzymes
Flux métabolique

Université de Montréal
Faculté de Médecine
Département de biochimie
Bistabilité - un commutateur physiologique en métabolisme énergétique
La glycolyse est la voie métabolique centrale pour générer de l'ATP et la synthèse des
précurseurs pour le métabolisme des nucléotides, des phospholipides et des acides
aminés.
Le flux glycolytique est élevé dans les cellules cancéreuses par rapport aux tissus adultes
normaux et de grandes quantités de glucose consommé sont détournées vers la
production de lactate, un phénomène connu comme l'effet Warburg. Ce même
comportement est également typique des tissus hautement prolifératifs tels que les tissus
fœtaux et les cellules souches.
En revanche, les cellules quiescentes ont de faibles flux glycolytiques, et consomment le
glucose à des taux faibles tout en catabolisant la plupart de ce glucose en dioxyde de
carbone.
Cette différence d'activité glycolytique, constatée dans des cellules différentes, est
accomplie grâce à des niveaux de régulation différents.
oDes exemples en sont la rétro-inhibition (rétroaction négative) allostérique et
l’activation allostérique en aval exercées par les métabolites intermédiaires des
enzymes glycolytiques.
BCM 2505 2

Université de Montréal
Faculté de Médecine
Département de biochimie
Régulation allostérique d’enzymes glycolytiques
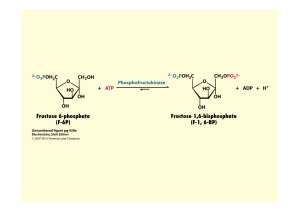
Un rôle central est joué par trois enzymes,
ola phosphofructokinase (PFK),
ole pyruvate kinase (PK) et
ola phosphofructokinase / fructose-2,6-
bisphosphatase (PFKFB)
à travers l’inhibition ou l'activation par trois
intermédiaires réactionnels dans la glycolyse:
ole fructose-1,6-bisphosphate (F16BP),
ole fructose 2,6-diphosphate (F26BP) et
ole phosphoénolpyruvate (PEP).
BCM 2505 3

Université de Montréal
Faculté de Médecine
Département de biochimie
Ces enzymes glycolytiques ont des isoformes multiples (PFKL/M/P, PKM1/M2/L/R et
PFKFB1-4) qui sont soumises à des régulations allostériques différentes.
oChaque isoforme, par conséquent, influence le flux glycolytique d'une manière
distincte.
Des tissus et des cellules différents expriment des combinaisons d’isoformes de ces
enzymes distinctes, donnant ainsi lieu à un comportement spécifique de flux
glycolytique qui satisfait les besoins biosynthétiques et énergétiques du type de
cellules en question.
En général, l'expression des isoformes d'enzymes glycolytiques et leur régulation sont
étroitement liées au contrôle de la croissance cellulaire.
Il y a des validations croissantes qui indiquent que la perte en contrôle de la croissance
tel que dans la formation de tumeurs, due à des mutations dans les proto-oncogènes
et gènes suppresseurs de tumeurs, est accompagnée par l'altération de l'expression
spécifique d'isoenzymes glycolytiques. Une reprogrammation métabolique s’ensuit.
Expression d’isoformes en fonction du tissu concerné
BCM 2505 4

Université de Montréal
Faculté de Médecine
Département de biochimie
Un aspect supplémentaire de la régulation du flux glycolytique est leur modulation due aux
voies de signalisation.
Les voies de signalisation admettent un comportement du flux glycolytique distinct des
isoformes présentes; ici l'action des voies de signalisation modifie plutôt le comportement
cinétique de l'enzyme cible au lieu d’induire un nouvel isozyme.
oSignalisation par une tyrosine kinase modifie le comportement cinétique de l’isoforme
PKM2 en modulant son comportement allostérique.
oDe même, les événements de signalisation déclenchés par le glucagon dans les
hépatocytes modifient la cinétique de l'isoenzyme du foie de PK.
oProtéines kinases A/B/C (PKA, PKB et PKC) se sont avérées influencer la cinétique
d'isoformes PFKFB.
Signalisation dans la régulation du flux glycolytique
BCM 2505 5
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
1
/
30
100%