Lire l`article complet

Correspondances en Métabolismes Hormones Diabètes et Nutrition - Vol. XX - n° 1 - janvier 2016
34
Cas clinique
* Service
d’endocrinologie,
CHUdeRouen.
Un hypogonadisme congénital
à bascule
A tipping congenital hypogonadism
Jean-Marc Kuhn*
M
onsieur M. est âgé de 39 ans. Né 1 mois avant
terme (2,5 kg et 47 cm), son histoire médicale
commence dès sa naissance, au moment de
laquelle est mis en évidence un syndrome malformatif
avec dysplasie ectodermique et anhidrose. S’y adjoint
une cryptorchidie bilatérale.
Lors d’une évaluation effectuée à l’âge de 3 ans et 4 mois,
il mesure 95 cm et pèse 13 kg. Son développement
psychique apparaît normal. La recherche d’un substratum
génétique expliquant le tableau clinique fait réaliser
un caryotype et une étude du gène WRN. Le caryotype
se révèle normal (46XY), ainsi que l’étude du gène
du syndrome de Werner. À l’âge de 4 ans est réalisée,
en 2 temps, une cure chirurgicale de la cryptorchidie.
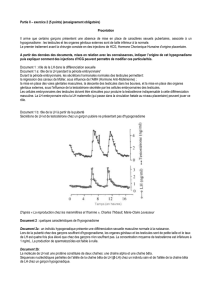
À l’âge de 13 ans, le retard de croissance (figure 1) et de
développement pubertaire fait réévaluer la situation.
À cette date, sont notés de nombreux nævi, un micro-
pénis et 2 testicules intrascrotaux de petite taille.
Aucun signe d’amorce du développement pubertaire
n’est constaté. Fait de forte valeur, monsieur M. est
anosmique. Le bilan endocrinien qui est réalisé permet
d’écarter l’existence d’un déficit somatotrope : au cours
de 2 épreuves de stimulation (glucagon-propranolol,
d’une part, et GHRH, d’autre part), les taux de GH
s’élèvent au-dessus du seuil des 30 mU/l. Le taux
de sulfate de déhydroépiandrostérone (SDHA) est
mesuré à 1,1 mg/l (N : 0,7 à 3,8) et celui de testostérone
à 0,33 ng/ml. Le taux de LH est inférieur à 0,5 U/l. Enfin,
les résultats de la mesure de la TSH (0,9 mU/l ; N : 0,1
à 4,5) et de la T4L (14 pmol/l ; N : 12 à 21) confirment
l’absence d’anomalie de la fonction thyroïdienne. Il est
choisi de maintenir une surveillance médicale attentive
de monsieur M., qui n’a aucune difficulté à suivre une
scolarité normale.
À 15,5 ans, sa taille atteint 158 cm. Le pénis mesure
3,5 cm, et aucun signe de développement pubertaire
n’est noté. Le taux de testostérone est de 0,2 ng/ml et,
de façon surprenante, FSH et LH plasmatiques sont res-
pectivement mesurées à 67 et 22 U/l. L’hypogonadisme
hypogonadotrope avec anosmie s’est transformé en
hypogonadisme primaire !
À 18,5 ans, monsieur M mesure 170 cm et pèse 47 kg.
Il entre en Maths Spé. L’endocrinologue qui prend le
relais du suivi pédiatrique retrouve, en sus du syndrome
malformatif initialement constaté, une hyperlaxité
ligamentaire, une calvitie, l’absence de développement
pilaire. L’examen ophtalmologique précise l’existence
d’un glaucome. Un traitement de substitution par
Figure 1. Courbe de croissance staturale (tracé supérieur) et pondérale (tracé inférieur)
de monsieur M. objectivant un retard de croissance prédominant sur le plan pondéral.
0034_MET 34 09/02/2016 14:54:00

Correspondances en Métabolismes Hormones Diabètes et Nutrition - Vol. XX - n° 1 - janvier 2016
35
Un hypogonadisme congénital à bascule
1. Aslanger AD, Altunoglu U,
Aslanger E, Satkın BN,
Uyguner ZO, Kayserili H. Newly
described clinical features in
two siblings with MACS syn-
drome and a novel mutation
in RIN2. Am J Med Genet A
2014;164A(2):484.
2. Pitteloud N, Acierno JS Jr,
Meysing AU, Dwyer AA, Hayes FJ,
Crowley WF Jr. Reversible
Kallmann syndrome, delayed
puberty, and isolated anosmia
occurring in a single family with
a mutation in the fibroblast
growth factor receptor 1
gene. J Clin Endocrinol Metab
2005;90(3):1317.
3. Sinisi AA, Asci R, Bellastella G
et al. Homozygous mutation
in the prokineticin-receptor2
gene (Val274Asp) presenting
as reversible Kallmann syn-
drome and persistent oligo-
zoospermia: case report. Hum
Reprod 2008;23(10):2380.
4. Laitinen EM, Tommiska J,
Sane T, Vaaralahti K, Toppari J,
Raivio T. Reversible congenital
hypogonadotropic hypogona-
dism in patients with CHD7,
FGFR1 or GNRHR mutations.
PloS One 2012;7(6):e39450.
Références
androgènes est initié, et la surveillance endocrinienne
poursuivie. Le dernier bilan en date, réalisé à l’âge
de 38 ans, confirme l’anosmie, avec une atrophie
des bulbes olfactifs bien identifiée par l’examen
IRM de l’encéphale (figure 2). L’ostéodensitométrie
objective une ostéoporose (T-score lombaire à −3,2).
LH et FSH sont respectivement à 30 et 68 U/l, et la
testostéronémie, mesurée à distance du traitement
androgénique substitutif, est de 0,29 ng/ml (N : 4 à 9).
Les résultats de l’exploration biologique des fonctions
thyroïdienne, surrénalienne et somatotrope ainsi que
la sécrétion de prolactine sont normaux.
Si le traitement à visée endocrinienne de monsieur M.,
qui comporte une substitution en testostérone et sa
surveillance, ne pose guère de questions, il n’en est pas
de même en ce qui concerne l’origine et l’évolution de
son hypogonadisme.
L’hyperlaxité ligamentaire et les troubles oculaires
peuvent faire évoquer un syndrome d’Ehlers-Danlos,
au cours duquel d’authentiques hypogonadismes
primaires ont été décrits (1). Au demeurant, l’absence
d’hématomes et l’hypogonadisme hypogonadotrope
initial avec anosmie ne permettent pas de retenir cette
hypothèse.
Ces 2 dernières caractéristiques, confortées par l’absence
de bulbes olfactifs sur l’IRM encéphalique, confortent le
diagnostic de syndrome de Kallmann-de Morsier. Celui-ci
est en accord à la fois avec les anomalies génitales
observées (cryptorchidie, micro-pénis, retard pubertaire)
et avec la réversibilité du déficit gonadotrope. Une telle
évolution a en effet été montrée chez des patients
dont l’hypogonadisme hypogonadotrope congénital
associé à un trouble olfactif (anosmie ou hyposmie)
était sous-tendu par des mutations des gènes codant
notamment FGFR1 (2), PROK2/PROKR2 (3) et CHD7 (4).
Cette réversibilité n’est cependant pas exclusive du
syndrome de Kallmann-de Morsier, puisqu’elle a été
observée chez des patients dont l’hypogonadisme
hypogonadotrope congénital était normosmique et
sous-tendu par des mutations des gènes codant Kiss1/
KissR1 (5), TAC3/TAC3R (6) et GnRHR (7, 8).
Si le diagnostic de syndrome de Kallmann-de Morsier
est bien celui qu’il convient de retenir chez monsieur M.,
il reste à expliquer pourquoi l’hypogonadisme hypo-
gonadotrope initial s’est transformé en hypogonadisme
primaire. On peut formuler l’hypothèse qu’en dépit de
son abaissement chirurgical à un âge adéquat, le tissu
testiculaire cryptorchide n’ait pu répondre correctement
au réveil tardif et spontané de la sécrétion hypophysaire
de gonadotrophines. Afin de tester cette hypothèse,
l’étude des gènes KAL1, FGFR1, FGF8, PROK2 et PROKR2
a été entreprise chez monsieur M. Aucune mutation
n’a été retrouvée sur ces différents gènes. Il n’est donc
pas exclu que cet hypogonadisme “à bascule”, à l’évi-
dence congénital, soit lié à la mutation d’un des autres
gènes (FGF17, FLRT3, DUSP6, IL17RD, SPRY4, CHD7,
SEMA3A, NELF, WDR11, HS6ST1) dont la responsabilité
dans un tel phénotype est connue (9) ou d’un autre gène
qui s’ajouterait à cette longue liste et resterait à découvrir.
Dans ce dernier cadre, on ne peut exclure l’inscription
du phénotype de monsieur M. dans celui d’un syndrome
de Johnson-McMillin. Cette entité, décrite en 1983,
associe alopécie, malformation des oreilles, trouble
de la conduction auditive, anosmie ou hyposmie et
hypo gonadisme hypogonadotrope (10). Peuvent s’y
associer une hypo- ou une anhidrose (11), des nævi,
une asymétrie faciale, un retard de croissance. Le
retard mental y est inconstant. L’ensemble du tableau
clinique observé chez ce patient, au QI parfaitement
normal, pourrait donc s’inscrire dans ce syndrome.
Si cette hypothèse était exacte, elle s’ajouterait à la
liste des causes d’hypo gonadisme hypogonadotrope
congénital spontanément réversible. L’affirmation de
ce diagnostic, ou au contraire sa réfutation, ne pourra
reposer que sur les résultats de l’étude génétique. Elle
devra néanmoins attendre, car le gène responsable du
syndrome de Johnson-McMillin, transmis sur un mode
autosomique dominant, n’a pas encore été précisément
identifié. Il existe cependant des pistes, et le gène codant
le récepteur de type A de l’endothéline, qui intervient
dans le développement embryonnaire du premier arc
branchial, pourrait en être un candidat potentiel (12).
En attendant, monsieur M., au prix du maintien d’une
substitution en testostérone, mène une vie personnelle
et professionnelle tout à fait normale.
■J.M. Kuhn déclare ne pas
avoir de liens d’intérêts.
Retrouvez
l’intégralité
des références
bibliographiques
sur www.edimark.fr
Figure 2. Résultat de l’examen encéphalique par résonance magnétique nucléaire. A. Coupe
sagittale T1 où l’on peut observer la dysmorphie faciale. B. Coupe coronale T2 confirmant
l’absence de bulbes olfactifs.
0035_MET 35 09/02/2016 14:54:01

Correspondances en Métabolismes Hormones Diabètes et Nutrition - Vol. XX - n° 1 - janvier 2016
48
Cas clinique
5.
Root AW. Reversible isolated hypogonadotropic hypogonadism due
to mutations in the neurokinin B regulation of gonadotropin-releasing
hormone release. J Clin Endocrinol Metab 2010;95(6):2625.
6.
Gianetti E, Tusset C, Noel SD et al. TAC3/TACR3 mutations reveal preferen-
tial activation of gonadotropin-releasing hormone release by neurokinin
B in neonatal life followed by reversal in adulthood. J Clin Endocrinol
Metab 2010;95(6):2857.
7. Sidhoum VF, Chan YM, Lippincott MF et al. Reversal and relapse of
hypogonadotropic hypogonadism: resilience and fragility of the repro-
ductive neuroendocrine system. J Clin Endocrinol Metab 2014;99(3):861.
8. Raivio T, Falardeau J, Dwyer A et al. Reversal of idiopathic hypogona-
dotropic hypogonadism. N Engl J Med 2007;357(9):863-73.
9. Valdes-Socin H, Rubio Almanza M, Tomé Fernández-Ladreda M,
Debray FG, Bours V, Beckers A. Reproduction, smell, and neurodevelopmental
disorders: genetic defects in different hypogonadotropic hypogonadal
syndromes. Front Endocrinol (Lausanne) 2014;5:109.
10. Johnson VP, McMillin JM, Aceto T Jr, Bruins G. A newly recognized
neuroectodermal syndrome of familial alopecia, anosmia, deafness, and
hypogonadism. Am J Med Genet 1983;15(3):497.
11. Johnston K, Golabi M, Hall B, Ito M, Grix A. Alopecia-anosmia-deafness-
hypogonadism syndrome revisited: report of a new case. Am J Med Genet
1987;26(4):925.
12. Gordon CT, Weaver KN, Zechi-Ceide RM et al. Mutations in the endo-
thelin receptor type A cause mandibulofacial dysostosis with alopecia.
Am J Hum Genet 2015;96(4):519-31.
Références (suite)
0048_MET 48 09/02/2016 14:54:01
1
/
3
100%