Compte-rendu public de la CNMV – réunion n°5 du 18

1
Agence nationale du médicament vétérinaire
BP 90203 - 35302 Fougères cedex
Téléphone : 02 99 94 78 78 - Télécopie : 02 99 94 78 64
MÉDICAMENTS VÉTÉRINAIRES
COMPTE RENDU PUBLIC DE LA COMMISSION NATIONALE
DES MÉDICAMENTS VÉTÉRINAIRES
Réunion n°5 du 18 octobre
Sommaire
1 - QUORUM ET CONFLITS D’INTÉRÊTS ............................................................................................. 4
1.1 - QUORUM ............................................................................................................................................ 4
1.2 - CONFLITS D’INTERETS ......................................................................................................................... 4
2 - ADOPTION DU COMPTE RENDU DE LA RÉUNION DU 20 SEPTEMBRE 2011 ........................... 4
4 - EXAMEN DES SUJETS EN LIEN AVEC DES DOSSIERS RÉGLEMENTAIRES ............................ 4
4.1 - PHARMACOVIGILANCE : AVIS SUR LE BILAN DES DECLARATIONS D’EFFETS INDESIRABLES......................... 4
4.2 - AVIS SUR LES DEMANDES DE RENOUVELLEMENT D’AMM ....................................................................... 5
5 - ACTUALITÉS DU MÉDICAMENT VÉTÉRINAIRE ............................................................................ 5
5.1 - DEMANDES D’AMM ............................................................................................................................. 5
5.2 - DEMANDES D’INSCRIPTION SUR LISTE POSITIVE ..................................................................................... 5
5.3 - AMM RECEMMENT DELIVREES PAR LA COMMISSION EUROPEENNE ........................................................ 5
5.4 - AMM RECEMMENT DELIVREES PAR L’ANMV SUITE A UNE PROCEDURE DE RECONNAISSANCE MUTUELLE
OU PROCEDURE DECENTRALISEE ........................................................................................................... 5
5.5 - RENOUVELLEMENT D’AMM PAR PROCEDURE DE RECONNAISSANCE MUTUELLE ...................................... 5
5.6 - ACTUALITES DE L’AGENCE ................................................................................................................... 6
5.6.1. Rapport du CGAAER sur le suivi post-autorisation de mise sur le marché du médicament
vétérinaire. Juin 2011................................................................................................................... 6
5.6.2. Bilan de l’appel à candidature d’experts pour la création d’un groupe de travail « autovaccins
à usage vétérinaire ». .................................................................................................................. 6
5.6.3. Informations sur la journée ANSES sur l’antibiorésistance en santé animale du 18 Novembre
2011. ........................................................................................................................................... 6
5.6.4. Procédure d’arbitrage sur l’utilisation de l’enrofloxacine chez le lapin. ...................................... 6
5.7- ACTUALITES DES MEMBRES DE LA COMMISSION ..................................................................................... 6
5.7.1. Lexique des termes utilisés dans le cadre des indications d’utilisation des médicaments
vétérinaires (métaphylaxie, prophylaxie, prévention en milieu infecté) ...................................... 6
6 - SAISINES ............................................................................................................................................ 7
6.1 - SAISINE SUR L’UTILISATION DE POUDRES ORALES OU DE POUDRES POUR SOLUTION BUVABLE EN MELANGE
DANS L’ALIMENT, EN ELEVAGE PORCIN .................................................................................................. 7
7 - CALENDRIER DES REUNIONS DE LA CNMV POUR 2012 ............................................................ 7

2
Etaient présents :
MEMBRES DE DROIT
MINISTERE DE L’AGRICULTURE - Direction Générale de l’Alimentation
M. PICARD
MINISTERE DE LA SANTE - Direction Générale de la Santé
Mme HANOUET
Anses - AGENCE NATIONALE DU MEDICAMENT VETERINAIRE
M. MOUROT
MEMBRES NOMMES
M. FAROULT (président) - Docteur Vétérinaire Rouen
Mme HAGEN-PICARD (vice-présidente) - Professeur ENV Toulouse
M. ALVINERIE - Chercheur émérite INRA Toulouse
M. BERNY - Professeur ENV Lyon
M. BOUSQUET-MELOU - Professeur ENV Toulouse
Mme CADIERGUES - Maître de conférence ENV Toulouse
Mme CHETBOUL - Professeur ENV Alfort
M. FICHEUX - Pharmacien proposé par l’Académie nationale de pharmacie
M. HUGNET - Docteur Vétérinaire La Bégude de Mazenc
M. MAILLARD - Maître de conférence ENV Toulouse
M. MILLEMANN - Maître de conférence ENV Alfort
M. ROBERTON - Docteur Vétérinaire Tours
EXPERTS EXTERIEURS
M. FORTINEAU - Docteur Vétérinaire Châteaugiron
Mme REHBY - Docteur vétérinaire à la retraite Gueugnon
M. PELLERIN - Professeur ONIRIS Nantes
REPRESENTANT DU SYSTEME NATIONAL DE TOXICOVIGILANCE
Mme PULCE
REPRESENTANTS DE L’INDUSTRIE DES MEDICAMENTS VETERINAIRES
Mme BARTHELEMY
Mme GUIRAL-TREUIL
EXPERTS DE L' ANSES - AGENCE NATIONALE DU MEDICAMENT VETERINAIRE
Mme AMAR
Mme LOUET
Mme SALERY
Mme STEVENIN
M. VASSAUX

3
Etaient excusés :
MEMBRES NOMMES
Mme BOULLIER – Maître de conférence ENV Toulouse
Mme NORMAND - Docteur vétérinaire Pontivy
REPRESENTANT DES ASSOCIATIONS DE CONSOMMATEURS
M. FLINOIS – Docteur vétérinaire
REPRESENTANT DE LA COMMISSION NATIONALE DE PHARMACOVIGILANCE
M. CARON – Président de la commission nationale de pharmacovigilance
Etaient absents :
MEMBRES NOMMES
M. ZENNER - Professeur ENV Lyon
AFSSAPS - AGENCE FRANCAISE DE SECURITE SANITAIRE DES PRODUITS DE SANTE
Mme FOSSET MARTINETTI

4
1 - QUORUM ET CONFLITS D’INTÉRÊTS
1.1 - Quorum
Après vérification du quorum, le président a ouvert la séance.
1.2 - Conflits d’intérêts
Aucun conflit d’intérêt n’a été déclaré pour cette commission.
2 - ADOPTION DU COMPTE RENDU DE LA RÉUNION DU 20 SEPTEMBRE 2011
Le compte rendu de la réunion du 20 Septembre 2011 est approuvé à l’unanimité des membres présents.
3 - INFORMATIONS
3.1 - Présentation de la norme AFNOR NF X 50-110 relative à la qualité en expertise
Dans le cadre de l’article 6 du règlement intérieur « modalités de l’expertise collective » qui indique que
l’expertise de la commission est réalisée conformément aux prescriptions de la norme NF X 50-110,
l’expert de l’Anses à l’origine de la norme en a fait une présentation détaillée afin de sensibiliser les
membres de la commission sur les points clés de cette norme.
4 - EXAMEN DES SUJETS EN LIEN AVEC DES DOSSIERS RÉGLEMENTAIRES
4.1 - Pharmacovigilance : avis sur le bilan des déclarations d’effets indésirables
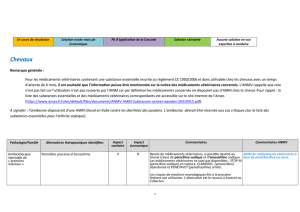
L’ANMV présente un bilan des effets indésirables graves recueillis entre le 09/09/2011 et le 05/10/2011.
80 cas graves ont été recensés durant cette période.
La répartition en fonction des espèces concernées est comme suit :
Pour cette période, 93 médicaments sont cités dans les déclarations. 83 médicaments sont concernées
une seule fois et 8 deux fois. FRONTLINE COMBO SPOT ON CHAT (MERIAL) et PORCILIS AR-T DF
(INTERVET INTERNATIONAL) sont inclus dans respectivement 4 et 3 déclarations. Pour FRONTLINE
COMBO SPOT ON CHAT, 2 cas concernent des lapins, une espèce contre-indiquée par l’AMM et deux
cas d’insuffisance rénale chez le chat. Dans un cas, le médicament est considéré comme non responsable
de l’effet indésirable et dans l’autre, les informations disponibles ne permettent pas de conclure.
Quant au PORCILIS AR-T DF, 3 cas ont été enregistrés avec 1 cas d’anaphylaxie et 2 cas encore en
évaluation.
Pour les vaccins contre la maladie hémorragique du lapin, comme indiqué lors de la réunion de septembre
le bilan des réponses des 4 titulaires concernés a été présenté par l’ANMV. Aucun cas de manque
d’efficacité n’a été signalé pour les vaccins de deux titulaires. Les deux autres titulaires confirment
l’existence de tels cas avec leurs vaccins. La réévaluation du rapport bénéfice-risque de ces vaccins sera
effectuée dès la réception des résultats des études en cours.
0 10 20 30 40
Chiens
Chats
Bovins
Lapins
Porcins
Ovins
Humains
Cobayes
Furets
Equins
34
19
10
5
5
2
2
1
1
1

5
4.2 - Avis sur les demandes de renouvellement d’AMM
Se reporter au relevé des avis de la commission du 18 Octobre 2011 publié sur le site de l’Anses ANMV.
5 - ACTUALITÉS DU MÉDICAMENT VÉTÉRINAIRE
5.1 - Demandes d’AMM
La commission est favorable à l’AMM de :
AQUAFLOR, du laboratoire INTERVET, prémélange médicamenteux à base de florfénicol destiné aux
truites d’eau douce.
ZULVAC COMBO 1+8 SUSPENSION INJECTABLE POUR BOVIN, du laboratoire PFIZER HOLDING
FRANCE, vaccin contre la FCO.
5.2 - Demandes d’inscription sur liste positive
Pour être éligibles à l’inscription sur la liste positive, les médicaments doivent être utilisés dans le cadre
d’un programme sanitaire d’élevage c’est à dire correspondre à des interventions systématiques dans un
but prophylactique sur l'ensemble d'un troupeau selon un calendrier préétabli. Les leptospiroses bovines
étant assez rares au niveau national, la commission estime que le critère du caractère systématique n’est
pas respecté. Dans ces conditions, elle n’est pas favorable à une inscription sur la liste positive des
vaccins correspondants.
5.3 - AMM récemment délivrées par la Commission Européenne
La procédure centralisée de demande d’AMM pour le médicament suivant s’est terminée favorablement :
RECOCAM 20 MG/ML SOLUTION INJECTABLE du laboratoire CF PHARMA, à base de méloxicam
destinée aux bovins, porcs et chevaux. Ce médicament est un générique du METACAM.
5.4 - AMM récemment délivrées par l’ANMV suite à une procédure de reconnaissance
mutuelle ou procédure décentralisée
Les procédures décentralisées ou de reconnaissance mutuelle de demandes d’AMM pour les
médicaments suivants se sont terminées favorablement :
EXETEC 2, EXETEC 10, EXETEC 25 du laboratoire VETOQUINOL, hybrides des DOLPAC 2, 10 et 25,
comprimés à base d’oxantel, de pyrantel et de praziquantel, destinés chez les chiens au traitement curatif
des infestations parasitaires mixtes par les stades adultes de certains nématodes et cestodes.
ELIMINALL 50 MG SOLUTION POUR SPOT-ON POUR CHATS, ELIMINALL 67 MG SOLUTION POUR
SPOT-ON POUR CHIENS, ELIMINALL 134 MG SOLUTION POUR SPOT-ON POUR CHIENS,
ELIMINALL 268 MG SOLUTION POUR SPOT-ON POUR CHIENS, ELIMINALL 402 MG SOLUTION
POUR SPOT-ON POUR CHIENS du laboratoire KRKA, hybrides des médicaments FRONTLINE SPOT-
ON, à base de fipronil.
CLAVUDALE 50 MG COMPRIME POUR CHATS ET CHIENS, CLAVUDALE 250 MG COMPRIME POUR
CHIENS, CLAVUDALE 500 MG COMPRIME POUR CHIENS du laboratoire DECHRA, génériques des
produits SYNULOX 50, SYNULOX 250 et SYNULOX 500 du laboratoire PFIZER, médicaments à base
d’amoxicilline et d’acide clavulanique.
BENEFORTIN 2,5 COMPRIME POUR CHIENS ET CHATS, BENEFORTIN 5 COMPRIME POUR CHIENS,
BENEFORTIN 20 COMPRIME POUR CHIENS du laboratoire LAVET PHARMACEUTICALS, génériques
des médicaments FORTEKOR 2,5, 5 et 20 à base de bénazépril.
5.5 - Renouvellement d’AMM par procédure de reconnaissance mutuelle
Se reporter au relevé des avis de la commission du 18 Octobre 2011 publié sur le site de l’Anses ANMV.
 6
6
 7
7
1
/
7
100%