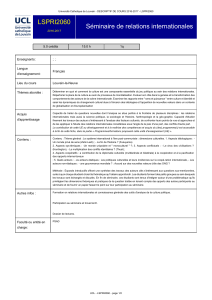
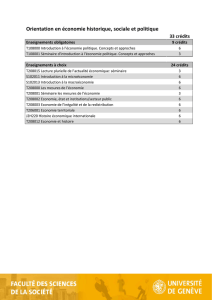
Optique pour la biologie : Y. Usson

!"#!$#!%&
!&
Op#que'pour'la'Biologie'
Grenoble'2015' Séminaire'Dautreppe'
'()*+,-&(',.&/0&1*'/'2*-&
3456&,77'89&/:;<&)*=>?*=029&,@A45B6ACD&2B5@E;F5&0FG56&
Op#que'pour'la'Biologie'
Grenoble'2015' Séminaire'Dautreppe'
*@45@HE@&:IBA;JD5&:JK&EGHLA5@6&MEFF:@N:A6&O:@6&5C&P:LM:BBA:&Q:@665@&5C&6E@&RF6&5@&!%S"<&
2:FAFD5&!T"S&U&J@&occhiolino9&J@&VALBE6LEG5&LEVGE6D&NWJ@5&F5@HFF5&LE@45K5&5C&NWJ@5&:JCB5&
LE@L:45<&
>5&65B:AC&0@CE@A&4:@&/5JJX5@ME5Y&Z!T[$?!\$[]&^JA&:_BD&F`:I5@HE@&N56&;AEFEaA6C56&6JB&F56&
GE66A;AFACD6&5C&F`A@CDBbC&N5&F:&VALBE6LEGA5<&

!"#!$#!%&
$&
Op#que'pour'la'Biologie'
Grenoble'2015' Séminaire'Dautreppe'
CLSM
GFP & TPE
EPI-FLUORESCENCE
Bibliometry (Web of sciences)
Op#que'pour'la'Biologie'
Grenoble'2015' Séminaire'Dautreppe'
Microscopie'confocale'
Stratégie):&B5c5C5B&F:&FJVAdB5&MEB6&eEL:F5&
Approche):&RFCB:a5&EGH^J5&

!"#!$#!%&
[&
Op#que'pour'la'Biologie'
Grenoble'2015' Séminaire'Dautreppe'
*@45@HE@&Ee&LE@eEL:F&VALBE6LEG5&
=:B4A@&=A@6Yf&Z!S%\]&
Op#que'pour'la'Biologie'
Grenoble'2015' Séminaire'Dautreppe'
7EJBL5&F:65B&
';c5LHe&
7G5LAV5@&
(F:@&eEL:F&E;c5C&
(F:@&eEL:F&&6EJBL5&
(F:@&eEL:F&N5&NDC5LHE@&
(=&
&g&GA@MEF5&h&
iAFCB5&N`:BBbC&
>E@eEL:F&U&LE@cJa:A6E@&N5&GF:@&eEL:JK&

!"#!$#!%&
j&
Op#que'pour'la'Biologie'
Grenoble'2015' Séminaire'Dautreppe'
%&kV& >E@45@HE@@5F&
=ACELME@NBA56&N:@6&J@5&L5FFJF5&4A4:@C5&ZBMEN:VA@5&!$[]&
>E@eEL:F&VALBE6LEGf&
75LHE@@5V5@C&EGH^J5&
LE@eEL:F&
Op#que'pour'la'Biologie'
Grenoble'2015' Séminaire'Dautreppe'
Microscopie'à'excita#on'à'deux'photons'
Stratégie):&LE@R@5B&F:&FJVAdB5&N`5KLAC:HE@&:J&eEf5B&N5&F:&F5@HFF5&
Approche):&5KLAC:HE@&@E@?FA@D:AB5&

!"#!$#!%&
%&
Op#que'pour'la'Biologie'
Grenoble'2015' Séminaire'Dautreppe'
.5c5C&N56&GMECE@6&
OEB6?eEL:JK&
(BA@LAG5&LE@eEL:F& -KLAC:HE@&;A?GMECE@A^J5&
(BE4E^J5B&F`5KLAC:HE@&
0J&@A45:J&NJ&eEf5B&
Op#que'pour'la'Biologie'
Grenoble'2015' Séminaire'Dautreppe'
Comparaison entre SPE et TPE
S0
S1
TPE
Emission
λe < λi
S0
S1
SPE
Emission
λe > λi
Excitation linéaire
λi
Excitation non-linéaire
λi
λi
ΔT
σSPE = σa = 10-16 cm2
σa
σa2
σa1
σTPE = σa1 σa2 ΔT
= 10-34cm4.10-15s
S1’ S1’
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
1
/
32
100%