Document

TP n°10 Chimie
Partie D : Elaborer un produit de consommation
Classe : Spéc.
Page 1 sur 2
Anodisation de l’aluminium
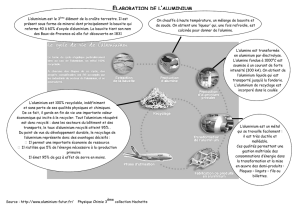
I/ But de l’anodisation
La plupart des métaux sont de bons réducteurs car ils s’oxydent relativement facilement à l’air. L’aluminium,
métal très réducteur, s’oxyde très facilement en donnant une couche d’alumine (oxyde d’aluminium) de
quelques nanomètres d’épaisseur qui protège le métal contre la poursuite de la corrosion.
L’anodisation de l’aluminium a pour but d’augmenter l’épaisseur de la couche d’alumine à la surface d’une
pièce en aluminium afin de mieux la protéger.
II/ Mise en évidence de l’alumine
Expérience
- Faire tomber de la poudre d’aluminium dans la flamme d’un bec bunsen incliné pour éviter que la
poudre ne tombe dans le bec. Noter les observations
- Placer l’extrémité d’un fil d’aluminium maintenu avec une pince en bois dans la flamme d’un bec
bunsen. Noter les observations.
Questions
a) Interpréter les observations faites sur l’aluminium en poudre dans la flamme.
b) Sachant que la formation de l’alumine est due à l’association de l’ion Al3+ et de l’ion O2–, retrouver sa
formule brute ainsi que l’équation de la réaction qui se produit dans la flamme avec la poudre.
c) Interpréter les observations faites sur le fil d’aluminium dans la flamme.
d) Proposer une explication justifiant que l’aluminium en poudre brûle dans l’air contrairement au fil
d’aluminium.
III/ Anodisation avec coloration
1) Montage
L’électrolyte est une solution d’acide sulfurique à
2 mol.L-1. La cathode est une lame de plomb et
l’anode est la pièce d’aluminium à anodiser.
On règle la tension du générateur de façon à
obtenir une intensité de 0,2 A dans le circuit.
Questions
a) Sachant que lors de l’anodisation il se forme
des ions Al3+ (qui forment ensuite l’alumine)
définir la nature de l’électrode formée par la
pièce d’aluminium.
b) Préciser le sens du courant et celui des
électrons dans le circuit électrique.
c) Annoter le schéma ci-contre et préciser la
nature des deux multimètres représentés.
L’aluminium a une densité environ trois fois plus faible que celle de l'acier ou du cuivre ; il est malléable,
ductile et facilement usiné et moulé. Il possède une excellente résistance à la corrosion et une grande
longévité. Il est également non magnétique et ne provoque pas d'étincelle.
Symbole : Al
Aspect : (d=2,7 ; Tfus = 933,5 K)
Métal mou, léger, mais résistant avec un aspect argent-gris mat, dû à une couche mince d'oxydation
d’alumine (Tfus = 2327 K) de 5 à 10 nm qui se forme rapidement quand on l'expose à l'air et qui empêche la
corrosion de progresser dans des conditions normales d'expositions chimiques.
–
+

TP n°10 Chimie
Partie D : Elaborer un produit de consommation
Classe : Spéc.
Page 2 sur 2
2) Préparation de la pièce d’aluminium
Mode opératoire
- S’équiper de gants et de lunettes de protections.
- Dégraisser la surface à anodiser en la frottant avec un chiffon imbibé d’acétone.
- Immerger la surface à anodiser dans un bain de soude à 5 mol.L-1 pendant 5 minutes environ.
- Rincer la pièce à l’eau froide.
- Placer ensuite la partie à anodiser dans une solution d’acide nitrique à 5 mol.L-1 pendant une dizaine de
secondes.
- Rincer la pièce à l’eau froide.
3) Réalisation de l’anodisation
Mode opératoire
- Placer la pièce à anodiser dans le montage d’électrolyse et démarrer l’électrolyse pendant une vingtaine
de minutes.
- Après l’électrolyse, récupérer la pièce et la laver à l’eau.
- Chauffer de l’eau dans une casserole jusqu’à ébullition.
- Pendant ce temps, plonger la pièce d’aluminium dans une solution diluée d’ammoniac pour supprimer
d’éventuelles traces d’acide, puis la rincer une nouvelle fois à l’eau.
- Plonger alors la pièce dans une solution de rouge d’alizarine à 0,05 mol.L-1 pendant 5 minutes.
- Pour finir, placer la partie colorée de la pièce d’aluminium dans l’eau bouillante pendant 5 minutes.
- Retirer la pièce et la laisser sécher.
4) Questions
La cathode
a) Qu’observe-t-on à la cathode ? Ecrire les équations des réactions susceptibles de se produire à cette
électrode. En déduire l’espèce qui se forme vraiment. (couples : H+ / H2(g) ; SO42– / SO2(aq) ; Pb2+ / Pb)
L’anode
b) Ecrire l’équation de la réaction qui se produit à l’électrode d’aluminium et qui forme les ions Al3+.
c) Sachant que les ions Al3+ formés réagissent ensuite avec l’eau du bain d’acide sulfurique pour former de
l’alumine, écrire l’équation de cette réaction.
d) En déduire l’équation complète de la réaction qui se produit à l’anode.
Bilan de l’électrolyse
e) Ecrire l’équation globale de la réaction de cette électrolyse.
f) En supposant que l’électrolyse ait durée exactement 20 minutes avec une intensité I = 200 mA,
déterminer la quantité et la masse d’alumine formé.
Ces réactions provoquent donc la formation d’une couche d'alumine qui est par ailleurs un très bon isolant.
L’électrode d’aluminium se recouvrant d’une pellicule isolante risque donc de stopper l’électrolyse. C’est pour
cette raison qu’il faut utiliser un électrolyte tel que l’acide sulfurique qui dissout partiellement la couche
d’alumine. On obtient alors à la surface de la plaque d’aluminium des structures d’alumine hexagonales et
poreuses permettant à l’électrolyse de se poursuivre et à la couche d’alumine de continuer à épaissir.
Les pigments apportés lors du bain dans le rouge d’alizarine viennent alors combler ces pores. Pour finir, le
traitement à l’eau bouillante forme des cristaux de böhmite (Al2O3, H2O) qui recouvrent le tout et maintiennent
les pigments dans les pores. La coloration est donc fixée.
g) Annoter les schémas ci-dessous :
……………………………..
……………………………..
……………………………..
1
/
2
100%