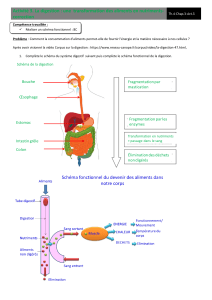
13. Digestion et absorption des aliments

123
13. Digestion et absorption des aliments
Introduction
La digestion est le processus par lequel les molécules organiques sont rompues
(réduites) pour être rendues absorbables par le tube digestif.
L'absorption est le processus par lequel les produits de la digestion, les vitamines,
les minéraux et l'eau traversent la barrière digestive. La figure 13.1 donne une vue
générale de la digestion pour les glucides, les lipides et les protéines.
Fig. 13.1.: Vue générale de la digestion des lipides, protéines et glucides
13.1. Digestion des glucides
Chez les monogastriques, les glucides représentent une part importante de l'apport
énergétique. Chez l'homme, le principal glucide est représenté par l'amidon. Chez
les herbivores, le principal glucide est la cellulose. Il s'y ajoute pour toutes les
espèces quelques oligo-saccharides. Selon la structure chimique de ces différentes
substances, la digestion se fera soit directement par les enzymes de l'individu soit
par fermentation bactérienne (herbivores), c'est-à-dire par des enzymes
bactériennes (fig.13.2.). Chez les monogastriques, les produits terminaux de la
digestion sont des monosaccharides (glucose, galactose, fructose) qui sont les
molécules absorbables par le tube digestif.
Triglycérides
Protéines
Glucides
ESTOMAC
INTESTIN GRELE
1- Digestion
Acides gras
β-monoglycerides
Peptides
Acides aminés
Oligosaccharides
Disaccharides
INTESTIN
GRELE
2- solubilisation
micellaire
Micelles mixtes
avec acides
biliaires
MUQUEUSE
JEJUNALE
3-Absorption
TG Chylomicrons
Acides aminés
Monosaccharide
CIRCULATION
LYMP
HATIQUE
4- Transport
Chylomicrons
SANG

124
Figure 13.2. Digestion et absorption des glucides chez les ruminants et les
non-ruminants. Chez les herbivores, le principal glucide alimentaire est la cellulose
dont la digestion se fera essentiellement dans le réticulo-rumen (ruminants) ou le
gros intestin (caecum colon) avec pour produits terminaux des acides gras volatils
(AGV) qui seront directement absorbés par la paroi du rumen. Chez les
monogastriques de type omnivore, les glucides (essentiellement l'amidon) seront
digérés dans l'intestin pour donner du glucose.
Omnivores Herbivores
Enzymes
digestives
Glucides
Fermentation
microbienne
Glucose dans
l’intestin grêle Acides gras volatils dans le
rumen ou le caeco-côlon
Absorption dans la
circulation sanguine
13.1.1. Rappels sur la structure des glucides
L'amidon
(du latin amylum, fleur de farine) est un glucide de réserve utilisé par les
végétaux supérieurs pour stocker l'énergie. C'est l'équivalent du glycogène pour les
animaux. L'amidon est un polysaccharide de formule chimique
(
)
. Il est
composé de deux fractions polysaccharidiques : l'amylose et l'amylopectine.
L'amylose
est une molécule formée d'environ 600 molécules de glucose chaînées
linéairement. Pour les chaînes simples, les liaisons sont de type α
αα
α
-(1-4) glucose
. En
revanche,
l'amylopectine
est une molécule avec des ramifications pour lesquelles
les chaînes ramifiées sont formées avec des liaisons de type α-(1-6) tous les 24-30
glucoses (fig. 13.3.).
La
cellulose
est également un polymère du glucose dont l'enchaînement est de type
β
ββ
β
-(1-4)-glucose
(fig. 13.4).

125
On retrouve également des oligo-saccharides comme le
saccharose
(glucose +
fructose) qui est une forme de transport des glucides chez les végétaux, le
maltose
(glucose + glucose) et le
lactose
(glucose + galactose).
Les quantités de monosaccharides ingérées sont négligeables chez les mammifères,
pour qui le seul monosaccharide est le glucose.
Figure 13.3
. Amylose (gauche) et amylopectine (droite). L'amylose est une chaîne
linéaire de glucose avec des liaisons de type
α
(1-4) alors que l'amylopectine présent
des ramifications avec des liaisons
α
(1-6).
Figure 13.4
. La cellulose. La cellulose est un polymère formé par des liaisons de
type – (1-4). La cellulose est une molécule linéaire (sans ramification) formée par
1000 to 10000 résidus de type -D-glucose. Une fibre de cellulose est formée par
environ 500 000 molécules de cellulose.
13.1.2. Les enzymes digestives
La digestion des glucides implique une hydrolyse c'est-à-dire la capture de l'eau (fig.
13.5.). L'hydrolyse est une réaction spontanée très lente qui est accélérée par des
enzymes
. Les enzymes sont toutes des protéines et elles sont nommées par leur
substrat auquel on ajoute le suffixe "
ase
". Les mammifères ne possèdent pas
liaisons
-
(1,4)

126
d'enzymes capables d'attaquer les liaisons β-(1-4)-glucose de la cellulose c'est-à-dire
de
cellulase
. La digestion de la cellulose se fera obligatoirement par
fermentation
microbienne
, les bactéries apportant leur faculté enzymatique pour hydrolyser les
glucides. Cela s'effectue dans des portions anatomiques spécialisées chez les
herbivores et omnivores :
•
Ruminants : réticulo-rumen, caecum
•
Lapin : caecum
•
Cheval : caecum – gros intestin
•
Porc : caecum
Figure 13.5
. Synthèse et dégradation des polymères. La synthèse correspond à
une réaction de déshydratation alors que la dégradation (digestion) est une
hydrolyse c'est-à-dire l'adjonction d'une molécule d'eau dans la chaîne.
Polymerization Reaction
Condensation or
Dehydration Reaction
Requires energy, biological
catalysts (enzymes
)
Digestive enzymes
catalyze hydrolytic
reactions
La digestion bactérienne des glucides n'aboutit pas à la formation d'oligo-saccharides
mais à celle d'
acides gras volatils
(
AGV
). De même, les enzymes digestives des
mammifères ne peuvent pas attaquer les liaisons (1-6) des pectines.
Les enzymes produites par le tube digestif et impliquées dans la digestion des
glucides sont :
1)
l'amylase salivaire
ou
ptyaline

127
2)
l'
α
αα
α
-amylase
pancréatique
3)
les disaccharidases
des cellules de la muqueuse de l'intestin grêle (
maltase
,
sucrase
et
lactase
).
Le tableau 13.1. précise les substrats et les enzymes.
Tableau 13.1
: principaux glucides alimentaires et enzymes digestives
correspondantes chez les vertébrés.
Substrat de
départ
Enzymes extracellulaires Enzymes de la
muqueuse intestinale
Produits terminaux
Amylose
Amylopectine
Glycogène
maltose
α-amylase isomaltose
α-(1-4)-oligosaccharides
Maltase
Isomaltase
Glucose
Disaccharides
Sucrose (végétaux)
Lactose (lait)
Sucrase
(saccharase)
Lactase
Glucose et fructose
Glucose et galactose
Une
amylase
est une saccharidase c'est-à-dire une enzyme clivant les
polysaccharides.
L'α
αα
α
-amylase salivaire
est produite par les glandes salivaires ; elle agira sur le bol
alimentaire situé au milieu de l'estomac (le pH optimum d'activité est de 7). Cela
commence la digestion de l'amidon avec une production de maltose et de
dextrine (petits polymères du glucose). Le chien ne possède pas d'amylase
salivaire.
L'α
αα
α
-amylase pancréatique
est produite par le pancréas ; elle attaque les liaisons
α-(1-4) terminales et les α-(1-4) voisines des liaisons α-(1-6). Cela transforme les
polysaccharides en oligo-saccharides (3 à 10 monosaccharides). Chez le chien il
y a une production d'α-amylases par la muqueuse de l'intestin.
La digestion de l'amidon conduit essentiellement à la production de
maltose
(2
glucoses) et de
maltotriose
(3 glucoses) qui seront repris par les
disaccharidases
(fig. 13.6.).
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
1
/
13
100%