Cancer épidermoïde de l`anus - Chirurgie

SOMMAIRE
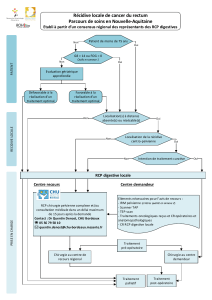
Cancers épidermoïdes du canal anal : bilan, classification et indications
thérapeutiques.
T. BOISSERIE, E. TOUBOUL
Résultats de la radiothérapie et de la radio-chimiothérapie
Des cancers épidermoïdes du canal anal
E. TOUBOUL, T. BOISSERIE
Indication opératoire et suivi après radio-chimiothérapie.
Y. PARC
Carcinome épidermoide de l’anus : technique d’amputation abdomino-
périnéale et de colostomie périnéale
N.ABBES ORABI, A.KARTHEUSER
Techniques de reconstruction périnéale par lambeaux
M. CHAOUAT
Résultats du traitement chirurgical du carcinome épidermoïde du canal anal
J. LEFEVRE

CANCERS EPIDERMOÏDES DU CANAL ANAL : BILAN, CLASSIFICATION ET
INDICATIONS THERAPEUTIQUES.
T. Boisserie, E. Touboul
Oncologie-Radiothérapie, hôpital Tenon A.P.-H.P.
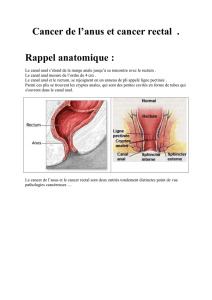
Epidémiologie, histologie et histoire naturelle
Le cancer du canal anal est une tumeur relativement rare, 1,5 % des cancers digestifs. Il touche avec une nette
prépondérance le sexe féminin, avec un pic de fréquence vers la septième décennie1, 2. Les habitudes sexuelles
et la transmission d'une infection à papillomavirus humain de type 16 constituent, actuellement, les facteurs de
risque les plus importants3-8. En France, son incidence est de l’ordre de 1 pour 100 000 habitants, avec une
prédominance chez la femme et la personne âgée9. Il faut noter que l’inflammation, les microtraumatismes
locaux ou les antécédents de pathologie anale bénigne (hémorroïdes, fissures) anciennement considérés
comme des facteurs de risques, ne le sont pas2.
L’histologie principale est le carcinome épidermoïde. Deux variantes histologiques auraient un moins bon
pronostic : le carcinome épidermoïde avec microkystes mucineux et le carcinome verruqueux (équivalent du
condylome géant ou tumeur de Buschke-Lowenstein)10.
L'évolution est dans la grande majorité des cas locale, de proche en proche par contiguïté, et lymphatique
régionale, soit vers les ganglions péri-rectaux et le pédicule hémorroïdaire supérieur, soit vers les ganglions
inguino-cruraux et plus rarement les ganglions iliaques internes, iliaques externes et lombo-aortiques. Les
métastases à distance sont, en revanche, rares et ne sont observées que dans 10 à 12 % des cas11. Cette
évolution explique l'importance des thérapeutiques à action locorégionale à visée curative.
Examen initial et bilan d’extension
Les principaux signes cliniques faisant suspecter un cancer du canal anal sont : les rectorragies, la douleur
anale, une lésion anale persistante et l’incontinence anale. Lorsque ce diagnostic est évoqué, un examen
clinique complet, une confirmation anatomopathologique et un bilan d’extension sont nécessaires à la prise en
charge thérapeutique.
Interrogatoire
Il doit préciser les troubles fonctionnels en termes d’intensité et de fréquence : nombre de selles par jour,
émissions glaireuses, présence de sang, douleur anale et la continence anale. Leur évaluation permet de coter
les signes fonctionnels et d’établir un score fonctionnel sphinctérien préthérapeutique12.
Examen clinique initial
Il doit être effectué idéalement par le gastro-entérologue, le chirurgien et l’oncologue pour aboutir à la
réalisation d’un schéma précis, orienté et coté de l’extension de l’extension tumorale sur lequel reposent la
stratégie thérapeutique et la technique de radiothérapie. L’examen sous anesthésie générale n’est pas
indispensable et dépend des difficultés rencontrées pour effectuer un examen ano-rectal de bonne qualité.
L’examen en position genu-pectorale et/ou décubitus dorsal explore la marge anale et la totalité de la
circonférence du canal anal et du bas rectum. Chez la femme, le toucher bidigital apprécie l’état de la cloison
recto-vaginale. Il est complété par un examen gynécologique au spéculum et au moindre doute, par un frottis
cervico-vaginal avec recherche d’une infection à papillomavirus. Il faut préciser sur le schéma la longueur
centimétrique de la lésion tumorale, la distance entre le pôle inférieur de la tumeur et la marge anale,
l’extension circonférentielle en mentionnant la topographie en termes de quadrants horaires, le caractère
infiltrant, bourgeonnant ou ulcérant et, dans une forme sténosante, l’importance de la sténose en termes de
pourcentage de réduction de la lumière du canal anal. Chez la femme le toucher pelvien recherche une

extension éventuelle dans la cloison recto-vaginale et dans ce cas, apprécie l’état de l’épithélium de
recouvrement de la muqueuse vaginale postérieure. Chez l’homme, le toucher pelvien évalue une extension
relativement rare vers l’axe vésico-prostatique.
Lors du toucher rectal, il est essentiel de rechercher un nodule pararectal ou pelvien présacré, évoquant une
adénomégalie métastatique.
L’examen des aires ganglionnaires inguinales et rétrocrurales est systématique. En cas d’adénomégalies
palpables, leur diamètre est mesuré et leur état précisé par une cytoponction ganglionnaire sous échographie.
Biopsies tumorales
Elles sont réalisées lors de l’examen endoscopique ano-rectal, avec recherche conseillée d’une infection à
papillomavirus sur les prélèvements. Elles doivent être profondes, multiples, effectuées à la fois au centre de la
tumeur et à sa périphérie. Elles doivent être répétées en cas de résultats négatifs et de doute persistant. Les
formes d’aspect trompeur ont imposé la règle d’un examen histopathologique systématique de toute pièce
d’exérèse proctologique, particulièrement devant une forme pseudo-vénérienne ou une forme fissuraire,
notamment lorsqu’elle ne siège pas dans l’une des commissures de 6 à 12 heurs ou qu’elle évolue vers la
chronicité malgré un traitement bien conduit.
Echo-endoscopie ano-rectale
Elle est considérée comme un examen essentiel et le plus fiable pour évaluer, d’une part, l’épaisseur
millimétrique de la tumeur et l’éventuelle extension tumorale vers les muscles sphinctériens et, d’autre part,
l’extension ganglionnaire périrectale et présacrée13, 14. Une image ronde, hypo-échogène, à contours nets de 5
à 10 mm, péri-rectale ou de plus de 10 mm de diamètre est considéré comme pathognomonique d’une
extension tumorale ganglionnaire.
Autres examens
Les clichés radiologiques standards du thorax de face et de profil et l’examen tomodensitométrique abdomino-
pelvien paraissent suffisants pour apprécier le bilan d’extension métastatique à distance. La place du TEP au
18-FDG reste discutée15, elle est notamment utile pour l’exploration ganglionnaire inguinale16, très sensible si
négative17. Si la TEP au 18α-FDG est positive, une cytoponction d’un ganglion inguinal sous échographie
permettra de différencier une adénopathie inflammatoire d’une adénopathie métastatique17.
Le dosage du SCC TA4 (squamous cell carcinoma tumor antigen 4) est un marqueur tumoral intéressant qui
participe à la surveillance pendant et après le traitement lorsque le taux sérique initial avant traitement est
élevé18. La recherche d’une pathologie virale associée n’est effectuée qu’après l’accord du patient : sérologie
VIH, VHC et VHB. La coloscopie est fréquemment proposée dans le but d’éliminer une pathologie colique
associée (rectorragies).
Lorsqu’une chimiothérapie est envisagée, le bilan est complété par un électrocardiogramme, un hémogramme,
le dosage de la créatininémie et le calcul de la clairance rénale de la créatinine, un ionogramme sérique, un
bilan biologie hépatique complet.
Classification
L’ensemble de ce bilan aboutit aux deux classifications tumorales complémentaires les plus utilisées (tableaux
1 et 2), indispensables à l’initiation d’une stratégie thérapeutique adaptée. La première est clinique selon la
classification TNM de l’UICC de 200919 et la deuxième écho-endoscopique13. En revanche, la classification par
stade19 est peu utilisée (tableau 3). Enfin, l’établissement d’un score fonctionnel anal sphinctérien
préthérapeutique12 est élément déterminant dans la conduite d’un traitement conservateur et l’évaluation des
résultats post-thérapeutiques (tableau 4).
Tableau 1 : classification TNM de l’UICC de 200919
Tumeur primitive
T1 : tumeur ≤ 2 cm dans sa plus grande dimension
T2 : tumeur > 2 cm mais ≤ 5 cm dans sa plus grande dimension (de 21 mm à 50 mm)

T3 : tumeur > 5 cm dans sa plus grande dimension
T4 : tumeur, quelle que soit sa taille, qui envahit un ou plusieurs organes adjacents (vagin, urètre, vessie) à
l’exception du rectum, de la peau périnéale, du tissu cellulaire sous-cutané et du sphincter.
Adénopathies régionales (N)
Nx : ganglions non évalués
N0 : pas de métastase ganglionnaire
N1 : ganglions périrectaux
N2 : ganglions iliaque interne et/ou inguinal unilatéraux
N3 : ganglions périrectaux et inguinaux et/ou iliaques internes bilatéraux et/ou inguinaux bilatéraux.
Métastases à distance (M)
MX : non évaluées
M0 : pas de métastase
M1 : métastases à distance
Tableau 2 : écho-endoscopique13
usT1 : atteinte de la muqueuse et de la sous-muqueuse sans atteinte du sphincter interne
usT2 : atteinte du sphincter interne sans atteinte du sphincter externe
usT3 : atteinte du sphincter externe
usT4 : atteinte d’un organe pelvien de voisinage
usN0 : pas d'adénopathie suspecte
usN+ : adénopathie péri-rectale de 5 à 10 mm de diamètre ayant les caractères de malignité (rond,
hypoéchogène, contours nets) ou mesurant plus de 10 mm de diamètre.
Tableau 3 : classification par stade19
Stade 0 : TisN0M0
Stade I : T1N0M0
Stade II : T2-3N0M0
Stade IIIA : T1-2-3N1M0 ; T4N0M0
Stade IIIB : T4N1M0 ; tous T, N2-3M0
Stade IV : tous T, tous N, M1
Tableau 4 : Score fonctionnel sphinctérien anal selon la classification de Tenon12
Score
Fréquence
de
selles
Emissions
glaireuse Saignement Douleur Incontinence
0
1
-
2 /j
-
-
-
-
1
3
-
4 /j
1
-
2 / sem
1
-
2 / sem
Occasionnelle
Occasionnelle,
minime
2
5
-
8 /j
Intermittente
1 /j, apport de
fer
Régulière,
antalgique
usuel
Intermittente
3
<8 /j
Permanente
Persistant,
transfusion de
GR
Intense,
morphinique
Persistante
4
Colostomie
et/ou AAP
Colostomie
et/ou AAP
Colostomie
et/ou AAP
Colostomie
et/ou AAP
Colostomie
et/ou AAP
AAP : Amputation abdomino-périnéale ; GR : globules rouges.

Stratégie thérapeutique
D'une manière générale, les cancers du tractus digestif sont moyennement ou peu radiosensibles. Le
carcinome épidermoïde du canal anal échappe à cette règle. Jusqu'aux années 1970, le traitement du cancer du
canal consistait en une chirurgie radicale dominée par l'amputation abdomino-périnéale20-22. Cependant, au
cours des années 1970 et début 1980, les travaux de l'école française23-26 et du "Princess Margaret Hospital" de
Toronto27 ont pu montrer l'action curative et conservatrice d'une radiothérapie de première intention et ont
fait progressivement régresser les indications chirurgicales mutilantes de première intention28-30. A partir de la
fin des années 1980 et le début des années 1990, de nombreuses études rétrospectives et non randomisées
semblaient montrer qu'un traitement par association radio-chimiothérapie concomitante exclusive avec la
combinaison 5-fluorouracile et mitomycine puis 5-fluorouracile et cisplatine était capable d'augmenter les taux
de conservation sphinctérienne et de contrôle tumoral local, sans élévation importante du risque de toxicité31-
37. A partir des années 90, les études prospectives randomisées ont montré que l’association radio-
chimiothérapie concomitante avec 5-fluorouracile et mitomycine38-40 est capable d’améliorer significativement
le taux de survie avec conservation de la fonction sphinctérienne.
Après une première série d'irradiation externe pelvienne et inguino-crurale de 45 Gy en 5 semaines suivie d'un
repos de 4 semaines il est proposé en cas de réponse tumorale supérieure à 50 % un complément de
radiothérapie localisé au volume tumoral de 15 Gy, soit par irradiation externe, soit par curiethérapie
interstitielle périnéale, selon le volume tumoral initial et sa topographie.
Pour les tumeurs classées T1N0 1 cm, la dose totale d'irradiation peut être limitée à 45-50 Gy pour des
tumeurs infra cliniques après biopsie exérèse et à 50-60 Gy en l'absence d'exérèse41.
Le traitement systématique des aires ganglionnaires inguinales reste discuté dans les tumeurs de petit volume
T1N0M0. Certains auteurs recommandent de se contenter d'une irradiation inguinale unilatérale en cas de
tumeur bien latéralisée42. D’autres auteurs préconisent l’utilisation du prélèvement du ganglion sentinelle
inguinal après double détection associant le bleu patenté et un radio-colloïde43.
La toxicité aiguë non négligeable et le taux de décès toxique de l’ordre de 2 à 3%39, 40, 44 incitent à proposer
l’association radio-chimiothérapie concomitante avec prudence et à peser l’indication au cas par cas, selon le
terrain physiologique du patient et le bénéfice attendu45.
L’intérêt du traitement combiné n’est pas démontré pour les tumeurs classées, selon l’UICC 2009, T1 et T2 de
moins de 4 cm, N0 et classées écho-endoscopiquement uT1-2 N0. Bien que l’ensemble des auteurs s’accordent
pour considérer qu’une tumeur classée T1N0, uT1-2N0 doit être traitée par radiothérapie exclusive à visée
curative et conservatrice12, 27, 41, le traitement des tumeurs classées T2 de moins de 4 cm, N0, uT1-2N0 reste
discuté. En effet, le taux de survie à 5 ans sans colostomie après radiothérapie exclusive ne dépasse pas 70%12
et certains auteurs proposent une association radio-chimiothérapie concomitante, lorsque le terrain
physiologique le permet, afin d’améliorer le contrôle tumoral local sans colostomie.
L’association radio-chimiothérapie concomitante est un standard thérapeutique dans les tumeurs classées,
selon l’UICC 2009, T2 de 4 cm ou plus, T3-4 N0 ou pour tout T, N1-3 et/ou classées écho-endoscopiquement
uT3-4 N0 ou tout T, N+, avec un bénéfice en termes à la fois de contrôle tumoral local et de survie sans
colostomie38-40.
Cependant, le traitement conservateur par radiothérapie exclusive ou par association radio-chimiothérapie
concomitante a ses limites. L’amputation abdomino-périnéale programmable avec épiplooplastie 5 semaines
après la première série d’irradiation de 45 Gy en 5 semaines est indiquée lorsque la tumeur est classée T4 selon
l’UICC 2009 et écho-endoscopiquement uT4, associée à des troubles sévères non régressifs de la fonction
sphinctérienne, dominés par l’incontinence anale ou une fistule recto-vaginale persistante, rendant illusoire
tout traitement conservateur avec un bon résultat fonctionnel.
L’amputation abdomino-périnéale doit être discutée au cas par cas avec le patient, en indiquant les avantages
attendus et les inconvénients, dans les tumeurs de gros volume classées T3-4 ou uT3-4 dont la réponse
tumorale après la première série d’irradiation est inférieure ou égale à 50%46-48.
L’amputation abdomino-périnéale de rattrapage avec lambeau musculo-cutané pédiculé périnéal de fermeture
est proposée en cas de rechute tumorale locale ou de progression tumorale locale, malgré un traitement à
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
1
/
28
100%