Semaine 3 : Propriétés et diagrammes des corps purs - Fun-Mooc

51
22/02/2017
Semaine 3 : Propriétés et diagrammes des corps purs
Objectifs pédagogiques
La troisième semaine est consacrée à l’étude des propriétés des fluides
thermodynamiques.
Après avoir commencé par étudier les propriétés des corps purs, et la manière
dont l'état d'un fluide peut être caractérisé, un approfondissement sur la vapeur
d’eau est effectué, compte tenu de son importance pratique.
Les modèles des gaz parfaits et idéaux sont brièvement présentés, puis un
retour sur la notion d’état est effectué, avec une réflexion sur le choix des
variables d’état à considérer.
Les diagrammes thermodynamiques dans lesquels les cycles peuvent être
visualisés sont alors étudiés, car ils jouent un rôle fondamental dans
l’apprentissage de la discipline.
Le reste de la semaine est consacré à la représentation graphique dans le
diagramme (h, ln(P)) des cycles des systèmes énergétiques simples (centrales
à vapeur, turbines à gaz, machines de réfrigération).
A la fin de la semaine :
- vous saurez identifier les différents états des corps purs
- vous serez capables d’expliquer les énergies mises en jeu lors des
phénomènes de vaporisation et de condensation
- vous serez capables d’utiliser la représentation d’une loi de pression saturante
pour connaître la température à laquelle un corps change de phase en fonction
de sa pression
- vous saurez décrire les modèles des gaz parfaits et idéaux
- vous saurez repérer dans le diagramme (h, ln(P)) les différentes zones et les
allures des différentes évolutions de référence
- et enfin vous saurez représenter dans le diagramme (h, ln(P)) les cycles des
systèmes énergétiques simples
Support de cours
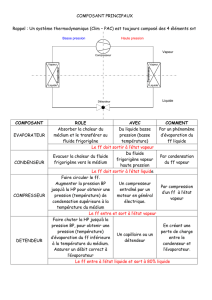
3.1 Propriétés et diagrammes des corps purs
Maintenant que nous avons vu comment calculer les énergies mises en jeu dans les
différentes transformations et quelles sont les évolutions de référence, quelques rappels

Polycopié : MOOC Conversion Thermodynamique de la Chaleur / MS
sur les propriétés des fluides de travail sont nécessaires. Ils nous permettront de
comprendre comment ces propriétés peuvent être représentées graphiquement dans les
diagrammes thermodynamiques, et d’apprendre à nous servir de l’un d’entre eux, le
diagramme (h, ln(P)), dit des frigoristes. Nous pourrons ensuite y tracer les cycles des
machines thermiques qui nous intéressent.
3.1.1 Rappels succincts sur les propriétés des corps purs
Pour pouvoir comprendre le fonctionnement des
machines thermiques, il est fondamental d’avoir
un minimum de connaissances sur les propriétés
des fluides qui les traversent.
Rappelons qu’un corps pur peut se présenter sous
l'une ou plusieurs des trois phases solide, liquide
ou gazeuse.
Dans le plan (P,T) où la pression est en ordonnée
et la température en abscisse, les trois phases
correspondent à trois domaines, séparés par trois
courbes de saturation se rejoignant au point triple
T (figure 3.1.1).
Il s’agit des courbes de sublimation, de vaporisation et de fusion.
Lorsqu'on chauffe un solide à pression constante bien choisie, il se transforme en
liquide, et on parle de fusion. C’est ainsi que la glace chauffée se transforme en eau
liquide.
Si l'on continue à apporter de la chaleur, le liquide se transforme en vapeur, et on parle
de vaporisation. C’est ainsi que si l’on fait bouillir de l’eau dans une casserole, elle
s’évapore et la quantité d’eau qui reste dans la casserole diminue progressivement.
Le phénomène de vaporisation et son contraire, la condensation, jouent un rôle
fondamental dans les cycles des centrales à vapeur et des installations de réfrigération.
Pendant ces transformations, on dit que le fluide est à l’équilibre liquide-vapeur.
La température à laquelle l’équilibre liquide-vapeur prend place est une fonction
croissante de la pression exercée sur le corps considéré.
Elle reste constante tant que la vaporisation n’est pas complète, c’est-à-dire tant que le
titre x5 est compris entre 0 et 1. On appelle la loi de pression saturante la relation qui
donne la pression de saturation d’un fluide en fonction de la température.
Il existe une pression et une température limites au-delà desquelles la zone d’équilibre
liquide-vapeur disparaît. On parle de pression et de température critiques.
Dans le plan (P,T), le point critique représente l'état où la phase de vapeur pure a les
mêmes propriétés que la phase de liquide pur.
5 Rappelons qu’on appelle titre x d’un mélange diphasique d’un corps pur le rapport de la masse
de vapeur à la masse totale (vapeur + liquide)
Figure 3.1.1 : Phases d'un corps

53
22/02/2017
A des températures et pressions plus élevées, appelées supercritiques, il n'est pas
possible d'observer une séparation entre les phases liquide et gazeuse : la frontière qui
sépare les phases liquide et vapeur disparaît au point critique.
3.1.2 Loi de pression saturante
Pour que le
changement de phase
puisse se réaliser, il
est nécessaire de
fournir ou de retirer
de l'énergie, appelée
chaleur latente de
changement d'état.
Au cours de la
vaporisation, on
observe des
variations
importantes du
volume spécifique, la
vapeur étant de
l'ordre de 600 à 1000
fois moins dense que
le liquide. Cette
modification de
volume spécifique se
fait à pression et température constantes.
A titre d’exemple, la
figure 3.1.2 présente la
loi de pression saturante
de l’eau Pvs(T), en
dessous de 100 °C,
température de saturation
de l’eau à 1 atm, c’est-à-
dire environ 1 bar.
Elle montre que la
pression de saturation de
l’eau à température
ambiante est très basse.
Pour 20 °C, elle est de
l’ordre de 0,025 bar.
Dans le condenseur d’une
centrale à vapeur, on
cherche à condenser la
vapeur qui sort de la
Figure 3.1.2 : Loi de pression saturante de l’eau
Figure 3.1.3 : Pressions de condensation et d’évaporation
d’un cycle de réfrigération

Polycopié : MOOC Conversion Thermodynamique de la Chaleur / MS
turbine à la température la plus basse possible afin d’augmenter le rendement du cycle.
Le fluide de refroidissement du condenseur est généralement l’air extérieur ou l’eau d’un
fleuve, qui sont à des températures basses, proches de 10 °C en demi-saison pour fixer
les idées. La température de condensation de l’eau dans le condenseur est donc aussi
basse que possible, et celui-ci fonctionne à une pression très faible, largement inférieure
à l’atmosphérique.
La figure 3.1.3 est un agrandissement de la loi de pression saturante du R134a, entre -18
°C et 50 °C.
Examinons ses implications en terme de valeur des pressions d’évaporation et de
condensation du fluide de travail d’une installation de réfrigération à compression de
vapeur où on suppose que l’enceinte froide est à la température Tef = - 8 °C, et l’air
extérieur à Ta = 35 °C.
Vous pouvez vous référer à la figure 1.4.2 illustrant les transferts d’énergie dans la
machine.
La courbe de la figure 7.1.3 montre que, si l’on utilise ce fluide comme réfrigérant, la
pression d’évaporation doit être inférieure à 2,1 bar environ pour que l’évaporation
prenne place à une température Tevap inférieure à - 8 °C et que l’enceinte froide puisse
céder de la chaleur au fluide. Au condenseur, la pression doit être supérieure à 8,8 bar
pour que la température de condensation Tcond soit supérieure à 35 °C et que le cycle
puisse être refroidi par échange avec l’air extérieur.
La comparaison des
pressions de condensation
de l’eau et du R134a, par
exemple à la température
de 20 °C, montre que les
pressions de saturation
varient beaucoup selon le
fluide thermodynamique
choisi.
Pour une application
donnée, la loi de pression
saturante est l’un des
critères de sélection du
fluide de travail.
Les courbes de la figure 3.1.4 donnent les lois de pression saturante de divers fluides.
En pratique, il faut de surcroît qu’existe un écart suffisant de température entre le fluide
de travail et les sources avec lesquelles il échange de la chaleur, de telle sorte que la
pression d’évaporation est encore plus basse, et la pression de condensation plus élevée.
3.2 : Caractérisation de l’état d’un fluide
Nous avons introduit précédemment les fonctions d’état, grandeurs dont la valeur ne
dépend que de l'état du système, et non pas de son histoire.
Figure 3.1.4 : Pressions de saturation de plusieurs fluides

55
22/02/2017
Un fluide peut être présent sous une ou plusieurs phases.
S’il est monophasique et que l’on considère une petite particule de fluide, son état peut
être défini par deux grandeurs comme sa pression P, sa température T, son volume
massique v, ou encore son énergie interne massique u ou son enthalpie massique h.
Ce sont les variables que nous utiliserons le plus souvent, avec les unités que nous
emploierons.
Attention à ce que les pressions seront généralement exprimées en bar et non en Pascal,
et les températures par défaut en Kelvin et en °C sinon.
A l’équilibre liquide-vapeur, lorsque le fluide est diphasique, la pression et la
température ne sont plus indépendantes.
L’état de la petite particule de fluide peut alors être défini par une grandeur comme sa
pression P ou sa température T, ainsi que :
- soit son titre en vapeur x introduit précédemment.
- soit son volume massique v, ou bien son énergie interne massique u ou son
enthalpie massique h.
3.3 : Exemples d'utilisation pratique des changements de phase
Donnons quelques exemples illustrant soit l'utilisation pratique des changements de
phase, soit les contraintes induites par la présence d'un équilibre liquide-vapeur :
Lorsqu'on ajoute des glaçons à une boisson tiède, elle leur fournit de la chaleur qui
les fait fondre, ce qui la rafraîchit. Comme la chaleur latente de fusion de la glace
est bien supérieure à la capacité thermique massique de la boisson, on obtient l'effet
de refroidissement recherché sans apporter trop d'eau de dilution.
Pour transporter le gaz naturel (composé principalement de méthane) sur de longues
distances par voie maritime, on le liquéfie à une température de - 160 °C environ,
réduisant 600 fois son volume massique par rapport au gaz. Il est ainsi possible de le
maintenir à la pression atmosphérique dans les cuves du méthanier. Bien que ces
cuves soient très bien isolées thermiquement, on ne peut éviter quelques échanges
de chaleur avec le milieu environnant, qui ont pour effet de vaporiser une petite
quantité de gaz, laquelle est utilisée pour la propulsion du navire.
A contrario, le gaz butane ou propane distribué pour les usages culinaires est
confiné à l'état liquide à température ambiante dans des bouteilles métalliques
épaisses, ceci afin de résister à la pression de quelques dizaines de bars qui s'établit
à l'intérieur, et qui varie en fonction de la température extérieure.
Toutes les cuissons réalisées à l'eau bouillante prennent place à 100 °C si la pression
est égale à 1 atmosphère, et ceci quelle que soit la puissance thermique fournie à la
cuisson. C'est ainsi que l'on peut définir avec précision le temps de cuisson pour une
recette culinaire, par exemple pour un œuf à la coque.
Le principe de la cocotte-minute est de s'affranchir de cette limite de 100 °C en
effectuant la cuisson dans une enceinte à une pression supérieure à 1 atm. On peut
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
1
/
33
100%