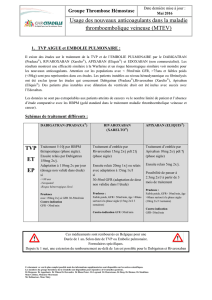
DDoossssiieerr dduu CCNNHHIIM ME valuation F iches

Le
CNHIM
est
une
association
indépendante
à
but
non
lucratif
(loi
1901)
dont
la
vocation
est
de
réaliser
et
diffuser
une
information
rigoureuse
et
scientifique
sur
le
médicament. Tous
les
articles
publiés
dans
Dossier
du
CNHIM
sont
le
fruit
d'un
travail
collectif,
sur
le
fond
et
sur
la
forme,
entre
les
rédacteurs
signataires,
le
comité
de
rédaction,
et
la
rédaction
du
CNHIM
d'une
part,
le
comité
de
lecture
et
certains
experts,
spécialistes
du
sujet
traité,
d'autre
part.
Sur
chaque
sujet,
Dossier
du
CNHIM
ne
publie
donc
pas
les
opinions
de
tel
ou
tel,
mais
réalise
une
analyse
scientifique
critique,
la
plus
objective
possi-
ble. Malgré
tout
le
soin
apporté
à
l’élaboration
de
Dossier
du
CNHIM,
une
erreur
peut
se
glisser
dans
les
informa-
tions
diffusées.
Les
lecteurs
doivent
donc
conserver
la
plus
grande
vigilance
dans
l’exploitation
des
données
à
leur
disposition.
Directeur
de
la
Publication : Xavier Dode
Rédaction
Rédactrice
en
chef : Marie
Caroline
Husson
Comité
de
rédaction : Dominique
Dardelle
(Suresnes),
Albert
Darque
(Marseille),
Bérangère
Gruwez
(Berck),
Isabelle
Fusier
(Paris),
Isabelle
Jolivet
(Paris),
Véronique
Lecante
(Paris),
Nathalie
Le
Guyader
(Paris),
Emma-
nuelle Radideau (Corbeil), Déborah Schlecht-Bauer
(Tours),
Corinne
Tollier
(Paris).
Comité
de
lecture : A.
Baumelou
(Paris),
P.
Beaufils
(Paris),
P.
Faure
(Paris),
J.E.
Fontan
(Paris)
C.
Guérin
(Paris),
S.
Limat
(Besançon),
C.
Montagnier-Pétrissans
(Paris),
M.
Ollagnier
(St
Etienne),
G.
Vedel
(Paris),
J.M.
Vetel
(Le
Mans),
T.
Vial
(Lyon).
Experts pour ce numéro : Joseph Emmerich (Paris),
Isabelle Gouin-Thibault (Ivry sur Seine), Patrick Jego
(Rennes), Marc Samama (Paris).
Rythme
de
parution : 6
numéros
par
an
N°
ISSN
0223,5242.
N°
de
commission
paritaire : G
82049
IMPRESSION : CPI – Imprimerie France Quercy
ZA des Grands Camps, 46090 Mercuès.
CENTRE
NATIONAL
HOSPITALIER
D’INFORMATION
SUR
LE
MEDICAMENT
www.cnhim.org
Hôpital
de
Bicêtre
–
78,
rue
du
Général
Leclerc
B.P.
11 - 94272
Le
Kremlin
Bicêtre
cedex
Tél. : 01
46
58
07
16
–
Fax : 01
46
72
94
56
Courriel : secretariatcnhim@wanadoo.fr
Président : Xavier Dode
Président
fondateur : André
Mangeot
Secrétariat
abonnement : Zohra
El
Hadaoui
Conseil
d’Administration : F. Ballereau (Nantes), G.
Benoit (Paris), H. Bontemps (Villefranche/Saône), O.
Bourdon (Paris), E. Boury (Lomme), J. Calop (Greno-
ble), B. Certain (Paris), M. Courbard-Nicolle (Paris), D.
Dardelle (Suresnes), X. Dode (Lyon), E. Dufay (Luné-
ville), J.E. Fontan (Bondy), D. Goeury (Paris), C. Guérin
(Paris), M.C. Husson (Paris), J.F. Latour (Lyon), N. Le
Guyader (Paris), A. Lepelletier (Nantes), P. Passe (Pa-
ris), P. Paubel (Paris), F. Pinguet (Montpellier), C. Rieu
(Longjumeau), D. Roncalez (Colmar), J.M. Trivier (Lille).
Echos
du
CNHIM Marie-Caroline Husson 3
Antithrombotiques oraux :
Dabigatran, Rivaroxaban, Apixaban.
S. Manin, C. Brunet, A-L. Flaugère, A. Darque, L. Camoin
et la participation du comité de rédaction
Editorial Pr Joseph Emmerich 5
En bref Marie-Caroline Husson 6
1. Introduction 7
2. Maladie thromboembolique : aspects physiopathologiques 8
2.1. Rappels physiologiques : hémostase 8
2.2. Physiopathologie de la maladie thromboembolique 11
3. Médicaments antithrombotiques disponibles 19
3.1. Antithrombotiques de référence 21
3.2. Inhibiteurs spécifiques des facteurs de coagulation 29
4. Nouveaux antithrombotiques oraux 32
4.1. Dabigatran etexilate : PRADAXA® 33
4.2. Rivaroxaban : XARELTO® 57
4.3. Apixaban : ELIQUIS® 77
4.4. Inhibiteurs directs oraux en développement 102
5. Surveillance biologique des traitements par les nouveaux
antithrombotiques oraux 104
6. Eléments de pharmaco-économie 104
7. Discussion / Conclusion 105
Acronymes et sigles 107
Références bibliographiques 107
Annexes 114
Interactions médicamenteuses
- Antiarythmiques 115
S. Skalli, M. Nouvel, A. Faudel, S. Omrani, M. Aitichou, S. Parat, C. Rioufol
- Neuroleptiques antiémétiques 131
S. Chanoine, E. Odouard, E. Franchon, R. Faure, N. Vantard, F. Ranchon,
V. Schwiertz, C. Gourc, R. Lecointre, C. Rioufol
- Neuroleptiques 137
M. Aitichou, A. Faudel, M. Nouvel, S. Skalli, S. Omrani, S. Parat, C. Rioufol
Résumés
des
derniers
numéros
parus 147
Au
sommaire
de
Dossier
du
CNHIM 148
Bulletin d’abonnement 2011 149
Bulletin d’abonnement 2012 150
Dossier
du
CNHIM
participe
à
l’ISDB,
réseau
international
de
revues
indépendantes
de
forma-
tion
thérapeutique.
Le
CNHIM
a
la
propriété
des
textes
publiés
dans
ce
numéro
et
se
réserve
tous
les
droits
de
reproduction
(même
partielle),
d’adaptation,
de
traduction,
pour
tous
les
pays
et
par
quelque
procédé
que
ce
soit
(loi
du
11
mars
1957,
art.
40
et
41
du
Code
Pénal
art.
425).
Les
articles
de
Dossier
du
CNHIM
sont
indexés
dans
bibliopch.
D
D
D
o
o
o
s
s
s
s
s
s
i
i
i
e
e
e
r
r
r
d
d
d
u
u
u
C
C
C
N
N
N
H
H
H
I
I
I
M
M
M
2011
Tome
XXXII,
5-6
E
v
a
l
u
a
t
i
o
n
F
i
c
h
e
s

-
2
-
Dossier
du
CNHIM,
2011,
XXXII,
5-6

-
3
-
Dossier
du
CNHIM,
2011,
XXXII, 5-6
Échos du CNHIM
Modernisation du système des produits de santé :
un projet de loi riche d’avancées mais encore trop
en retrait sur certains points
Suite à l’éclatement de l’affaire du Médiator début
2011, un certain nombre de dysfonctionnements
de l’organisation de la sécurité sanitaire des pro-
duits de santé ont été pointés dans le rapport de
l’inspection générale des affaires sociales (IGAS).
Une vaste concertation nationale sur la refonte de
ce système a alors été lancée – les Assises du mé-
dicament – par le Ministre du travail, de l’emploi et
de la santé. Ces assises et les recommandations
des parlementaires ont inspiré un projet de loi
actuellement en discussion à l’Assemblée natio-
nale.
Ce projet de loi sur la modernisation du système
des produits de santé comporte des mesures qui
si elles étaient appliquées représenteraient
des avancées certaines dans la gestion du
médicament en France.
Notamment :
* Les règles destinées à assurer la transparence
des liens d’intérêt sont profondément remaniées,
notamment la liste des personnes concernées est
étendue.
Le texte prévoit la création d’une « charte de
l’expertise sanitaire » qui s’appliquerait « aux ex-
pertises réalisées à la demande des services ou
instances en charge de la santé publique ».
* L’ANSM qui se substituera à l’AFSSAPS, aura
pour mission principale « l’évaluation des bénéfi-
ces et des risques liés à l’utilisation des produits à
finalité sanitaire destinée à l’homme et des pro-
duits à finalité cosmétique. Elle surveillera les ris-
ques liés à ces produits et effectuera des réévalua-
tions des bénéfices et des risques. »
Une méthode de « priorisation » de la réévaluation
du rapport bénéfices-risques des médicaments
avec AMM antérieure à 2005 a été publiée sur le
site de l’AFSSAPS en juillet dernier. Le démarrage
du criblage des produits était prévu pour septem-
bre 2011.
L’ANSM se trouvera dotée de plusieurs nouveaux
pouvoirs. Huit collèges composeront son conseil
d’administration. Enfin, une disposition prévoit que
le Directeur de l’ANSM rendra publics les ordres du
jour, et les comptes rendus des réunions des diffé-
rentes commissions de l’agence ; les modalités de
diffusion devront être fixées par un décret en
Conseil d’Etat.
* Le texte prévoit qu’une prescription hors AMM
sera possible dans deux cas :
- l’indication ou les conditions d’utilisation considé-
rées ont fait l’objet d’une « recommandation tem-
poraire d’utilisation » (RTU) de la part de l’ANSM ;
- le prescripteur juge indispensable, « au regard
des données acquises de la science », le recours à
un médicament pour améliorer ou stabiliser l’état
clinique du malade.
Le médecin devra alors prévenir le malade qu’il
effectue une prescription hors AMM et le mention-
ner sur l’ordonnance ; il devra motiver sa décision
dans le dossier médical du malade.
Sans cette RTU les médicaments prescrits hors
AMM ne pourront pas être pris en charge par
l’assurance maladie. Ces RTU seront assorties d’un
suivi des malades par le laboratoire voire d’un
engagement d’extension d’indication ou de modifi-
cation de l’AMM dans un délai déterminé.
Marie-Caroline Husson
Pharmacienne – praticien hospitalier
Rédactrice en chef
É c h o s
d u
C N H I M

-
4
-
Dossier
du
CNHIM,
2011,
XXXII,
5-6
Échos d
u CNHIM
Souhaitons que cet encadrement renforcé des uti-
lisations hors AMM par les RTU ne se fasse pas au
détriment des malades, dans des indications or-
phelines par exemple.
Peu de dispositions portent sur l’AMM elle-même
car elle est régie par la règlementation euro-
péenne, sauf en ce qui concerne la pharmacovigi-
lance qui peut être renforcée à la demande du
Directeur de l’ANSM auprès d’un laboratoire.
* La prescription d’une spécialité pharmaceutique
doit désigner les substances actives qu’elle
contient par leur DCI. Lorsque le médicament
comporte plus de trois substances actives, le nom
de marque s’impose. Mais au lieu d’être promue
sans délai, celle-ci est différée à l’utilisation de
logiciels professionnels qui risquent fort de ne pas
être certifiés avant plusieurs années.
* Enfin les règles régissant les ATU sont modifiées
en profondeur. Une ATU nominative ne pourra être
accordée à un médicament pour une indication
donnée que s’il existe une demande d’ATU de co-
horte, ou d’AMM, ou si des essais cliniques sont en
cours en France. A l’exception de deux situations :
- lorsqu’une issue fatale est prévisible pour le ma-
lade à court terme,
- lorsque la spécialité pharmaceutique a fait l’objet
d’un arrêt de commercialisation, si l’indication sol-
licitée est différente de l’AMM suspendue et qu’il
existe des données pertinentes sur son efficacité
et sa sécurité.
Si toutes ces mesures, dont la liste ci-dessus n’est
pas exhaustive, étaient mises en œuvre, cela
constituerait un important remaniement de la poli-
tique du médicament en France.
Ceci étant, la revue Prescrire souligne dans ce
projet de loi des manques importants, no-
tamment :
- le renforcement de la pharmacovigilance locale
n’est pas abordé, ce qui peut faire craindre la
marginalisation du rôle des centres régionaux pour
favoriser la centralisation des déclarations d’effets
indésirables ;
- la démonstration d’un progrès thérapeutique
pour qu’un médicament puisse obtenir une AMM
ou un remboursement n’est toujours pas exigée ;
- l’évaluation de la praticité pour prévenir la sur-
venue d’erreurs médicamenteuses, tout comme la
mise en place de financements pour la recherche
clinique indépendants de l’industrie pharmaceuti-
que, sont passés sous silence.

-
5
-
Dossier
du
CNHIM,
2011,
XXXII, 5-6
Antithrombotiques oraux
: Dabigatran, Rivaroxaban, Apixaban
Traitement anticoagulant : une nouvelle ère s’ouvre
Les antivitamines K sont utilisées depuis plus d’un
demi-siècle comme anticoagulants oraux de référence
dans toutes les pathologies où la thrombose joue un rôle
majeur : maladie thromboembolique veineuse, fibrilla-
tion auriculaire, valvulopathies et accidents vasculaires
cérébraux. Leurs inconvénients majeurs sont un faible
rapport bénéfice/risque et de nombreuses interactions
avec les médicaments et l’alimentation. Ceci explique
que même dans les études randomisées les plus récen-
tes, le temps passé par le malade où l’antivitamine K est
dans la zone thérapeutique, n’excède jamais plus de
65%.
Autrement dit, pendant près de 40% du temps le ma-
lade traité est soit insuffisamment anticoagulé et court
alors un risque de thrombose, soit trop anticoagulé et
peut alors craindre un accident hémorragique. Pour ces
raisons une surveillance thérapeutique de l’INR est né-
cessaire, mais celle-ci est consommatrice de ressources
économiques non négligeables et de temps médical et
paramédical important.
Les anticoagulants oraux sont prescrits dans notre pays
chez environ 1% de la population et sont responsables
d’environ 17 000 accidents iatrogènes.
Les héparines de bas poids moléculaire ont consti-
tué un progrès sensible durant les 3 dernières décen-
nies, mais la nécessité de l’injection sous-cutanée rend
leur utilisation au long cours difficile et inconfortable.
Les firmes pharmaceutiques ont développé depuis une
quinzaine d’années de nouveaux anticoagulants,
actifs par voie orale ; ce sont des molécules de petite
taille qui inhibent directement soit le facteur X activé soit
la thrombine.
Les premières – inhibitrices du facteur Xa - ont une dé-
nomination commune internationale qui se termine par
‘xaban’ (comme le rivaroxaban, l’apixaban, le darexa-
ban, l’otamixaban, l’edoxaban…), alors que les secondes
- inhibitrices de la thrombine - se terminent par ‘gatran’
(comme le dabigatran, flovagatran...). Comme les gran-
des classes thérapeutiques utilisées en cardiologie, cha-
cune de ces deux classes est composée de plusieurs
substances actives ayant le même mode d’action, avec
peut-être pour certaines, des développements à prévoir
dans des niches thérapeutiques spécifiques.
Il faudra pour ces raisons, que les médecins se familiari-
sent avec des schémas posologiques différents selon les
indications et les médicaments utilisés. De plus, il va
falloir développer une nouvelle conception de
l’éducation thérapeutique des malades. Il faudra
moins les éduquer sur l’équilibre du traitement que sur
la nécessité de ne pas arrêter un traitement qui devient
aussi simple à utiliser qu’une statine ou un antihyperten-
seur. L’enseignement de l’observance thérapeutique
devra faire partie intégrante de la prescription de ces
médicaments, et de leur dispensation, au risque de voir
survenir des récidives potentiellement mortelles, par
exemple dans les mois suivants leur prescription pour
une thrombose veineuse ou une embolie pulmonaire.
Les grandes études dont nous disposons déjà dans
la maladie thromboembolique veineuse (Recover, Eins-
tein DVT, Einstein Extension, Resonate, Remedy) et la
fibrillation auriculaire (Rely, Rocket AF, Aristotle) mon-
trent d’ores et déjà l’excellente tolérance du Dabigatran,
du Rivaroxaban et de l’Apixaban et une efficacité au
minimum non inférieure aux antivitamines K (soulignons
que ces médicaments sont déjà disponibles en prophy-
laxie après chirurgie orthopédique).
Il faut espérer que de bonnes études de phase IV per-
mettront de montrer un avantage plus important dans la
vraie vie en raison d’une moindre iatrogénie, mais cela
reste à démontrer.
Le surcoût immédiat de ces médicaments devrait éga-
lement être vite compensé par l’absence de nécessité de
surveillance biologique, et sans doute par la diminution
des durées d’hospitalisation. Cette diminution attendue
est liée à l’absence de nécessité d’un relais par héparine
de bas poids moléculaire à l’introduction des anticoagu-
lants, ou de réaliser une fenêtre thérapeutique pour un
geste invasif.
Pour l’ensemble de ces raisons nous sommes con-
vaincus que pour les futures générations de médecins,
les antivitamines K d’aujourd’hui vont être progressive-
ment mises aux oubliettes en pathologie humaine pour
ne garder peut-être que leur vocation première de dro-
gues utilisées pour la dératisation. Cet article de Dossier
du CNHIM, extrêmement complet et documenté, fait un
point critique de grande qualité sur le bénéfice/risque de
ces médicaments. Cette ère des nouveaux anticoagu-
lants est maintenant une réalité clinique.
Éditorial
Pr Joseph Emmerich
Service de Médecine Vasculaire-HTA et INSERM U765
Hôpital Européen Georges Pompidou
20
-
40 rue Leblanc
–
75908 PARIS Cedex 15
Antithrombotiques oraux :
Dabigatran, Rivaroxaban, Apixaban
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
 133
133
 134
134
 135
135
 136
136
 137
137
 138
138
 139
139
 140
140
 141
141
 142
142
 143
143
 144
144
 145
145
 146
146
 147
147
 148
148
 149
149
 150
150
 151
151
 152
152
1
/
152
100%