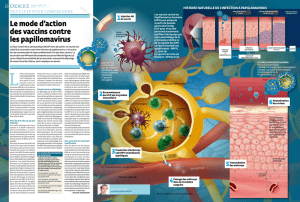
Vaccination contre le virus du papillome huamain

Vaccination contre le virus
du papillome humain
Siegfried Heinzl
Frauenklinik, Kantonsspital Bruderholz
Le cancer du col utérin est la deuxième forme de
cancer chez la femme dans le monde. Il y a cepen-
dant de grandes variations géographiques. Si le
carcinome du col utérin reste en seconde position
par sa fréquence dans les pays du tiers monde, il
est tombé à la septième place dans les nations in-
dustrialisées [1]. Cette évolution réjouissante tient
d’une part à l’introduction des examens systéma-
tiques de prévention tels que la colposcopie et la
cytologie, et d’autre part,àl’amélioration de l’hy-
giène, à une certaine prise de conscience du corps
et à l’amélioration générale des systèmes de santé.
En 1960, quelque 60000 femmes décédaient en-
core aux Etats-Unis d’un cancer du col, alors que
ce nombre n’était plus que de 3700 en 2003. En
Suisse aussi, l’incidence et la mortalité ont nette-
ment diminué. Le programme de dépistage, qui
a fait ses preuves, représente néanmoins une im-
portante charge émotionnelle pour les femmes et
suscite très fréquemment des angoisses inutiles.
De plus,des traitements injustifiés dans divers
stades de précancéroses sont souvent effectués,
et cela entraîne des coûts considérables pour le
système de santé.
Le développement d’un cancer du col est étroite-
ment associé à l’activité sexuelle et différents
agents pathogènes sont rendus responsables de
sa genèse. Dans ce contexte, le virus de l’herpès
alongtemps occupé le devant de la scène. Les
adénovirus et le cytomégalovirus ont également
été mis en cause, de même que le Trichomonas
vaginalis, le Treponema pallidum, la Neisseria
gonorrhoeae et les chlamydias. Même le sperme a
été suspecté d’être un agent responsable de l’ap-
parition du cancer du col [2]. Harald zur Hausen
a réussi pour la première fois dans les années
1970 à établir la relation entre le virus du pa-
pillome humain et le cancer du col de l’utérus [3],
dont le développement se fait en plusieurs étapes.
L’infection par des virus HPV oncogènes constitue
l’étape initiale. En cas de persistance du virus, on
observe une intégration du DNA HPV dans le gé-
nome de la cellule hôte. Celle-ci subit une trans-
formation entraînant l’inactivation de certains
gènes cellulaires suppresseurs (p53, pRb) et per-
mettant l’expression de différents oncogènes vi-
Vous trouverez les questions à choix multiple concernant cet article à la page 201 ou sur internet sous www.smf-cme.ch.
Quintessence
(Le cancer du col de l’utérus est largement répandu à travers le monde, mais
sa fréquence a considérablement diminué dans les pays industrialisés.
(La relation entre le cancer du col et l’infection par le virus du papillome humain
ou human papillomavirus (HPV) est considérée comme certaine.
(80% des femmes souffrent une fois ou l’autre au cours de leur vie d’une infec-
tion à HPV.
(Toutefois, peu de femmes seulement développent des lésions précancéreuses
ou un cancer du tractus génital inférieur.
(Il existe depuis peu des vaccins contre le HPV.
(L’efficacité de ces vaccins contre les différents types de virus est très élevée,
et leurs effets indésirables sont non seulement rares, mais en général aussi de
peu de gravité.
(Après que de nombreux pays aient publié des recommandations en la matière,
la Suisse a elle aussi maintenant émis les siennes.
(Le prix de la vaccination est actuellement très élevé.
(La décision de la prise en charge par l’assurance maladie obligatoire a été
prise en novembre 2007.
Summary
HPV vaccination
(Cervical cancer is very widespread worldwide, although its prevalence has
declined sharply in industrialised countries.
(The association between cervical cancer and HPV infection is regarded as
definite.
(80% of women have contracted an HPV infection once in their lives.
(However, few women develop precancerous lesions and cancer of the lower
genital tract.
(Vaccines against HPV infection have recently become available.
(They are highly effective against the relevant HPV types and their side
effects are minor and usually mild.
(In the wake of many countries which have published recommendations,
Switzerland has now embarked on the same course.
(The vaccine is currently very costly.
(The decision on coverage of the cost by compulsory sickness insurance has
been made in november 2007.
cabinet Forum Med Suisse 2008;8(11):210–213 210
210-213 Heinzl 245_f.qxp 29.2.2008 13:26 Uhr Seite 210

cabinet Forum Med Suisse 2008;8(11):210–213 211
types 16 et 18, devrait être commercialisé dans
les mois à venir. Entre-temps, de très nombreuses
études ont été effectuées et leurs résultats publiés
[6, 7]. Deux groupes ont été pris en compte pour
l’appréciation de l’efficacité préventive: un pre-
mier groupe pour la «per protocol efficiency»
(groupe PPE), qui incluait des cas vaccinés confor-
mément au plan de vaccination et qui étaient
HPV-négatifs à partir du septième mois après la
troisième dose de vaccin; un second groupe «mo-
dified intention to treat» (MITT) a été formé par
des sujets ayant reçu au minimum une dose de
vaccin et dont le status HPV était inconnu ou dont
le test PAP était négatif ou suspect avant le début
de l’essai. L’évaluation des résultats s’est basée
sur le développement de précancéroses (néopla-
sies intra-épithéliales cervicales = CIN ou lésions
intra-épithéliales squameuses = SIL) comme
marqueur indirect. Toutes les études indiquent de
manière consistante une grande efficacité [17–
19]. L’étude FUTURE II, publiée récemment, a
confirmé ces excellents résultats [20] pour les lé-
sions cervicales, comme ceux de Garland pour les
lésions anogénitales. On a également pu montrer
que le titre des anticorps ne varie guère au cours
des cinq premières années. Les analyses ont
montré que les jeunes filles âgées de 9à15 ans
présentent une réponse immunitaire nettement
meilleure que les jeunes femmes de 16 à 26 ans
[23]. Les titres immuns étaient deux fois plus éle-
vés chez les jeunes filles.
La question de la durée de protection du vaccin
reste ouverte. Les études réalisées à ce jour indi-
quent une protection vaccinale de plus de cinq ans
avec Gardasil®et de près de cinq ans avec Cer-
varix®[19, 22]. Fondamentalement, la durée de
protection offerte par les vaccins en général n’est
que rarement connue – si ce n’est jamais – au mo-
ment de leur enregistrement, et il manque au-
jourd’hui encore beaucoup d’informations à ce
sujet pour de très nombreux vaccins. La durée de
la protection conférée par un vaccin fait habi-
tuellement l’objet d’une estimation empirique. Il
existe par ailleurs divers modèles qui décrivent
la diminution des taux d’anticorps au cours du
temps en partant de l’idée qu’une protection ef-
ficace devrait durer dans le pire des cas douze à
trente-deux ans et dans le meilleur des cas toute
la vie [24]. La vaccination simultanée contre l’hé-
patite B et le HPV (Gardasil®) a également été tes-
tée [23]. Elle est possible et ne fait l’objet d’au-
cune limitation. Les analyses ont aussi montré
que le vaccin n’est pas seulement efficace contre
les types 16 et 18, mais qu’il y a aussi une réac-
tion croisée avec les types 31 et 45 [19], ce qui
augmente son efficacité d’environ 10%. Certains
résultats suggèrent de plus l’existence d’une sé-
roconversion chez les femmes plus âgées [25],
mais ils doivent encore être confirmés.
Les effets indésirables sont relativement rares et,
le cas échéant, légers. En comparant les effets in-
désirables du Gardasil®avec ceux d’un placebo
raux (E6, E7). Cette constellation ouvre la porte à
une division cellulaire incontrôlée [9]. Ce proces-
sus ne peut cependant se dérouler qu’en présence
de cofacteurs influençant avant tout les défenses
immunitaires de l’organisme et favorisant l’im-
munosuppression. La nicotine, les infections gé-
nitales, la prise prolongée d’inhibiteurs de l’ovu-
lation et diverses carences en vitamines ont été
évoquées parmi de nombreux autres facteurs
causaux.
Les études épidémiologiques ont montré que
l’infection à HPV est probablement la maladie
sexuellement transmissible la plus fréquente [4].
L’infection à HPV est endémique dans la popula-
tion jeune, sexuellement active. Sa prévalence dé-
pend avant tout de l’âge, de l’activité sexuelle, du
contexte immunologique, ainsi que de divers au-
tres facteurs. Quatre femmes sur cinq seront ainsi
infectées au cours de leur vie, essentiellement du-
rantl’adolescenceetlespremièresannéesdel’âge
adulte. L’infectionestengénéraltransitoireet n’est
plus détectable après une période d’environ huit à
quatorze mois. La transmission est habituellement
sexuelle, mais d’autres voies sont également pos-
sibles. La prévalence diminue avec l’âge.
L’infection évolue en général de manière asympto-
matique. Plus de 90% des cas guérissent spontané-
ment en quelques mois. Environ 1% des infections
donnent lieu au développement de condylomes
acuminés. Quelque 4% entraînent la formation de
lésions néoplasiques intra-épithéliales ou squa-
meuses dans le tractus génital inférieur. Seul
0,01% aboutit à un cancer invasif.
On peut admettre que pratiquement toutes les
précancéroses et surtout les carcinomes du col,
de la vulve et du vagin, sont associées au HPV. Un
DNA HPV peut être identifié dans 50 à 80% des
cas de SIL low-grade, dans 80 à 90% des SIL high-
grade et dans 99% des cancers. C’est également
la raison pour laquelle la recherche du DNA HPV
n’est pas recommandée dans le cadre des exa-
mens de dépistage de routine.
Après la réussite de l’isolement et de l’établisse-
ment de la séquence du HPV 16 par le groupe de
Harald zur Hausen, le développement du vaccin
n’était plus qu’une question de temps. Nous distin-
guons fondamentalement deux types de vaccina-
tions: la vaccination prophylactique, qui prévient
l’infection proprement dite,et la vaccination thé-
rapeutique au sens d’une immunothérapie, dont le
but est d’éliminer les cellules infectées. Le vaccin
dont il sera question ici relève de la vaccination à
visée purement prophylactique. Laura Koutsky a
publié pour la première fois en 2002 des données
démontrant que la vaccination permet de préve-
nir les infections à HPV et les précancéroses qui
en résultent [5].
Deux vaccins ont été développés: le vaccin Gar-
dasil®de la société Sanofi Pasteur MSD, qui est
dirigé contre les types 6, 11, 16 et 18 du HPV, est
d’ores et déjà disponible. Le vaccin Cervarix®
de la firme GlaxoSmithKline, efficace contre les
210-213 Heinzl 245_f.qxp 29.2.2008 13:26 Uhr Seite 211

cabinet Forum Med Suisse 2008;8(11):210–213 212
pays ont entre-temps suivi ces recommandations,
tout en appliquant diverses stratégies de vaccina-
tion. La commission des vaccinations allemande
a ainsi recommandé l’administration du vaccin
entre l’âge de 12 et de 17 ans [9]. Même si d’au-
tres pays émettent des recommandations quel-
que peu différentes, elles correspondent pour
l’essentiel aux conditions d’enregistrement de
Swissmedic du 15 novembre 2006. La vaccina-
tion par le Gardasil®est conseillée dans notre
pays entre 9 et 15 ans et, pour les vaccinations
dites de rattrapage, entre 16 et 26 ans. La Com-
mission fédérale pour les vaccinations s’était
attaquée à cette problématique très tôt déjà, en
mettantsurpied un groupe de travail dans cesens.
Les recommandations officielles pour la vaccina-
tion contre le virus du papillome humain ont été
publiées le 18 juin 2007 (OFSP 2007) (tab. 1 p)
[10].
Pour l’instant, c’est le coût relativement élevé du
vaccin qui pose problème. Une seule dose de Gar-
dasil®coûte en effet 236,85francs. En y ajoutant
les coûts de conseil et d’administration du vaccin,
la vaccination revient globalement à entre 800et
900 francs. Si ces dépenses ne devaient pas être
prises en charge dans le cadre des prestations
obligatoires des caisses-maladie, nous irions vers
une situation de «médecine à deux vitesses» avec
pour conséquence le fait que les personnes les
plus menacées ne pourraient pas «s’offrir» la vac-
cination. Il faut évidemment éviter à tout prix de
tomber dans une telle «médecine à deux classes».
Les coûts occasionnés au départ par les vaccina-
tions de rattrapage engendreraient certes des dé-
penses importantes. Mais ces coûts diminueront
considérablement une fois que la vaccination ne
concernera plus, chaque année, qu’une seule
classe d’âge. Le fait qu’il n’existe pas en Suisse de
données économiques précises sur le rapport
coût/bénéfice constitue un problème. Les chiffres
n’ont été évalués que très grossièrement. Les
coûts initiaux seront importants, mais le bénéfice
à long terme le sera cependant probablement da-
vantage. On estime en effet aux Etats-Unis que
l’on pourrait réaliser à terme des économies de
2,25 à 4,6 milliards de dollars.
Un autre problème réside dans le fait que la vac-
cination préventive a une efficacité maximale
lorsqu’elle est faite avant l’âge de la maturité psy-
chosexuelle. Il faut donc s’attendre à une certaine
retenue ou même à une résistance de la part des
parents et des médecins. Les milieux conserva-
teurs craignent également des conséquences au
niveau du comportement sexuel, si bien qu’il
reste un gros travail d’information à faire auprès
des différents groupes sociaux concernés.
Il convient aussi de relever que les examens de
dépistage resteront indispensables pendant les
trente prochaines années au moins, et cela mal-
gré la vaccination [38, 39], quel que soit l’avis des
assureurs, qui se fondent souvent trop sur des cri-
tères non médicaux. Ce n’est qu’à long terme que
contenant les adjuvants du vaccin, les différences
constatées sont insignifiantes. Elles sont en re-
vanche plus marquées lorsqu’on se réfère à un
placebo ne contenant que du NaCl. Aucun effet
indésirable grave n’a cependant été signalé à ce
jour.
Contre quelles maladies le vaccin HPV est-il effi-
cace? Au niveau gynécologique, on devrait s’at-
tendre à une diminution de 75% des cancers du
col, de 70% des précancéroses de grade sévère et
de 50% des précancéroses de faible grade. Dans
le même ordre d’idée, les cancers de la vulve et
du vagin devraient reculer d’environ 95% et les
précancéroses de 80%. L’incidence des condy-
lomes de la sphère génitale pourrait également
être abaissée de 90%.
D’autres types de lésions risquent aussi d’être in-
fluencés positivement par le vaccin HPV. Nous de-
vrions par exemple assister à une diminution des
condylomes acuminés et du cancer du pénis chez
l’homme et du cancer anal chez l’homme et la
femme. Les papillomes laryngés de l’enfant et les
cancers de la sphère ORL pourraient aussi dimi-
nuer, au même titre que le cancer de l’œsophage.
Le taux de succès de la vaccination dépend natu-
rellement du taux de participation de la popu-
lation et de la stratégie de vaccination. Comme l’ont
montré d’autres études en médecine préventive,
il est absolument essentiel d’englober un cercle de
participants aussi large que possible. Les calculs
indiquent qu’une vaccination englobant 50% de
lapopulationpotentiellementconcernéepeutréduire
l’incidence du cancer du col au mieux de 5 pour
100 000 à 1 pour 100 000. L’inclusion dans le pro-
gramme de vaccination de 90% de la population
ferait en revanche chuter l’incidence du cancer
du col à un niveau proche de 0 pour 100000. Un
tel succès ne se verrait cependant qu’après un
laps de temps de 50 à 60 ans [37]. C’est pourquoi
il serait judicieux de vacciner toutes les jeunes
filles durant leur scolarité – éventuellement à l’oc-
casion de la vaccination contre l’hépatite.
Après que la FDA ait jugé le vaccin Gardasil®
efficace, celui-ci a été introduit au Mexique, puis
peu après aux Etats-Unis [8]. De très nombreux
Ta bleau 1. Recommandations de la Commission
fédérale pour les vaccinations (CFV) et de l’Office
fédéral de la santé publique (OFSP).
Vaccination de base recommandée pour
les adolescentes:
a) Vaccination des jeunes filles âgées de 11 à14 ans,
avant leur 15eanniversaire
b) Vaccinations de rattrapage entre l’âge de 15 et de
19 ans
Vaccination complémentaire recommandée après
l’adolescence:
a) Recommandation en fonction de la situation individuelle
b) Limite d’âge conformément aux critères d’enregistre-
ment actuels du vaccin, actuellement 26 ans
La vaccination n’est pas recommandée chez les garçons.
210-213 Heinzl 245_f.qxp 29.2.2008 13:26 Uhr Seite 212

cabinet Forum Med Suisse 2008;8(11):210–213 213
l’on pourra envisager une modification du pro-
cessus de dépistage. On se montrera par ailleurs
plutôt restrictif en ce qui concerne les vaccina-
tions hors de la période de 9 à 26 ans, corres-
pondant aux conditions d’enregistrement. Une
prescription «off label»ne se justifierait qu’en cas
de preuve suffisante de son utilité. Même si cer-
tains indices suggèrent une éventuelle efficacité
de la vaccination après l’âge de 26 ans, les don-
nées dont nous disposons à ce sujet sont encore
insuffisantes.
Pour résumer, on peut retenir ce qui suit: la vac-
cination anti-HPV est extraordinairement efficace
contre les types de HPV concernés. Des réactions
croisées qui élargissent encore le spectre d’activité
du vaccin sont connues. La protection vaccinale
dure au moins cinq ans, probablement beaucoup
plus. Les effets indésirables sont extrêmement
rares. La vaccination est la plus efficace lors-
qu’elle est réalisée durant l’enfance ou l’adoles-
cence. Les vaccinations combinées, surtout avec
l’hépatite, sont possibles. Les sujets ayant déjà
été en contact avec le HPV profitent peut-être de
la vaccination, même si c’est à un degré moindre.
Les personnes n’ayant pas suivi le schéma de vac-
cination de façon stricte peuvent aussi bénéficier
du vaccin, même si c’est dans une mesure légè-
rement moindre. Le succès global de la vaccina-
tion préventive dépend de la stratégie adoptée.
Les coûts de la vaccination sont actuellement en-
core excessifs et devront être fortement diminués.
La décision de l’Office fédéral de la santé publique
ou du DFI concernant la prise en charge des coûts
a été résumée, le 21 novembre 2007, dans une
nouvelle ordonnance (voir encadré).
Références recommandées
–zur Hausen H. Human papillomaviruses and their possibile
role in squamous cell carcinomas. Curr Top Microbiol Immu-
nol. 1977;78:1–30
–Bachmann A, Zottler K, Iftner T, Fehm T, Nauth A. Hornung
R. et al. HPV-Infektion und Zervixkarzinom – eine Übersicht:
Aktuelles zur Diagnostik und prophylaxe. Geburtsh Frauen-
heilkunde. 2007,67:438–42.
–Centers for Disease Control and Prevention. Quadrivalent
human papillomavirus vaccine. Recommendations of the Ad-
visory Committee on Immunization Practices (ACIP). MMWR
Early Release. 2007;(March 12):1–24.
–Koutsky L. Epidemiology of genital human papillomavirus in-
fection. Am J Med.1997;102:3–8.
–Koutsky LA, Ault KA, Wheeler CM et al. A controlled trial of
a human papillomavirus type 16 vaccine. N Engl J Med. 2002;
347:1645.
–Villa LL, Costa RLR, Petta CA et al. Prophylactic quadrivalent
human papillomavirus (types 6, 11, 16, and 18) L1 virus-like
particle vaccine in young women: a randomised double-blind
placebo-controlled multicentre phase II efficacy trial. Lancet
Oncol. 2005;6:271–8.
–Harper DM, Franco EL, Wheeler C al. Sustained efficacy up
to 4.5 years of a bivalent L1 virus-like particle vaccine against
human papillomavirus types 16 and 18: follow-up from a ran-
domized control trial. Lancet. 2006;367:1247–55.
–The FUTURE II study group: Eff ect of prophylactic human
papillomavirus L1 virus-like-particle vaccine on risk of cervi-
cal intraepithelial neoplasia grade 2, grade 3, and adenocar-
cinoma in situ: a combined analysis of four randomised clin-
ical trials. Lancet. 2007;369:1861–68.
–Elbasha EH, Dasbach EJ, Insinga RP. Model for assessing hu-
man papillomavirus vaccination strategies. Emerg Inf Dis.
2007;13:28–41.
–ACS: American Cancer Society Guideline for human papillo-
mavirus (HPV) vaccine use to prevent cervical cancer and its
precursors. Saslow D, Castle PE, Cox JT et al. CA Cancer J
Clin. 2007;57:7–28.
Vous trouverez la liste complète des références sous www.
medicalforum.ch
Correspondance:
Prof. Siegfried Heinzl
Chefarzt Frauenklinik
Kantonsspital Bruderholz
CH-4101 Bruderholz
siegfr[email protected]
Ordonnance du DFI sur les prestations dans
l’assurance obligatoire des soins en cas
de maladie (modification du 21 novembre 2007)
Art. 12aVaccinations prophylactiques
L’assurance prend en charge les coûts des vacci-
nations prophylactiques suivantes aux conditions
ci-après:
Vaccination contre le papillomavirus humain
(HPV)
1. Selon les recommandations de l’OFSP et de la
CFV de juin 2007 (Bulletin OFSP no 25, 2007):
a. vaccination générale des filles en âge scolaire;
b. vaccination des filles et des jeunes femmes de
15 à 19 ans. Cette disposition est applicable
jusqu’au 31 décembre 2012.
2. Vaccination dans le cadre de programmes can-
tonaux de vaccination qui doivent satisfaire aux
exigences minimales suivantes:
a. l’information des groupes cibles et de leurs
parents/représentants légaux sur la disponibi-
lité des vaccins et les recommandations de
l’OFSP et de la CFV est assurée;
b. l’achat des vaccins est centralisé;
c. la vaccination complète (schéma de vaccination
selon les recommandations de l’OFSP et de la
CFV) est visée;
d. les prestations et les obligations des responsa-
bles du programme, des médecins chargés de
la vaccination et des assureurs-maladie sont dé-
finies;
e. la collecte des données, le décompte, les flux
informatif et financier sont réglés.
3. Aucune franchise n’est prélevée sur cette pres-
tation.
210-213 Heinzl 245_f.qxp 29.2.2008 13:26 Uhr Seite 213

HPV-Vakzination
Siegfried Heinzl
Frauenklinik, Kantonsspital Bruderholz
Literatur
1 World Health Organisation (WHO): Incidence, mortality and survival database; 2002,www.who.int/cancer.
2 Ferlay et al. Editors. Globocan 2002: Cancer incidence, mortality and prevalence worldwide, version 2.0 IARC Cancer-Base No.5.
Lyon. IARC Press 2004.
3 Wingo P. et al.: Cancer statistics, Cancer J. for Clinicans 1995,45, 8 –30.
4 American Cancer Society (ACS), Cancer Facts & Figures, Atlanta (2006).
5 Schw. Krebsregister zit bei: Oncosuisse. Nationales Krebsprogramm für die Schweiz 2005-2010; www.oncosuisse.ch.
6 Rigoni-Stern D.:Fatti statistici relativi alle malattie cancerose. Giornale per servireal progressidella patologia e della terapeutica 1842,
2: 507 – 517.
7 Fenoglio C. and Lefokowitch J: HSV II and Neoplasia of the Lower Genital Tract In: Grundmann E. (ed.):Cancer of the uterine cervix
Gustav Fischer Verlag (1985).
8 zur Hausen H.: Human papillomaviruses and their possibile role in squamous cell carcinomas. Curr Top Microbiol Immunol. 1977; 78:
1 – 30.
9 Bachmann A., Zottler K., Iftner T., Fehm T., Nauth A.,Hornung R. et al.: HPV-Infektion und Zervixkarzinom – eine Übersicht:
Aktuelles zur Diagnostik und prophylaxe. Geburtsh Frauenheilkunde 2007, 67: 438 – 442.
10 Bonnez W, Reichmann RC. Papillomaviruses. In: Mandell GL, Bennet JE, Dolin R (eds). Principles and Practice of Infectious
Diseases. 5th ed. Philadelphia: Churchill Livingston, 2000: 1630.
11 Muñoz N, Castellsagué X, Berrington de González, Gissmann L. HPV in the etiology of human cancer. Vaccine 2006; 24 (Suppl 3):1-
10.
12 Centers for Disease Control and Prevention. Quadrivalent human papillomavirus vaccine. Recommendations of the Advisory
Committee on Immunization Practices (ACIP). MMWR Early Release 2007 (March 12):1-24.
13 Koutsky L. Epidemiology of genital human papillomavirus infection. Am J Med.1997;102:3-8.
14 Schlecht N. et al.: Persistent human papillomavirus infection as a predictor of cervical intraepithelial neoplasia JAMA 2002; 286: 3106
–3114.
15 Durst M, Gissmann L, Ikenberg H, zur Hausen H.: A Papillomavirus DNA from a cervical cancer and its prevalence in cancer biopsy
samples from different geographics regions. Proc Nat Acad Sci 1983, 80: 3812–3815.
16 Koutsky LA, Ault KA, Wheeler CM et al. A controlled trial of a human papillomavirus type 16 vaccine. N Engl J Med 2002; 347:
1645.
17 Villa LL, Costa RLR, Petta CA et al. Prophylactic quadrivalent human papillomavirus (types 6, 11, 16, and 18) L1 virus-like particle
vaccine in young women: a randomised double-blind placebo-controlled multicentre phase II efficacy trial. Lancet Oncol 2005;6:271-
8.
18 Harper DM, Franco EL, Wheeler C, Ferris DG, Jenkins D, Schuind A et al. (2004). Efficacy of a bivalent L1 virus-like particle vaccine
in prevention of infection with human papillomavirus typs 16 and 18 in young women: a randomized controlled trial. Lancet 2004;
364:1757-65.
19 Harper DM, Franco EL, Wheeler C al. (2006). Sustained efficacy up to 4.5 years of a bivalent L1 virus-like particle vaccine against
human papillomavirus types 16 and 18: follow-up from a randomized control trial. Lancet 2006;367:1247-55.
20 The FUTURE II study group: Eff ect of prophylactic human papillomavirus L1 virus-like-particle vaccine on risk of cervical
intraepithelial neoplasia grade 2, grade 3, and adenocarcinoma in situ: a combined analysis of four randomised clinical trials. Lancet
2007; 369: 1861–68
21 Garland Suzanne M.D., Mauricio Hernandez-Avila, M.D.,
Cosette M. Wheeler, Ph.D., Gonzalo Perez, M.D., Diane M. Harper, M.D.: Quadrivalent Vaccine against Human Papillomavirus to
Prevent Anogenital Diseases. N Engl J Med. 2007;356:1928-43.
22 Villa LL, Costa RLR, Petta CA et al. High sustained efficacy of a prophylactic quadrivalent human papillomavirus types 6/11/16/18/ LI
virus-like particle vaccine through 5 years of follow-up. Brit J Cancer 2006; 95:14959-66.
23 EMEA. Gardasil, European Public Assesment Report (http://www.emea.europa.eu/humandocs/Humans/EPAR/gardasil/gardasil.htm)
24 Ferris D. G.: Prophylactic Efficacy of a Quadrivalent HPV (types 6, 11, 16, and 18) L1 Virus-Like Particle (VLP) Vaccine in Women
With Virologic Evidence of HPV Infection. Eurogin, Paris, April 2006.
25 Schwarz T.F: Data presented at the 42 nd annual meeting of the ASCO, Atlanta (GA), 2006.
26 Food and Drug Administration. Product approval information—licensing action [package insert]. Gardasil (quadrivalent human
papillomavirus types 6,11,16,18). Merck & Co., Whitehouse Station, NJ. Available at
http://www.fda.gov/cber/label/HPVmer060806LB.pdf.
27 Daling JR, Madeleine MM, Schwartz SM et al. A population-based study of squamous cell vaginal cancer: HPV and cofactors.
Gynecol Oncol 2002; 84:263–270.
28 Madeleine MM, Daling JR, Carter JJ et al. Cofactors with Human Papillomavirus in a population-based study of vulvar cancer. J Natl
Cancer Inst 1997; 89:1516–1523.
29 Clifford GM, Smith JS, Aguado T et al. Comparison of HPV type distribution in high-grade cervical lesions and cervical cancer: A
meta-analysis. Br J Cancer 2003; 89, 101–105.
30 Sotlar K, Diemer D, Dethleffs A et al. Detection and typing of Human Papillomavirus by E6 nested multiplex PCR. J Clin Microbiol
2004; 42:3176–3184.
31 Clifford GM, Rana RK, Franceschi S et al. Human Papillomavirus genotype distribution in low-grade cervical lesions: Comparison by
geographic region and with cervical cancer. Cancer Epidemiol Biomarkers Prev 2005; 14:1157–1164.
32 van Beurden M, ten Kate FJW, Smits HL et al. Multifocal intraepithelial neoplasia grade III and multicentric lower genital tract
neoplasia is associated with transcriptionally active Human Papillomavirus. Cancer 1995; 75:2879–2884.
 6
6
1
/
6
100%