PREMIER PROBLÈME : GÉOMÉTRIE CAP: Il points

Correction BEP du 30 mai 1997 MATHEMATIQUES SCIENCES (2h00)
Electrotechnique
MATHEMATIQUES
PREMIER PROBLÈME : GÉOMÉTRIE 19 points
1. a1 = 10
10 = 100 cm2.
2. a) Points A2, B2, C2 et D2 et le carré A2B2C2D2
b) c2 = AA DA = 5 5 = 50 = 7,07 cm.
3. a2 = 50 cm2.
4. Points A3, B3, C3 et D3 et le carré A3B3C3D3 (ci-dessus).
5. c3 =
Error!
c2 =
Error!
7,07 = 5 cm.
6. a3 = 25 cm2.
7.
a) a1 = 100 cm2 ; a2 = 50 cm2 ; a3 = 25 cm2 ; a4 = 12,5 cm2.
b) On divise par 2 à chaque fois.
8. Suite géométrique car on passe d’un terme à l’autre en divisant par 2 soit une multiplication par 0,5.
Donc la raison est q = 0,5.
9. an = a1
qn – 1.
10. a10 = a1
qn – 1 = 100
0,5 10 – 1 = 0,2 cm2.
A1
C1
B1
D1
A2
D2
C2
B2
A3
C3
D3
B3

DEUXIEME PROBLÈME : FONCTIONS NUMERIQUES 21 points
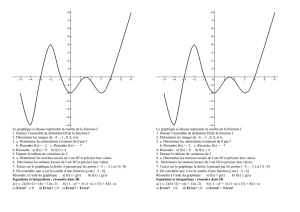
1. Tableau
x
0
4
6
8
y
4
0
– 5
– 12
x’
I
x
J
y
C1
O
y’
(D)
C2

2. a) cette fonction est :
une fonction affine
une fonction linéaire
Linéaire car de la forme g(x) = ax avec a un nombre réel non nul.
b) la représentation graphique de la fonction g est une droite (D) :
passant par l’origine du repère
ne passant pas par l’origine du repère
c) Droite (D).
3. Courbe C2.
4. - l’intervalle sur lequel h est croissante sur [– 8 ; 0]
- l’intervalle sur lequel h est décroissante sur [0 ; 8]
- la valeur maximale de h(x) est 4
- la valeur de x pour laquelle h(x) est maximal est 0
5.
y = Error! x2 + 4
y = – Error! x2 + 4
y = – Error! x2 – 4
y = Error! x2 – 4
h(0) = 4, donc on a le choix entre les deux premières propositions. Compte tenu fait que la courbe
est une valeur maximale, alors le coefficient devant x2 doit être négatif.
6. h est une fonction paire car pour x et – x appartenant à l’intervalle [– 8 ; 8], la représentation
graphique admet l’axe des ordonnées comme axe de symétrie.
7. Les abscisses des points d’intersection de C et de (D) sont : x = – 8 et x = 2.
8. L’équation de (D) est g(x) = 1,5 x et l’équation de C est h(x) = –
Error!
x2 + 4. On recherche les
points d'intersection dont les ordonnées sont égales donc g(x) = h(x). Alors les abscisses doivent
vérifier l’égalité 1,5 x = – 0,25 x2 + 4.

TROISIEME PROBLÈME : CHIMIE 15 points
1. Nom des réactifs : acide chlorhydrique HCl et craie CaCO3.
2. Nom des produits : eau H2O et chlorure de calcium CaCl2.
3.
Affirmation
Vraie
Fausse
La formule du chlorure de calcium indique qu’il y a 2 atomes de
calcium pour 1 atome de chlore.
La formule du chlorure de calcium indique qu’il y a 2 atomes de
chlore pour 1 atome de calcium.
L’ion Cl– provient d'un atome de chlore ayant perdu un électron.
Lors de l’expérience décrite, il se produit un dégagement de
dihydrogène.
4. a)
- la masse du morceau de craie utilisée : 5 g.
- la masse totale indiquée par la balance au début de l’expérience : 240 g.
b) Indication de la balance à la fin de l’expérience : 240 g. Conservation de la masse du
système au cours d’une réaction chimique.
5. L’équation bilan de la réaction chimique de l’expérience s’écrit :
2 HCl + CaCO3 ; H20 + CaCl2 + CO2
1 mole de CaCO3 donne, d’après les coefficients stœchiométriques de la réaction, 1 mole de CO2.
M (CaCO3) = 40 + 12 + 3
16 = 100 g/mol
M =
Error!
d’où n =
Error!
=
Error!
= 0,05 mol
Il se forme 0,05 mole de CO2.
Vm =
Error!
d’où V = n
Vm = 0,05
22,4 = 1,12 L de dioxyde de carbone produit à la fin de la réaction.
6. M (CO2) = 44 g/mol
M =
Error!
d’où m = n
M = 0,05
44 = 2,2 g.
La masse indiquée alors par la balance est 237,8 g (240 – 2,2).

QUATRIEME PROBLÈME : ELECTRICITE 11 points
1. La grandeur physique que l’appareil 1 permet de mesurer est l’intensité du courant électrique.
2. 0,65 A (car il faut lire sur la graduation du bas, et lorsque l’aiguille indique 100 l’intensité du
courant serait de 1 A).
3.
a) U1max = 1,8
5 = 9 V U2max = 3,6
5 = 18 V
b) La période T1 = 4
2 = 8 ms et la période T2 = 4
2 = 8 ms.
4. U1max < U2max : c’est un transformateur éleveur de tension.
5. U1eff =
Error!
=
Error!
= 6,4 V
6. Le voltmètre V1 placé entre M et N, réglé sur la position AC, indique :
U1eff ……………………………………………………..
U1max ……………………………………………………
La tension entre les deux crêtes de la sinusoïde ………….
CINQUIEME PROBLÈME : ENERGIE MECANIQUE 14 points
1.
t (s)
0
0,5
1
1,5
2
d (m)
0
1,2
5
11
19,6
2. La profondeur p à laquelle se trouve la surface de l’eau est 19,6 m.
3. Em = Ep + Ec = Ep = m g h = 0,3
9,8
19,6 = 57,6 J (énergie potentielle est maximum à t = 0 s).
4. a) Ep = m g h = 0,3
9,8
10 = 29,4 J.
b) Em = Ep + Ec donc Ec = Em – Ep = 57,6 – 29,4 = 28,2 J.
c) Ec =
Error!
m v2 = 28,2 donc v2 =
Error!
=
Error!
= 188 donc v =
Error!
= 13,7 m/s.
5. Em = Ec = 57,6 J =
Error!
m v2 donc v2 =
Error!
=
Error!
= 384 donc v =
Error!
= 19,6 m/s.
v = 19,6 m/s = 70,6 km/h.
1
/
5
100%