PESTE PORCINE CLASSIQUE : LE CAS ALLEMAND

5
Cécile MAJESTE-MENJOULAS
PESTE PORCINE CLASSIQUE :
LE CAS ALLEMAND

6
TABLES DES MATIERES
TABLE DES ILLUSTRATIONS……………………………………………………………...9
INTRODUCTION………………………………………………………………………………12
PARTIE I : LES CONNAISSANCES INDISPENSABLES EN MATIERE DE PPC……13
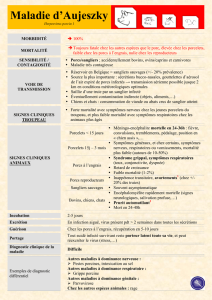
I. L’agent pathogène…………………………………………………………………………..14
II. Eléments essentiels sur la maladie……………………………………………………….18
A. Pathogénie…………………………………………………………………………………………… 18
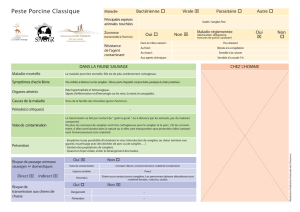
B. Tableaux cliniques……………………………………………………………………………………18
C. Tableau nécropsique…………………………………………………………………………………20
D. Diagnostic……………………………………………………………………………………….…….20
III. Quelques éléments d’ épidémiologie…………………………………………………….24
PARTIE II : LA PRODUCTION PORCINE ALLEMANDE………………………………...26
I. Le marché du porc en Allemagne………………………………………………………….27
A. L’Allemagne :
premier producteur européen……………………………………………………...27
B. Les Allemands : d’importants consommateurs de viande porcine……………………………...27
C. Le commerce extérieur allemand…………………………………………………………………..28
1. Exportations à destination des pays tiers………………………………………………..28
2. Importations en provenance des pays tiers……………………………………………..
.
28
3. Echanges intra communautaires………………………………………………………….29
II. Organisation de la filière porcine allemande…………………………………………….29
A. Le cheptel porcin allemand………………………………………………………………………….29
1. L’effectif national……………………………………………………………………………29
2. Répartition géographique du cheptel allemand…………………………………………29
3. Evolution et répartition des différentes catégories d’animaux…………………………31
B. Les exploitations porcines allemandes…………………………………………………………….34
C. Une filière libérale en mutation……………………………………………………………….……..35
PARTIE III : LA PPC CHEZ LES PORCS DOMESTIQUES EN ALLEMAGNE……….37
I. Situation allemande en matière de PPC des porcs domestiques
au cours des dix dernières années………………………………………………………….38
A. La grande crise (1993-1995)………………………………………………………………………..38
B. Evolution de 1996 à 1999. Crise européenne de 1997-1998…………………………………...40
C. La période récente (2000 à 2003)………………………………………………………………….41
D. Bilan de la période 1993-2003 en matière de PPC des porcs domestiques…………………..43
1. Une situation difficile, une évolution favorable……………………………………………...43
2. Résultats des enquêtes épidémiologiques…………………………………………….……44

7
II. Les souches virales allemandes………………………………………………………….48
A. Intérêts et objectifs de l’identification des types viraux…………………………………………..48
B. Résumé de la technique employée ; identification et intérêt relatif des gènes candidats…….49
C. Résultats : Types viraux identifiés en Allemagne…………………………………………………51
1. Analyse des types viraux grâce à l’étude de la région 5’NTR…………………………51
a.
Types viraux rencontrés en Allemagne de 1990 à 2000 et disparus aujourd’hui.53
b.
Types viraux toujours présents en 2001-2002……………………………………..54
2. Analyse des types viraux par séquençage de la région E2………………………...….56
D. Conclusion de l’étude génotypique…………………………………………………………………58
III. Analyse des facteurs de risque dans l’apparition de la PPC chez les porcs
domestiques en Allemagne…………………………………………………………………...58
A.
La population de sangliers infectés en Allemagne : facteur de risque majeur d’introduction
de la PPC en Allemagne………………………………………………………………………...…..59
1. Habitat, alimentation, structure sociale et déplacements des sangliers……………...59
2. La population de sangliers en Allemagne : un effectif en croissance continue………60
a. L’effectif et la répartition géographique des sangliers allemands…………
61
b. Causes et conséquences d’une telle croissance
……………………………...62
3. Les sangliers et la PPC en Allemagne…………………………………………………...63
a. Localisation des sangliers infectés
………………………………………………..63
b. Origines de la contamination des sangliers en Allemagne
…………………..65
c. Les sangliers sont-ils un réservoir de virus
……………………………………..66
d. Voies de transmission sanglier-porc
……………………………………………...67
B.
L’utilisation d’eaux grasses et de déchets contaminés…………………………………………..69
C.
L’importation de porcs ou de produits de porcs contaminés…………………………………….70
D.
Facteurs de risque à l’origine des foyers secondaires de PPC…………………………………70
PARTIE IV : LES MESURES DE LUTTE CONTRE LA PPC EN ALLEMAGNE………72
I. La réglementation allemande : un état fédéral, une législation à plusieurs niveaux…73
A.
L’Allemagne, état membre de l’Union Européenne………………………………………
……….73
B.
L’Allemagne, un état fédéral………………………………………………………………………..74
II. Mesures générales de lutte contre la PPC chez les porcs domestiques……………..74
A. Mesures de prophylaxie sanitaire défensive………………………………………
………………..
75
1. Détection sérologique de la PPC chez les porc domestiques :
surveillance sanitaire……………………………………………………………………….75
2. Mesures préventives à prendre parles éleveurs………………………………………...75
B. Mesures de prophylaxie sanitaire offensive………………………………………
…………………
76
III. Mesures en vue du contrôle de la PPC chez les sangliers…………………………....77
A. Identification des populations infectées et suivi de l’infection…………………………………...78
B. Une pratique de la chasse orientée………………………………………
…………………………..
79
1. La chasse sans orientations a des effets plus néfastes que bénéfiques
………………
79
2. La gestion cynégétique allemande comme moyen de lutte contre la PPC
……………
80
C. Campagnes d’immunisation orale………………………………………
…………………………….
81
1. Principe et objectif de la vaccination des sangliers infectés
……………………………...
81
2. Résultats communs aux différents essais terrains……………………………………...82

8
3. Vaccination orale en Mecklembourg-Poméranie : un exemple d’éradication
de la PPC difficile à obtenir………………………………………
…………………………..
83
4. Vaccination orale en Rhénanie-Palatinat : un exemple de vaccination
en court d’application………………………………………
………………………………….
85
D. Alerter et informer…………………………………………………………………………………….87
PARTIE V : SYNTHESE ET DISCUSSION………………………………………………...90
I. PPC en Allemagne, le bilan………………………………………………………………...91
II. Risques pour les pays limitrophes………………………………………………………...99
CONCLUSION………………………………………………………………………………....103
BIBLIOGRAPHIE
…………………………………………………………………………………………...
106
ANNEXES
……………………………………………………………………………….……………………
113
Annexe 1………………………………………………………………………………………..113
Annexe 2………………………………………………………………………………………..114

9
TABLE DES ILLUSTRATIONS
FIGURES
Figure 1 : Localisation mondiale de la PPC depuis 1990 (d’après Paton et al., 2003)……..24
Figure 2 : Production et consommation en Allemagne de 1990 à 2002
en milliers de tec (source ITP) …………………….…………………….………………….27
Figure 3 : Evolution des importations et exportations allemandes (source ITP) …………...28
Figure 4 : Le cheptel porcin dans les Lander (régions allemandes) en 2002
(d’après données ZMP, 2003)…………….…………………….…………………………..29
Figure 5 : Le cheptel porcin dans les cantons (Kreis) allemands (d’après Weiss, 2003)…...31
Figure 6 : Evolution du cheptel porcin en Allemagne de 1992 à 2000
(d’après Haxsen, 2001) …………………….…………………….…………………………32
Figure 7 : Déficits et excédents régionaux en porcelets pour l’année 2000
(d’après Haxsen, 2001) …………………….…………………….…………………………33
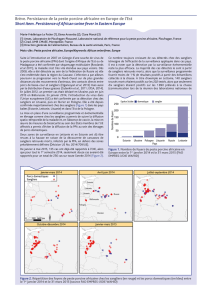
Figure 8 : Localisation géographique des foyers déclarés de 1993 à 1995………………….39
Figure 9 : Localisation géographique des foyers déclarés de 1996 à 1999………………….40
Figure 10 : Localisation géographique des foyers déclarés de 2000 à 2003………………...42
Figure 11 : Histogramme du nombre de foyers par année…………………………………..43
Figure 12 : Structure du génome du virus de la PPC (CSFV) représentant des
régions fréquemment amplifiées par RT-PCR et les parties séquencées correspondantes
(d’après Paton et al., 2000)
…………………….…………………….…………………………...
50
Figure 13 : Arbre phylogénétique réalisé à partir de l’analyse de la région 5’NTR
de 38 échantillons viraux allemands collectés de 1964 à 2000 ( EU-RL)
et des échantillons de référence (outgroup) souche Kanagawa (Japon)
(extrait de Wonnemann et al., 2001a ; nomenclature Greiser-Wilke et al., 1998)………….52
Figure 14 : Localisation géographique des différents types viraux identifiés
en Allemagne de 1989 à 2002 chez les porcs domestiques
(à partir de Fritzemeier et al., 2000 et Teuffert et al., 2002) ….……………………………53
Figure 15 : Arbre phylogénétique réalisé à partir de l’analyse de la région E2
de 38 échantillons viraux allemands collectés de 1964 à 2000 ( EU-RL)
et des échantillons de référence (outgroup) souche Kanagawa (Japon)
(extrait de Wonnemann et al., 2001a ; nomenclature Greiser-Wilke et al., 1998) …………57
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
1
/
111
100%