- enseignement Catholique

1
Document1
AUTEURS : Brigitte Janssens, Pascale Sartiaux
Fiche d’expérience 12
La corrosion du fer
Cette expérience peut être réalisée par les élèves moyennant le respect de certaines précautions (voir
le point 6. Sécurité) : dans ce cas, les points 2, 3, 4 et 6 leur sont destinés.
1. Objectifs de l’expérience
La corrosion est un terme général qui s’applique au processus de conversion des métaux en oxydes ou
en d’autres composés. Ce processus détériore graduellement les métaux.
Cette expérience a pour but d’identifier quelques-uns des facteurs impliqués dans la corrosion.
2. Description générale
Il s’agira ici de reproduire en laboratoire le phénomène d’apparition de la rouille, d’accélération de
ce phénomène et de la protection contre ce phénomène, à partir de laine d’acier, type tampon jex,
et de clous en fer.
3. Matériel et produits
a) Corrosion du fer
- 2 bocaux en verre ou béchers de 250 mL
- 1 couvercle (ou rond en carton un peu plus grand que le bocal) percé d’un orifice
- 1 thermomètre
- 1 éponge métallique en laine d’acier (tampon en laine d’acier extra-fine
1
)
- Vinaigre
b) Mise en évidence de quelques facteurs chimiques influençant la corrosion
- 8 tubes à essai
- 1 support pour tubes à essai
- 8 petits clous en fer bien décapés
- Eau distillée
- Eau bouillie
- Huile
- Solution d’hydroxyde de sodium (NaOH) 0,1 M
- Solution de carbonate de sodium (Na2CO3) 0,1 M
- Solution de chlorure de sodium (NaCl) 0,1 M
- Solution d’acide chlorhydrique (HCl) 0,1 M
- Solution d’acide nitrique (HNO3) 0,1 M
- Solution d’hexacyanoferrate (III) de potassium (K3Fe(CN)6) 0,1 M
- Solution de sulfate de fer (II) (FeSO4) 0,1 M
1
Les éponges métalliques, type Tampon Jex, ne conviennent pas car elles sont en inox, donc inoxydables.
HPT
Formation scientifique
UAA19

2
Document1
c) Comment accélérer ou ralentir la corrosion du fer ?
- 4 erlenmeyers de 250 mL
- 7 béchers de 250 mL
- 4 statifs avec 4 pinces et 4 noix de fixage
- 4 bouchons percés, munis chacun d’un tube en verre
- papier essuie-tout
- 4 éponges métalliques en laine d’acier (tampon en laine
d’acier extra-fine)
- Eau colorée avec un colorant alimentaire
- Sel de cuisine
- Vinaigre
4. Procédure
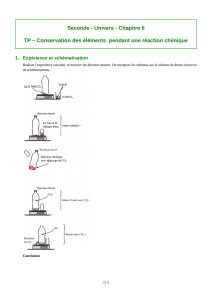
a) Corrosion du fer
1) Fermer le 1er bocal à l’aide du couvercle. Relever la température du bocal en plaçant un
thermomètre dans l’orifice du couvercle. Noter la température.
2) Placer l’éponge métallique dans le 2e bocal et la couvrir de vinaigre. Laisser agir une minute.
3) Retirer l’éponge et l’essorer. Jeter le vinaigre. Celui-ci a enlevé le revêtement protecteur de
l’éponge, laissant le métal exposé à l’air.
4) Replacer l’éponge dans le 1er bocal et refermer ce dernier à l’aide du couvercle percé.
5) Replacer le thermomètre dans l’orifice du couvercle et le plonger jusqu’au cœur de l’éponge.
6) Attendre 20 minutes. Observer et noter la température.
Remarque :
On peut parallèlement réaliser d’autres expériences similaires en modifiant un paramètre afin de mettre
en évidence les facteurs qui favorisent ou ralentissent la corrosion :
o laine d’acier de grosseur différente
o laine d’acier humidifiée avec du vinaigre ou laine d’acier sèche
o laine d’acier très fine, humidifiée avec du vinaigre et roulée dans du NaCl
o laine d’acier recouverte d’huile (simule une couche de peinture ou autre protection)
b) Mise en évidence de quelques facteurs de corrosion
1) Placer un clou en fer brillant et propre dans chacune des six éprouvettes (glisser avec soin
chaque clou le long de la paroi de l’éprouvette pour éviter d’en briser le fond).
2) Remplir partiellement chaque éprouvette d’un réactif différent de façon à couvrir le clou.
Tube n°
Description avant l’expérience
Observations après une nuit
1
H2O
2
Eau
bouillie
3
NaOH
4
Na2CO3
5
NaCl*
6
NaCl +
huile**
7
HCl
8
HNO3

3
Document1
3) Identifier chaque solution comme étant acide, basique ou neutre en utilisant du papier pH.
4) Laisser reposer les clous toute la nuit dans les solutions. Observer et consigner tous les
changements produits.
5) Ajouter à chaque solution 1 ou 2 gouttes de la solution d’hexacyanoferrate (III) de potassium.
Observer tout changement.
6) Comparer les résultats à celui obtenu par l’addition d’hexacyanoferrate de potassium à 1 mL
d’une solution de sulfate de fer (II).
7) Tirer les conclusions et déterminer les agents chimiques modifiant la corrosion du fer.
* Dans le tube à essai n°5, introduire la solution de NaCl en laissant la tête du clou dépasser.
** Dans le tube à essai n°6, introduire un clou et de l’eau salée recouverte d’une couche d’huile,
de telle manière que l’eau salée et l’huile recouvrent bien le clou.
c) Comment accélérer ou ralentir la corrosion du fer ?
1) Remplir 4 béchers avec la même quantité d’eau colorée.
2) Placer 3 éponges métalliques dans les 3 derniers béchers et
les couvrir de vinaigre. Laisser agir une minute.
3) Retirer la 1re éponge, la rincer rapidement et la sécher avec
du papier essuie-tout.
4) Retirer la 2e éponge et l’essorer.
5) Retirer la 3e éponge, l’essorer et la rouler dans du sel de
cuisine.
6) Introduire chacune des 3 éponges, ainsi que la 4e éponge
n’ayant pas subi de traitement, dans un erlenmeyer.
7) Fermer chaque erlenmeyer par un bouchon muni d’un tube
en verre.
8) Retourner les erlenmeyers et les fixer chacun à un statif à l’aide de la noix et de la pince.
9) Placer en dessous de chaque erlenmeyer un bécher rempli d’eau colorée.
10) Descendre simultanément les 4 erlenmeyers de telle manière que les tubes plongent dans
l’eau colorée.
11) Observer à la fois le liquide dans les tubes et les éponges métalliques.

4
Document1
5. Note pour le professeur
a) Corrosion du fer
Après 20 minutes, l’éponge a rouillé et la température à l’intérieur du bocal a augmenté.
Les réactions intervenant dans le processus de corrosion du fer sont :
- Le fer subit une 1re oxydation :
Fe(s) → Fe2+(aq) + 2 e-
- L’oxygène présent dans l’air est réduit en réagissant avec les ions H+ présents dans le
vinaigre :
O2(g) + 4 H+(aq) + 4 e- → 2 H2O(l)
- Formation de la rouille (oxyde de fer III) :
4 Fe2+(aq) + O2(g) + 4 H2O(l) + 2 x H2O(l) → 2 Fe2O3.x H2O(s) + 8 H+(aq)
On peut faire observer le parallélisme entre cette réaction de formation de la rouille et la réaction
de combustion (vue en 3e, dans l’UAA4 – Transformation de la matière). Lors de la réaction de
combustion, le combustible brûle en se combinant avec l’oxygène de l’air, lors de la formation de
la rouille, c’est le fer métallique qui réagit avec l’oxygène de l’air. Ces deux réactions sont deux
oxydations (du métal et du combustible) mais les combustions sont plus rapides et dégagent plus
d’énergie (sous forme de chaleur et lumière) que la corrosion du fer.
b) Mise en évidence de quelques facteurs de corrosion
Dans le tube n°1, le clou est en contact uniquement avec
l’air sec, le chlorure de calcium absorbant l’humidité de
l’air (donc boucher hermétiquement le tube à l’essai).
Dans le tube n°2, le clou est en contact avec l’eau salée
et l’air. Dans le tube n°3, le clou n’est en contact qu’avec
l’eau salée. Dans le tube n°4, le clou est en contact avec
de l’eau privée de dioxygène.
On observe que certains clous se recouvrent de rouille.
L’eau, le sel et le dioxygène dont des agents favorisant
la corrosion du fer. En particulier, l’action simultanée du
dioxygène de l’air et de l’eau favorise la corrosion du fer.
Quant au milieu salin, il accélère le phénomène de
corrosion.
c) Comment accélérer ou ralentir la corrosion du fer ?
Dans l’erlenmeyer contenant l’éponge métallique n’ayant subi aucun traitement, rien ne se passe.
Il en de même de l’erlenmeyer contenant l’éponge métallique séchée après avoir été plongée
dans le vinaigre et rincée (ou alors il faudra attendre très longtemps, bien au-delà d’une période
de cours…).
Dans les erlenmeyers contenant l’éponge métallique humidifiée au vinaigre et celle humidifiée au
vinaigre et roulée dans le sel, l’eau colorée va monter dans les tubes en verre ; dans le dernier
cas, la montée de l’eau démarrera plus rapidement. Cela témoigne de la consommation de
l’oxygène présent dans l’air du ballon lors de la formation de la rouille. On peut également
observer la rouille de ces deux éponges dans l’erlenmeyer.
Il est donc possible d’accélérer l’apparition de la rouille : dans la réaction chimique d’oxydation
du fer, la chaleur, le sel accélèrent l’apparition de la rouille sur les objets en fer. La plupart des
acides accélèrent également l’apparition de la rouille.

5
Document1
6. Sécurité
La réalisation d’expériences en particulier en chimie suppose le respect d’un certain nombre de
règles permettant à chacun, élèves et professeur, de vivre ces séances de laboratoire dans les
meilleures conditions de sécurité.
Pour chaque local où se déroulent de telles expériences, existe un règlement de laboratoire,
approuvé par le Conseiller en Prévention. Il sera signé par le chef d’établissement, le professeur,
l’élève et ses parents/responsables.
Chaque élève a une bonne connaissance de ce document.
Analyse de risques
7. Développements attendus principalement visés
Sur base d’une expérience réalisée en classe, mettre en évidence l’oxydation des métaux (A2).
À l’aide d’un exemple, décrire le phénomène de corrosion des métaux à l’air libre (C4).
Pour différents métaux exposés à l’air humide pendant plusieurs semaines, l’élève note ses
observations (il constate que la plupart des métaux se dégradent : ils se ternissent et se recouvrent
d’une couche d’oxyde métallique). Puis, il précise qu’il s’agit d’une réaction d’oxydo-réduction.
Sur base d’un document donné, retrouver la (les) conséquence(s) de la corrosion d’un métal (A3).
À partir d’un document, l’élève explicite que les conséquences de la corrosion ne sont pas les mêmes
suivant la nature du métal (formation d’une couche d’oxyde protectrice ou dégradation complète du
matériau).
8. Bibliographie
- CENTRE DES SCIENCES DE MONTREAL, Comment peut-on accélérer ou ralentir l’apparition
de la rouille ?, Guide Eclairs de sciences, 3e Cycle, Univers Matériel,
http://www.eclairsdesciences.qc.ca/activites/comment-peut-on-accelerer-ou-ralentir-lapparition-
de-la-rouille/, page consultée le 19 janvier 2016
- GRAHAM, I., DERAIME, S., Le grand livre des expériences, Ed. Gallimard Jeunesse, Paris, 2012,
p.32
- LINDREC, LEROUX, TANAVELLE, Quelques expériences sur la corrosion du fer,
http://www.enfa.fr/physique-chimie/wp-content/uploads/2009/10/corrosionfer_enseignant.pdf,
page consultée le 12 février 2016
Phases
Points-clés
Sources de danger
Nature du risque
Mesures de prévention préconisées
Avant
(Professeur)
Organisation de la
classe
Les déplacements des élèves
Afin de limiter les déplacements, installer
des postes de travail avec tout le matériel
nécessaire pour le groupe.
Pendant
(Professeur
et élèves)
/
/
/
Après
(Professeur
et élèves)
/
/
/
 6
6
1
/
6
100%