bac blanc - Lycée Saint

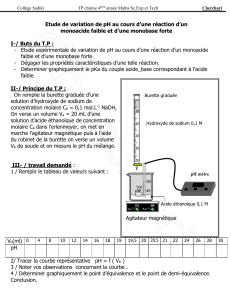
page 1 / 10
BAC BLANC
mars 2006
PHYSIQUE - CHIMIE
Série S
L’usage des calculatrices est autorisé
Ce sujet comporte un exercice de PHYSIQUE –CHIMIE, deux exercices de PHYSIQUE et un exercice de
CHIMIE présentés sur 10 pages numérotées de 1 à 10, y compris celle-ci et les feuilles annexes relatives
aux exercices I , II et IV, à rendre avec la copie, numérotées 8/10, 9/10 et 10/10.
Le candidat doit traiter les quatre exercices qui sont indépendants les uns des autres :
I. Temps de demi-vie et temps de demi-réaction (6 points)
II. Charge et décharge d’un condensateur (6 points)
III. Frédéric et son pistolet à fléchette (3 points)
IV. Déterminer la constante d’équilibre par deux méthodes (5 points)
DUREE DE L’EPREUVE : 3 H 30. - COEFFICIENT : 6

page 2 / 10
I. TEMPS DE DEMI-VIE ET TEMPS DE DEMI-REACTION (6 points)
1. Temps de demi-vie
Le thorium 230Th est utilisé dans la datation des coraux et concrétions carbonatées ainsi que dans la
datation des sédiments marins et lacustres. Dans un échantillon de « thorium 230 », on appelle N(t) le
nombre de noyaux de thorium présents à chaque date t et N0 celui des noyaux présents à la date t0 = 0 an.
On a représenté dans l’annexe 1 (A RENDRE AVEC LA COPIE) la courbe donnant le rapport
0
)(
N
tN
.
1.1. Le noyau 230Th est un émetteur α et se désintègre pour donner du 88Ra. Indiquer ce que représente α et
écrire l’équation de la réaction nucléaire correspondante, en énonçant les lois utilisées (le noyau de radium
est obtenu dans un état non excité).
1.2. Donner la définition du temps de demi-vie t1/2 et déterminer sa valeur pour le thorium 230Th en
expliquant succinctement la méthode utilisée.
1.3. Donner l’expression mathématique de la loi de décroissance radioactive et calculer la constante
radioactive en année –1.
1.4. Parmi ces grandeurs :
- l’âge de l’échantillon de noyaux
- la quantité initiale de noyaux.
- la température
- la nature des noyaux
quelle est la seule grandeur qui fait varier le temps de demi-vie ?
1.5. Le thorium 230Th fait partie de la famille radioactive de l’uranium 238U. Une famille radioactive est
composée d’un ensemble de noyaux radioactifs, tous issus d’un noyau initial instable qui, de père en fils,
par désintégrations successives conduisent à un noyau stable, ici le « plomb 206 ». L’ « uranium 238 »,
dissous à l’état de traces dans l’eau de mer, produit des atomes de « thorium 230 » suivant les réactions
nucléaires suivantes :
Donner les valeurs de Z4 et Z5, en les justifiant, et indiquer le type de radioactivité pour les deux premières
transformations.
1.6. Au début de leur formation, les concrétions carbonatées des coraux contiennent de l’ « uranium 238 »
et pas de « thorium 230 ». La méthode de datation de ces carbonates repose sur le rapport des nombres de
noyaux :
)(
)(
238
230
UN
ThN
. Ce rapport augmente au cours du temps jusqu’à ce qu’on appelle « l’équilibre
séculaire ». Celui-ci correspond à l’état où les deux populations des noyaux d’ « uranium 238 » et de
« thorium 230 » ont même activité.
1.6.1. L’activité A(t) d’une population de noyaux identiques est définie ici par :
dt
tdN
tA )(
)( !=
Montrer que A(t) = λ.N(t) pour une population de noyaux donnée.
1.6.2. En déduire, qu’à l’équilibre séculaire, le rapport
)(
)(
238
230
UN
ThN
est constant.
ThUPaThU ZZ
230234234
91
234
90
238
92 54 !!!!

page 3 / 10
2. Temps de demi-réaction :
On étudie maintenant la décomposition chimique au cours du temps, en présence d’un catalyseur,
d’une solution aqueuse de peroxyde d’hydrogène ou eau oxygénée, de concentration molaire effective
[H2O2]0 = 9,0×10–2 mol.L–1 à t0 = 0 s, suivant la réaction :
2 H2O2 (aq) = O2 (g) + 2 H2O (l)
Le peroxyde d’hydrogène se décompose à température ambiante.
La courbe de l’annexe 2 (A RENDRE AVEC LA COPIE) donne l’évolution de la concentration de la
solution aqueuse d’eau oxygénée en fonction du temps.
2.1. L’eau oxygénée appartient au couple O2 / H2O2.
En utilisant l’équation associée à la réaction précédente, donner le second couple auquel appartient l’eau
oxygénée, en précisant pour chaque couple si elle constitue l’oxydant ou le réducteur.
2.2. Justifier en exploitant la courbe, sans calcul, le fait que l’on peut considérer la décomposition du
peroxyde d’hydrogène comme une transformation chimique lente et totale.
2.3. Définir le temps de demi-réaction. Déterminer sa valeur approximative à partir de la courbe 1 de
l’annexe 2.
2.4. Effet de la concentration initiale
La courbe 2 de l’annexe 2 donne l’évolution de la concentration de la solution d’eau oxygénée en fonction
du temps, avec : [H2O2]0 = 1,8×10 –1 mol.L-1
A partir des courbes 1 et 2, quelle est l’influence de la concentration molaire initiale sur le temps de demi-
réaction ?
2.5. Effet de la température
Sur la figure de l’annexe 2 tracer l’allure de la courbe donnant, pour une température plus faible,
l’évolution de la concentration de la solution d’eau oxygénée en fonction du temps, avec
[H2O2]0 = 9,0×10 –2 mol.L-1
3. Conclusion
Les grandeurs
0
)(
N
tN
et [H2O2](t) évoluent dans le temps suivant la même loi mathématique.
Quelle(s) analogie(s) et quelle(s) différence(s) peut-on constater en ce qui concerne les facteurs qui
influencent le temps de demi-vie et le temps de demi-réaction dans les exemples étudiés ?
Remarque : ce résultat, obtenu dans le cas de la réaction étudiée, n’est pas généralisable à toute
transformation chimique.

page 4 / 10
II. CHARGE ET DECHARGE D’UN CONDENSATEUR (6 points)
I. Dipôle RC.
On réalise le montage ci-contre comportant :
- un générateur de f.é.m. E = 9,0 V et de résistance interne
négligeable ;
- un condensateur dont la capacité varie entre 40 et 80 µF ;
- un conducteur ohmique de résistance R = 40 Ω.
1. Le condensateur est préalablement déchargé. Quel est le
phénomène physique mis en jeu quand on place l’interrupteur
K en position (1) ? Pourquoi ce phénomène est-il très rapide ?
2. Un ordinateur muni d’une carte d’acquisition permet d’enregistrer l’évolution au cours du temps de la
tension uAM aux bornes du condensateur. L’acquisition commence quand on bascule l’interrupteur K de la
position (1) à (2). Ces données sont traitées par un tableur grapheur pour obtenir la courbe de la figure 1 de
l’annexe 3 (A RENDRE AVEC LA COPIE).
2.a. Quel est le phénomène physique mis en évidence ?
2.b. En utilisant la courbe de la figure 1 de l’annexe 3 (A RENDRE AVEC LA COPIE), déterminer la
constante de temps de ce phénomène ; en déduire une valeur approchée de la capacité du condensateur.
2.c. On reprend cette expérience avec un condensateur de capacité deux fois plus grande. Dessiner sur la
figure 1 de l’annexe 3 (A RENDRE AVEC LA COPIE) l’allure de la courbe obtenue. Justifier
brièvement.
3. L’étude théorique de ce phénomène conduit à une équation différentielle : RC
du c
dt
+ uc = 0
où uC est la tension aux bornes du condensateur.
3.a. Retrouver cette équation différentielle en appliquant la loi d’additivité des tensions.
3.b. La solution de cette équation différentielle est de la forme : uC = A . e- B.t.
Déterminer l’expression des constantes positives A et B.
II. Dipôle RLC.
On réalise le montage suivant comportant :
- un générateur de f.é.m. E = 9,0 V et de résistance interne
négligeable ;
- un condensateur dont la capacité varie entre 40 et 80 µF ;
- une bobine d’inductance L = 1,0 H et de résistance interne
r = 10 Ω ;
- un conducteur ohmique de résistance R’ = 5,0 Ω.
L’interrupteur K est placé en position (1) puis basculé en
position (2), l’acquisition commence à ce moment.
1.a. Quelles sont les grandeurs mesurées en voies Y1 et Y2 du système d’acquisition ?
1.b. L’une des grandeurs permet de connaître les variations de l’intensité i du courant électrique.
Laquelle ? Justifier.
uC

page 5 / 10
2. Les données acquises en voies Y1 et Y2 sont traitées par un tableur grapheur pour obtenir la courbe de la
figure 2 de l’annexe 3 (A RENDRE AVEC LA COPIE).
2.a. Associer les courbes x et y de la figure 2 de l’annexe 3 (A RENDRE AVEC LA COPIE) aux voies
Y1 et Y2.
2.b. Quel est le phénomène observé ? Pourquoi ne se produit-il pas dans l’expérience de la partie I ?
2.c. Mesurer la pseudo-période T des oscillations, en déduire la valeur de la capacité C.
3. Le tableur grapheur permet d’obtenir les courbes représentant les variations de l’énergie électrique EE
emmagasinée par le condensateur ; de l’énergie magnétique EM emmagasinée par la bobine et de leur
somme E = EE + EM. Ces courbes sont données à la figure 3 de l’annexe 3 (A RENDRE AVEC LA
COPIE).
3.a. Donner les expressions littérales des énergies EE et EM.
3.b. Identifier les courbes (3) ; (4) ; (5) de la figure 3 de l’annexe 3 (A RENDRE AVEC LA COPIE) en
justifiant la réponse. En comparant les courbes (3) et (4), donner une interprétation du phénomène étudié.
3.c. Interpréter qualitativement l’évolution de l’énergie représentée par la courbe (5). Évaluer l’énergie
dissipée pendant les 50 premières millisecondes.
III. Frédéric et son pistolet à flèches (3 points)
Frédéric décide d'utiliser ses connaissances en mécanique pour étudier le mouvement d’une flèche tirée par
son pistolet.
Négligeant l'action de l'air et prenant la valeur g = 10 m.s-2 pour la pesanteur, il considère la flèche A
comme un objet ponctuel de masse m = 50 g et de vitesse initiale
0
v
r
.
La flèche est tirée d'un point M, à la distance d, au-dessus du sol, avec une vitesse
0
v
r
verticale.
1. Etude théorique du mouvement de la flèche.
Dans le repère (O, x, y) (cf. schéma ci-contre), O étant le point du sol
se trouvant à la verticale de M), établir sous forme littérale les
équations horaires du mouvement de la flèche après son lancement.
2. Détermination expérimentale de la valeur vo.
Le canon du pistolet est vertical ; son extrémité est située au point M2
tel que d = 1,70 m. Frédéric tire vers le haut et constate que la flèche
touche le sol 2,20 s après son départ de M2.
Calculer la valeur vo de la vitesse initiale, en utilisant les équations
établies dans la première partie.
3. Sommet de la trajectoire.
Calculer la valeur H de la hauteur maximale atteinte par la flèche, en utilisant les équations établies dans la
première partie.
M
y
x
d
i
r
j
r
0
v
r
O
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%