Validation analytique des résultats

Qualité et accréditation en biologie médicale
Ann Biol Clin 2010 ; 68 (Hors série no1) : 223-226
SG2-04
Validation analytique des résultats
A. Vassault, J. Arnaud, A. Szymanovicz
et les membres du sous-groupe 2 analytique*
Groupe de travail SFBC «Accréditation des laboratoires de biologie médicale »
(coordonnateur M. Vaubourdolle)
RÉSUMÉ
Les résultats, au fur et à mesure de leur production, doivent être revus avant d'être soumis
à la validation définitive par le biologiste médical qui autorise leur mise à disposition. Cette
opération, dans le cas des laboratoires automatisés, consiste à transférer les séries de résultats
de l'analyseur automatique vers le système d'information du laboratoire et donc de s'assurer
que toutes les étapes du processus ont été accomplies conformément aux exigences définies.
Cet article propose de rassembler les différents éléments indispensables à prendre en compte
dans cette étape de validation.
MOTS CLÉS : accréditation |ISO 15189 |validation analytique |contrôle interne de qualité
|étalonnage |système analytique
ABSTRACT Analytical validation of the results
The results obtained using automatic analysers have to be reviewed before release to the
laboratory information system (LIMS) for definitive validation by the authorised person. The
objective of such a review is to ensure that quality indicators are in agreement with the
defined requirements and that the procedures have been carefully fulfilled.
KEY WORDS: accreditation |ISO 15189 |analytical validation of the results |internal quality
control |calibration |analytical system
* Liste des membres du SG2 : Anne Vassault (coordonnateur), Valérie Adjidé, Josiane Arnaud, Pascal
Bailly, Frédéric Barbier, Bruno Baudin, Catherine Bourcier, Éric Chapuzet, Patrice Combe, Jacques de Graeve,
Jean-Louis Dhondt, Laurence Drouard, Patrice Fournier, Claude Giroud, Line Guezenec, Joseph Henny, Anne
Hulin, Guy Lalau, Christian Nourrin, Jean-Marc Pavard, Agnès Perrin, Henri Portugal, Olivier Reuilly, Jean
Pascal Siest, Anton Szymanowicz
223
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 04/06/2017.

SG2 PHASE ANALYTIQUE –SG2-04
SG2-04 Validation analytique des résultats
Objet et domaine d'application
➥
Ce document décrit les éléments à prendre en compte pour valider les résultats
sur le plan analytique et permettre l'élaboration du compte rendu. Cette étape
précède la validation du compte rendu effectuée par le biologiste médical.
1Contexte : exigences du guide de bonne exécution
des analyses de biologie médicale (GBEA)
«La validation des résultats est double : elle comporte la validation analytique, qui peut être réalisée par
le technicien de laboratoire médical, et la validation biologique, qui engage la responsabilité exclusive
du biologiste médical.
La validation analytique comporte la vérification de la conformité des conditions d'exécution aux procé-
dures et tient compte notamment des résultats obtenus avec les échantillons de contrôle.
La validation analytique des examens de biologie médicale, interne au laboratoire de biologie médicale,
doit être soumise à des procédures précises écrites. Elle ne doit être effectuée qu'après avoir vérifié les
indicateurs de bon fonctionnement des instruments et pris connaissance des résultats du contrôle interne
de qualité »(GBEA, 1999).
La législation actuelle ne considère plus que la validation biologique qui conditionne la
transmission du résultat d'examen au clinicien ou au patient. Toutefois, la validation
analytique reste une étape importante au sein du laboratoire qui permet de mieux
maîtriser la fin du processus de la phase analytique.
2Procédure de validation analytique
Les différentes étapes sont résumées dans le logigramme de la figure 1 :
➜Indicateurs de bon fonctionnement
Ils sont propres à chaque système analytique. D'une façon générale, ces indicateurs
révèlent des anomalies pouvant se produire à différents niveaux :
•système de traitement des échantillons (distribution, mesure des volumes, des
températures, état des tubulures, protection contre l'évaporation, contamina-
tions, prédilutions, etc.) ;
•système de dosage (étalonnage, réactifs, mesures des volumes, mesure des
températures, etc.) ;
•système de mesure (cuves, lampe, électrodes, etc.), système de traitement des
informations (calculs, arrondis, etc.). L'examen des courbes d'étalonnage et celui
des signaux afférents constitue un élément très pertinent pour évaluer le bon
fonctionnement d'un système analytique.
224
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 04/06/2017.
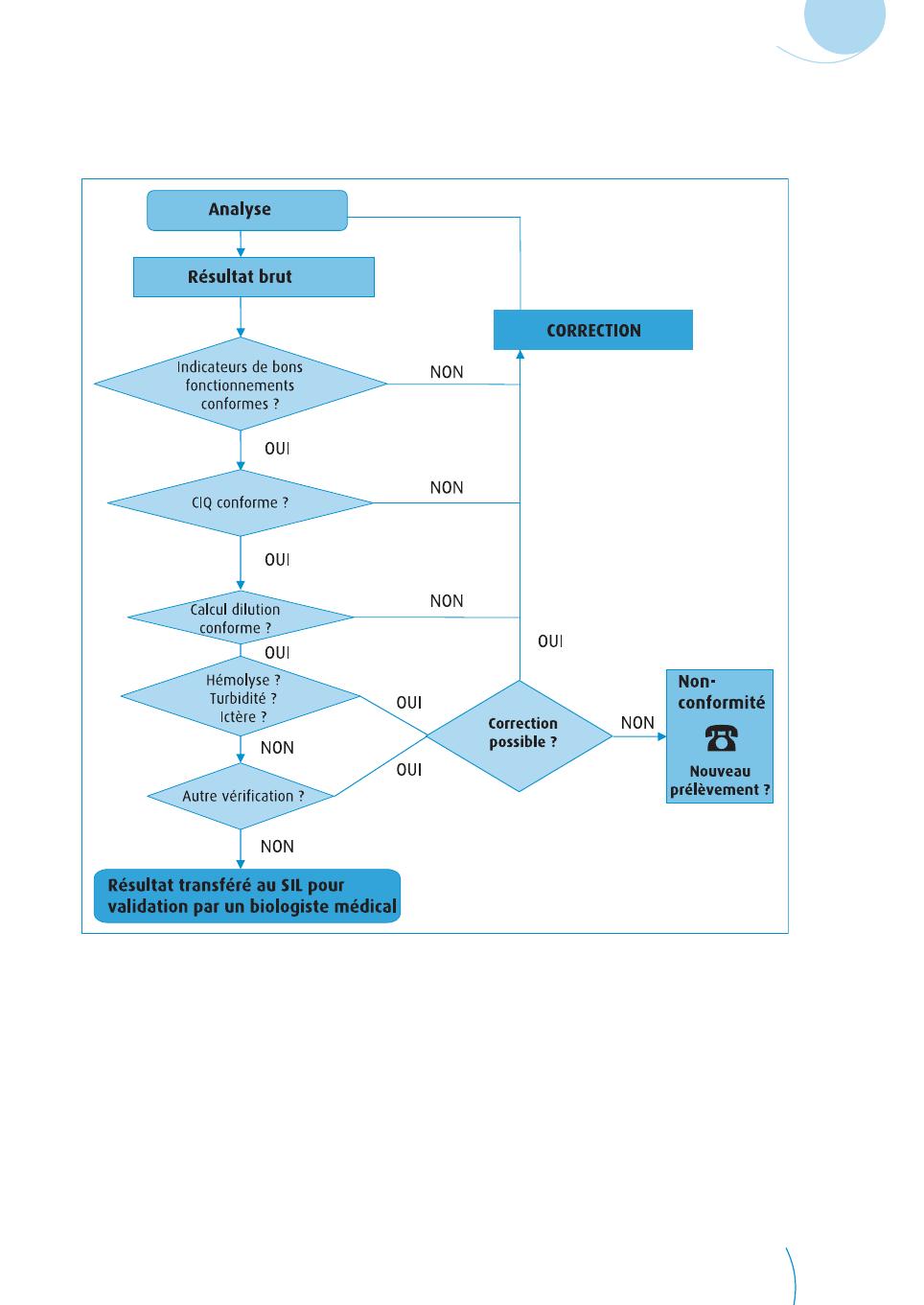
➜FIGURE 1 : VALIDATION ANALYTIQUE DES RÉSULTATS
f:\2000\image\130591\vassault2\1
CIQ : contrôle interne de qualité ; SIL : système d'information du laboratoire.
➜Résultats du contrôle interne de qualité
Ils doivent être conformes à ceux attendus : la mise à disposition des résultats ou leur
transfert d'un analyseur vers le système d'information du laboratoire (SIL) sont condi-
tionnés par la conformité des résultats observés pour les échantillons de contrôle ana-
lysés dans le cadre du programme de contrôle interne de qualité mis en place (
cf.
article
SG2-03). Les résultats obtenus avec les échantillons de contrôle traduisent le fonction-
nement du processus analytique et la fiabilité des résultats de la série des analyses,
pourvu que l'étendue des valeurs dans laquelle le contrôle est prévu corresponde aux
niveaux de concentration des échantillons biologiques analysés.
225
Recommandations pour l'accréditation des laboratoires de biologie médicale 1
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 04/06/2017.

➜Vérification de la prise en compte des dilutions éventuelles
Lorsque les résultats sont situés au-delà de la limite supérieure de linéarité de la tech-
nique utilisée, une dilution doit être effectuée, manuellement ou automatiquement pro-
grammée par l'analyseur. Dans ce cas, l'opérateur doit s'assurer qu'il a été tenu compte
dans les calculs des dilutions effectuées.
➜Anomalies signalées par les analyseurs automatiques
La plupart des analyseurs automatiques correctement programmés signalent pour
chaque échantillon biologique, par une alarme, toute anomalie relative au signal mesuré.
Dans ce cas, l'opérateur doit en tenir compte et procéder aux corrections nécessaires.
Les opérations à déployer dépendent de chaque système analytique et doivent être
répertoriées dans la procédure (par ex. : excès d'antigène, défaut de substrat, etc.).
➜Interférences
Les interférences potentielles de l'hémolyse, de la turbidité et de la bilirubine (ictère), de
certains médicaments, d'anticorps hétérophiles, etc. doivent être vérifiés. Certains échantillons
biologiques présentent des particularités qui peuvent être détectées soit par l'oeil de l'opéra-
teur, soit par le système d'alarme de l'analyseur automatique ou être signalées par le prescrip-
teur. L'utilisation de systèmes analytiques susceptibles de quantifier les interférences visibles
les plus fréquentes est recommandée. La conduite à tenir doit être précisée dans un document
mis à la disposition de l'opérateur. Dans ce cas, l'opérateur doit respecter les instructions
établies par le biologiste et les appliquer si l'influence de cette anomalie est jugée importante,
c'est-à-dire susceptible de conduire à des résultats erronés, de procéder à son élimination si
cela est possible (par ex., une déprotéinisation dans le cas d'un ictère) ou à un refus d'exécution
de l'analyse (cas des échantillons pour lesquels l'hémolyse interdit de quantifier avec fiabi-
lité l'analyte). Dans ce cas, le prescripteur devra être averti dans les meilleurs délais. Une
vérification avec un nouvel échantillon après un nouveau prélèvement sera effectuée si
l'interférence ne relève pas de la pathologie du patient (par ex., anémie hémolytique et
hémolyse) ou de sa prise en charge thérapeutique (interférence médicamenteuse).
➜Vérification d'un résultat
L'opérateur peut avoir à vérifier des résultats s'il soupçonne une anomalie comme une
contamination, une évaporation, un bouchage ou lorsque le résultat n'est pas compatible
avec la physiopathologie. Une confrontation des résultats avec les antériorités notam-
ment est indispensable pour prévoir l'utilité d'une dilution par exemple.
La validation analytique se termine par l'envoi des résultats vers le SIL.
Les étapes suivantes relèvent de la validation biologique (
cf.
SG3, volume 2) :
■vérification de la compatibilité des résultats entre eux au sein d'une même
demande d'analyse ;
■vérification de la compatibilité des résultats avec les résultats antérieurs en
prenant en compte les informations concernant la prise en charge du patient ;
■vérification de la compatibilité des résultats en fonction des renseigne-
ments cliniques, thérapeutiques, nutritionnels et environnementaux ;
■libération des résultats et envoi au prescripteur (et/ou au patient).
226
SG2 PHASE ANALYTIQUE –SG2-04
Conflits d'intérêts : aucun
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 04/06/2017.
1
/
4
100%








