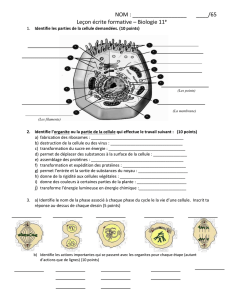
Approche documentaire : à partir de documents sur la pression

Approche documentaire MathSpé PC 2014-2015
Lycée Descartes Page 1 sur 7
Approche documentaire : à partir de documents sur la pression osmotique,
discuter de l’influence de la pression sur le potentiel chimique et des
applications de cette propriété au laboratoire, en industrie ou dans le vivant.
L'osmose (du grec ὠσμός, qui veut dire «poussée») est un phénomène de diffusion de
matière à travers une membrane semi-perméable.
Lorsque deux solutions sont séparées par une membrane semi-perméable (perméable au
solvant mais pas aux solutés), un transfert de solvant se produit de la solution la moins
concentrée (milieu hypotonique) vers la solution la plus concentrée (milieu hypertonique)
jusqu'à l'équilibre (milieux isotoniques). C’est le phénomène d’osmose.
De même, quand la membrane sépare du solvant pur et une solution de ce même solvant,
un afflux de solvant dans la solution est observé. On appelle pression osmotique π la
surpression qui doit être appliquée à la solution pour empêcher cet afflux de solvant.
Si une pression supérieure à la pression osmotique est appliquée à la solution, le transfert
de solvant s’effectue dans l’autre sens. C’est le phénomène d’osmose inverse.

Approche documentaire MathSpé PC 2014-2015
Lycée Descartes Page 2 sur 7
Document 1 : Approche historique
Il semble que le phénomène d’osmose ait été découvert
par hasard par le physicien, ecclésiastique et épicurien
français Jean-Antoine Nollet, en 1748. En effet, l'abbé
Nollet, pour conserver la fraicheur de son vin, aurait utilisé
un morceau de vessie animale tendue et attachée
fermement autour du col d'une fiole à demi remplie de vin,
qu'il a ensuite immergée dans l'eau froide. Au bout de
quelques heures, le volume de la solution à l'intérieur de la
fiole avait augmenté jusqu'à la capacité maximale de la
fiole. Fort heureusement, le vin était encore frais et
consommable, bien que moins alcoolisé…
En 1886 le chimiste néerlandais Jacobus Van't Hoff (1852-1911)
explique par la thermodynamique le phénomène d’osmose et publie
une analogie entre la pression osmotique au sein des solutions
aqueuses et l’équation des gaz parfaits. Il recevra en 1901 le premier
prix Nobel de chimie « en reconnaissance des services extraordinaires
qu'il a rendus par la découverte des lois de la dynamique chimique et
de la pression osmotique dans les solutions »
En 1950, le phénomène d’osmose inverse est mis en évidence par le physicien américain Reid.

Approche documentaire MathSpé PC 2014-2015
Lycée Descartes Page 3 sur 7
Document 2 : Thermodynamique de l’osmose
Le phénomène d’osmose repose sur le transfert de particules à
travers une membrane semi-perméable. Constituées souvent de
polymères organiques (acétate de cellulose, polyamides…) elles
apparaissent à l’échelle moléculaire comme un enchevêtrement de
macromolécules (figure 1). Les cavités entre les chaînes sont assez
larges pour laisser passer des petites molécules de solvant (eau
souvent) mais trop petites pour que des solutés hydratés la
traversent. Néanmoins la taille ne fait pas tout et des molécules plus
grosses que les cavités peuvent aussi traverser la membrane qui se
déforme alors localement pour solubiliser les espèces.
Figure 1
D’une façon plus générale les membranes permettent de réaliser des filtrations et le tableau
ci-dessous indique la taille des particules stoppées et les domaines d’application :
Technique séparative
Taille des particules stoppées
Applications
Filtration
conventionnelle
supérieure à 5 m
Filtration classique
Micro filtration
supérieure à 1 m
potabilisation de l'eau, traitement des effluents.
Ultra filtration
supérieure à 50 nm
industrie agroalimentaire, bio-industries,…
Nano filtration
supérieure à 1 nm
élimination d'ions multivalents, régénération de bains
usés de traitements de surface,…
Osmose, osmose inverse
supérieure à 0,4 nm
production d'eau ultra-pure, dessalement d'eau de mer.
Rappel : la "taille" de la molécule d'eau est de l'ordre de 0,3 nm.
Pour comprendre l’origine du phénomène d’osmose nous allons
considérer le système ci-contre (figure 2) :
un compartiment (1) contenant nA(1) mol de solvant A et nB(1)
mol de soluté B à une température T et sous une pression P.
un compartiment (2) contenant nA(2) mol de solvant A et nB(2)
mol de soluté B à une température T et sous une pression P.
une membrane semi-perméable entre les 2 compartiments ne
laissant passer que les molécules de solvant.
On considèrera que la solution (2) est plus concentrée que la
solution (1) (xB(2) > xB(1)) et que les solutions sont idéales.
L’osmose directe se traduit alors par un flux de solvant du
compartiment (1) au compartiment (2) donc de la solution la moins
concentrée vers la plus concentrée (figure 2).
En effet, en considérant pression et température constantes on peut
écrire la différentielle de l’enthalpie libre totale du système dG :
)1(
)2(
)1(
)1()2()1()2()2()1()1(
ln A
A
A
AAAAAAA
dn
x
x
RTdGdonc
dndndndG
Le solvant passe donc spontanément du compartiment (1) au (2). Q1
Figure 2
h

Approche documentaire MathSpé PC 2014-2015
Lycée Descartes Page 4 sur 7
Si le compartiment (1) contient du solvant pur, on
peut définir la pression osmotique comme la
surpression à appliquer à la solution du compartiment
(2) pour empêcher l’afflux de solvant dans la solution et
avoir le système ci-contre (figure 3) à l’équilibre.
En traduisant l’égalité des potentiels chimiques du
solvant dans les 2 compartiments à l’équilibre
thermodynamique, on peut montrer après quelques
lignes de calcul et approximations que la pression
osmotique π des solutions idéales diluées se met sous
la forme suivante appelée loi de Van’t Hoff :
Figure 3
Loi de Van’t Hoff : π = CB RTi
où π est la pression osmotique en Pascal
CB est la concentration molaire volumique du soluté en mol.m-3
R est la constante des gaz parfaits (8,314 J.K-1.mol-1)
et T est la température en Kelvin
Remarques :
1. Si la solution contient plusieurs solutés la pression osmotique se met sous la forme :
RTCi
2. Si la solution n’est pas idéale on admet généralement que l’équation de Van’t Hoff se
réduit au premier terme du développement polynomial suivant :
)1(...)1( 2BBBBB aCRTCbCaCRTC
, a est la constante du viriel osmotique.
Pour mesurer les pressions osmotiques des osmomètres ont
été construit, correspondant au montage ci-contre (figure 4). La
situation se complique alors un peu : au début les niveaux sont à
la même hauteur dans le solvant et dans la solution qui contient
une concentration CB init en soluté. L’afflux de solvant dans la
solution dilue le soluté et provoque une montée de la solution
dans l’osmomètre. On atteindra l’équilibre quand la pression
hydrostatique de la colonne de solution coïncidera avec la
pression osmotique. Cela permet d’établir facilement la formule :
π = CB fin RT = solvant g hi
où g est l’accélération de la pesanteur (9,81 m.s-2),
CB fin est la concentration finale en soluté en mol.m-3
solvant est la masse volumique du solvant en kg.m-3
et h est la hauteur de la colonne de solution en m.
Figure 4
Les pressions osmotiques peuvent atteindre des valeurs très importantes : ainsi, pour de
l’eau de mer (assimilée à une solution de chlorure de sodium à 32 g.L-1) à 15 °C, elle atteint
plus de 20 bars !
(1)
(2)

Approche documentaire MathSpé PC 2014-2015
Lycée Descartes Page 5 sur 7
Document 3 : Une application au laboratoire
Détermination des masses molaires par osmométrie
L’une des applications les plus courantes de l’osmométrie est la mesure des masses
molaires des macromolécules telles que les protéines et les polymères synthétiques.
La masse molaire de l’hémoglobine peut ainsi être déterminée à partir de la mesure de
pression osmotique suivante : en dissolvant dans 100 mL d’eau 4,00 g d’hémoglobine
humaine on obtient une solution dont la pression osmotique à 7,4 °C est de 13,4 mbar.
Hémoglobine :
protéine constituée de quatre chaînes identiques
deux à deux. Chacune de ces chaînes est associée
à un groupement particulier, l’hème constitué d’un
ion fer (II) partiellement complexé. Contenue dans
les globules rouges, son rôle est de transporter
l'oxygène des poumons aux tissus et le dioxyde de
carbone dans le sens inverse.
La masse molaire de l’hémoglobine humaine est de
l’ordre de 65000 g.mol-1.
Réaliser une série de mesure à des concentrations différentes permet d’améliorer la
précision de la masse molaire obtenue.
Ainsi, pour mesurer la masse molaire moyenne d’un échantillon de PVC (polychlorure de
vinyle) des chercheurs ont réalisé différentes solutions (non idéales à cause de la taille des
macromolécules) à 25°C dans la cyclohexanone. Le tableau suivant indique les hauteurs de
solution ( = 0,980 kg.L-1) dans l’osmomètre en fonction de la concentration massique en
polymère, ce qui a permis aux chercheurs de déterminer que la masse molaire moyenne
du
polymère était de 120 kg.mol-1 et son degré de polymérisation moyen était de 1920.
C (g.L-1)
1,00
2,00
4,00
7,00
9,00
h (cm)
0,28
0,71
2,01
5,10
8,00
PVC ou polychlorure de vinyle : polymère constitué de macromolécules dans lesquelles
le motif unitaire (-CH2-CHCl-) se répète un très grand nombre de fois.
Masse molaire : M(Cl) = 35,5 g.mol-1
 6
6
 7
7
1
/
7
100%