Protéines Ras et transmission des signaux mitogènes - iPubli

SYNTHÈSE
1 994 ; 10 65 7-64
Piee Ch
Protéines Ras et transmission
des signaux mitogènes
cfos.
L

1
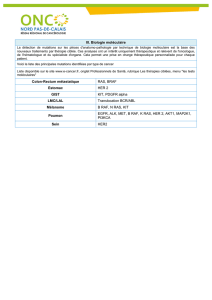
X

RasGRF
Sos
hSos1
hSos2

Protéine Raf-1
3.
JO,

Ras GTPase Activating Protein p120GAP
 6
6
 7
7
 8
8
1
/
8
100%