La glycémie postprandiale

L’ESSENTIEL SUR…
352Diabète & Obésité • Novembre 2011 • vol. 6 • numéro 53
COMMENT L’IDENTIFIER,
COMMENT LA DÉFINIR ?
CLINIQUE
D’abord par la clinique, car si l’HPP
est influencée par plusieurs fac-
teurs (la glycémie préprandiale, le
taux d’incrétines, la sécrétion d’in-
suline), la sensibilité à l’insuline
des tissus périphériques est au
premier plan. Par conséquent,
le patient insulinorésistant est à
risque d’HPP et le surpoids avec
un tour de taille augmenté sont
des indicateurs de cette anomalie
métabolique (1).
BIOLOGIE
❚La tolérance normale
au glucose
Chez les sujets ayant une tolé-
rance normale au glucose, la glycé-
mie plasmatique ne dépasse géné-
ralement pas 7,8 mmol/l (1,40g/l)
à la suite de la prise d’aliments et
revient physiologiquement à son
niveau préprandial au bout de
2 heures (2).
*CHU de Bordeaux
L’Organisation mondiale de la
santé définit par ailleurs la tolé-
rance normale au glucose par une
valeur glycémique inférieure à
7,8 mmol/l (140 mg/dl) 2 heures
après l’ingestion d’une charge de
75 g de glucose (hyperglycémie
provoquée par voie orale [HGPO]).
❚L’état postprandial
L’état postprandial correspond à
la période de 4 à 6 heures sui-
vant un repas pendant laquelle
les glucides sont progressive-
ment hydrolysés et absorbés
au niveau intestinal. Les phéno-
mènes postprandiaux peuvent se
recouvrir les uns les autres durant
la journée, du fait de la succes-
sion des prises alimentaires (3).
Au cours d’une journée, le temps
passé en état postprandial se ré-
vèle beaucoup plus long que les
périodes de jeûne : chez un sujet
normal, le cumul des périodes
postprandiales atteint environ
12 heures par jour, contre seule-
ment 2 heures en fin de nuit pour
l’état strictement à jeun (4).
Des analyses de profil glycé-
mique sur le nycthémère ont
permis d’estimer que la du-
rée cumulée de l’élévation des
chires glycémiques au-delà
des valeurs préprandiales était
de l’ordre de 6 heures chez le
sujet non diabétique et pouvait
atteindre 12 à 15 heures chez le
patient diabétique
(Fig. 1)
.
C’est l’utilisation des méthodes de
mesure en continu de la glycémie
qui a permis de mieux cerner la dé-
gradation progressive de la glycé-
mie et de confirmer que la perte du
contrôle de la glycémie postpran-
diale (GPP) est un phénomène
précoce (5).
xxxxx
xxxxx
xxxxxx
xxxxx
© Chris Fertnig - iStockphoto
La glycémie postprandiale
Un paramètre à prendre en compte (aussi)
dans le diabète de type 2
n
Si la prise en compte de l’hyperglycémie postprandiale (HPP) est admise de longue date dans le
diabète de type 1, son diagnostic et sa prise en compte sont plus récents dans le diabète de type 2
(DT2). Mieux diagnostiquée, elle est mieux ciblée par les molécules récentes car elle est probable-
ment directement impliquée dans les complications macrovasculaires.
Pr Bogdan Catargi*

LA GLYCÉMIE POSTPRANDIALE
Diabète & Obésité • Novembre 2011 • vol. 6 • numéro 53 353
QUELLES VALEURS
CIBLES ?
Les valeurs cibles de la glycémie
recommandées par les sociétés
savantes sont présentées dans le
tableau 1
.
RELATION
ENTRE GLYCÉMIE
POSTPRANDIALE
ET RISQUE
CARDIOVASCULAIRE
Cette relation a été mise en évidence
par plusieurs études épidémiolo-
giques dont DECODE (6) menées
sur une large cohorte de population
non diabétique. Tous ont bénéficié
d’une HGPO lors de l’inclusion. Les
valeurs prédictives de la glycémie
à jeun et de la glycémie à 2 heures
étaient étudiées et comparées à la
mortalité totale.
Le principal résultat était que plus
la GPP est élevée, plus le risque de
mortalité augmentait et, ce, quel que
soit le niveau de la glycémie à jeun.
La valeur prédictive de la glycé-
mie à 2 heures s’est avérée indé-
pendante de la glycémie à jeun.
Ceci souligne le fait que la relation
entre hyperglycémie (ou HbA1c) et
le risque cardiovasculaire dans la
population générale n’implique pas
uniquement la glycémie à jeun mais
aussi la glycémie postcharge.
LES ÉTUDES
D’INTERVENTION
L’ÉTUDE STOP-NIDD
Il y a très peu d’études d’interven-
tion, et encore moins qui soient
concluantes car le risque vasculaire
est plurifactoriel. La plus ancienne
est l’étude STOP-NIDD qui a suivi 1
429 patients intolérants au glucose
pendant au moins 3 ans, traités par
acarbose et qui a montré une ré-
duction significative du risque
cardiovasculaire
(Fig. 2)
(7).
LES ÉTUDES SUR
L’ATHÉROSCLÉROSE
Plus nombreuses sont les études
qui se sont intéressées aux critères
indirects de l’athérosclérose, et en
particulier l’épaisseur intima/media
(EIM). K. Esposito a étudié l’impact
spécifique sur la GPP de 175 patients
diabétiques de type 2 du repaglinide
versus le glyburide. La glinide s’est
avérée plus ecace sur la glycé-
mie postprandiale, la GPP, (- 0,7
g/l vs - 0,5 g/l) et a permis une ré-
duction plus importante de l’EIM
(Fig. 3)
(8).
L’ÉTUDE NAVIGATOR
On attendait beaucoup de l’étude
15
14
Concentration en glucose (mmol/l)
Durée du diabète (année)
Temps (heures)
HbA1c : ■ < 6,5 % (n = 30) ■ 6,5 % à 7 % (n = 17) ■ 7 % à < 8 % (n = 32) ■ 8 % à 9 % (n = 24) ■ 9 % (n = 26)
Postprandial
(période journée)
Matin
11,5
10,0
8,4
4,4
0,7
A jeun
(période nocturne)
Petit-déjeuner
13
12
11
10
9
8
7
6
5
0 2 4 6 8 10 12 14 16 18 20 22 24
0,06
0,05
Probability of Any Cardiovascular Event
0,04
0,03
0,02
0,01
0 100 200 300 400 500 600
P = 0,04 (Log-Rank Test)
P = 0,03 (Cox Proportional Model)
Placebo
Acarbose
700 800 900 1 000 1 100 1 200 1 300
Days After Rondomization
1 400
0
No. at Risk
Placebo 686 675 667 658 643 638 633 627 615 611 604 519 424 332 232
Acarbose 682 659 635 622 608 601 596 590 577 567 558 473 376 286 203
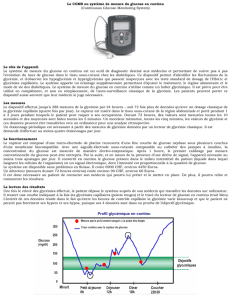
Figure 1 - Mesure de la glycémie par un système de surveillance continue, sur
24 heures, de 130 patients diabétiques de type 2. Cinq groupes selon les niveaux
d’HbA1c : 6,5 % (n = 30), 6,5 - 6,9 % (n = 17), 7 - 7,9 % (n = 32), 8 - 8,9 %, (n = 25), 9 %
(n = 26). Objectif : déterminer si la dégradation de la GAJ et celle de la GPP dépendent
de l’évolution du diabète de type 2.
Figure 2 - Effet d’un traitement par acarbose sur les risques cardiovasculaires chez des
sujets intolérants au glucose (7).
Organisation HbA1c (%) GAJ GPP
ADA-EASD < 7 … …
IDF-Europe < 6,5 5,5 mmol/l (< 1,00 g/l) 7,8 mmol/l (< 1,40 g/l)
AACE ≤ 6,5 6,1 mmol/l (< 1,10 g/l) 7,8 mmol/l (< 1,40 g/l)
Tableau 1 - Valeurs cibles de la glycémie recommandées par les
sociétés savantes.

354Diabète & Obésité • Novembre 2011 • vol. 6 • numéro 53
L’ESSENTIEL SUR…
NAVIGATOR (Nateglinide and
Valsartan in Impaired Glucose To-
lerance Outcomes Research) ini-
tiée dans les années 2000. Cette
étude prospective multicentrique,
randomisée avait pour objec-
tif de déterminer si le risque de
diabète et d’événements cardio-
vasculaires peut être diminué.
9306sujets intolérants au glucose
(HbA1c = 5,8 %, GAJ = 6,1 mmol/l,
GPP = 9,2 mmol/l) et ayant des an-
técédents cardiovasculaires ou à
haut risque cardiovasculaire ont
été inclus et traités, soit par pla-
cebo versus nateglinide (60 mg x
3/j), soit par valsartan versus pla-
cebo (plan factoriel 2 x 2). Le suivi
a duré 3,3 ans. Il n’a pas été ob-
servé de baisse de l’incidence
du diabète (critère principal),
ni du critère composite éten-
du (décès cardiovasculaire,
infarctus non fatal, AVC non
fatal, hospitalisation pour in-
susance cardiaque ou angor
instable, revascularisation ar-
térielle)
(Fig. 4)
(9).
L’ÉTUDE HEART2D
L’étude HEART2D (hyperglycemia
and its eect after acute myocar-
dial infarction on cardiovascular
outcomes in patients with type 2
diabetes mellitus), bien que discu-
table sur le plan méthodologique,
est intéressante car elle a comparé
les eets du contrôle des glycé-
mies à jeun versus les glycémies
postprandiales sur le risque d’évé-
nement cardiovasculaire chez les
diabétiques de type 2, après un in-
farctus du myocarde. Cette étude
prospective randomisée a inclus
1 115 diabétiques de type2 de 30à
75 ans, 21 jours après un infarc-
tus du myocarde, sur une durée
moyenne de 963 jours (1-1687).
Le groupe PRANDIAL (n = 557) a
été traité par un analogue rapide
de l’insuline lispro avant chaque
repas, avec un objectif glycémique
<7,5 mmol/l à 2heures. Le groupe
260
220
180
Glucose (mg/dl)
140
100
260
220
180
140
Minutes Minutes
P < 0,01
P < 0,01P < 0,001
P < 0,001
Avant
Repaglinide
Pic postprandial
Glyburide
Pic postprandial
AvantAprès Après
0 60 120 0 60 120
100
20
15
10
5
0
0
Hazard ratio, 0,94 (95 % CI, 0,82-1,09)
P = 0,43
Placebo
Nateglinide
Années de suivi
Événements
cardio-vasculaires (%)
21 3 4 5 6
0 200 400 600 800 1 000 1 200 1 400 1 600 jours
Prandial n = 557 n = 453 n = 420 n = 407 n = 393 n = 392 n = 388 n = 384
Basal n = 558 n = 464 n = 430 n = 410 n = 399 n = 386 n = 382 n = 377
BASAL (n = 558)
PRANDIAL (n = 557)
Proportion de patients n’ayant pas
eu d’événement du critère primaire
1,0
0,9
0,8
0,7
0,6
0,5
Figure 3 - Effets de la réduction de l’hyperglycémie postprandiale sur l’athérosclérose
dans le diabète de type 2 (8).
Figure 4 - Effet du nateglinide sur l’incidence du diabète et les événements cardio-
vasculaires chez des sujets intolérants au glucose (9).
Figure 5 - Effet du contrôle de la glycémie prandiale versus à jeun sur les événements
cardiovasculaires chez des sujets DT2 après un infarctus du myocarde (10).

LA GLYCÉMIE POSTPRANDIALE
Diabète & Obésité • Novembre 2011 • vol. 6 • numéro 53 355
BASAL (n = 558) a reçu de l’in-
suline NPH 2 fois par jour ou de
l’insuline glargine 1 fois par jour
avec un objectif glycémique à jeun
<6,7 mmol/l.
Le critère principal était un critère
combiné et fait d’événements car-
diovasculaires : mort cardiovascu-
laire, infarctus du myocarde non
fatal, AVC non fatal, revasculari-
sation coronaire, hospitalisation
pour un syndrome coronarien aigu.
Cette étude a été négative,
puisque le nombre de patients
ayant eu un événement n’était
pas diérent dans les deux groupes
(PRANDIAL n = 174 (31,2 %) versus
BASAL n = 181 (32,4 %))
(Fig. 5)
(10).
LES INCRÉTINES POUR
LE NOUVEAU
TRAITEMENT DE LA GPP
Il s’agit de la classe des incrétines
(inhibiteurs de la DPP-4 et analo-
gues du GLP-1). Ces molécules étant
récentes, les études d’intervention
sur la GPP et le risque cardiovascu-
laire sont encore en cours.
LES INHIBITEURS DE LA DPP-4
Ils agissent sur la GPP en préve-
nant la dégradation du GLP-1 en-
dogène sans agir sur sa sécrétion,
en augmentant la sécrétion d’in-
suline et en diminuant la sécrétion
de glucagon. Ils n’ont pas d’eet
sur la vidange gastrique. L’eet sur
la GPP a été montré avec ces molé-
cules. Par exemple, la sitagliptine
diminue la GPP de - 2,7 mmol/l
par rapport au placebo (11).
Les résultats poolés des études de
phase IIb/III avec cette molecule
montrent un délai d’apparition
plus tardif du premier événe-
ment cardiovasculaire indési-
rable majeur (MACE)
(Fig. 6)
(12).
LES ANALOGUES DU GLP-1
Ils réduisent la GPP par la conjonc-
tion de 3 mécanismes :
• l’inhibition de la production hé-
Patients à risque
Contrôle 1 251 935 860 774 545 288 144 123 102 57
Saxagliptine 3 356 2 615 2 419 2 209 1 638 994 498 436 373 197
5
4
3
2
1
0
5 24 37
Contrôle Saxagliptine
Premier événement indésirable (%)
Semaines
50 63 76 89 102 115 128
Figure 6 - Délai d’apparition du premier événement cardiovasculaire indésirable
majeur (MACE) (12).
GLP-1 plasmatique postprandial
2 h après les repas (pM)
Exenatide plasmatique
postprandial 2 h après les
repas (pM)
Figure 7 - Différences entre IDPP-4 et analogues du GLP-1 (d’après 13).
patique de glucose (par stimula-
tion de la sécrétion d’insuline et
inhibition de la sécrétion du glu-
cagon) ;
• la diminution de l’absorption
intestinale de glucose (par le ra-
lentissement de la vidange gas-
trique) ;
• l’augmentation de la captation hé-
patique de glucose (par stimulation
sitaglipline

356Diabète & Obésité • Novembre 2011 • vol. 6 • numéro 53
L’ESSENTIEL SUR…
de la sécrétion d’insuline et inhibi-
tion de la sécrétion du glucagon).
Les analogues du GLP-1 ont un
eet plus marqué sur la GPP
comparativement aux inhibi-
teurs de la DPP-4
(Fig. 7)
(13).
L’exénatide (Byetta®) semble avoir
une ecacité postprandiale supé-
rieure au liraglutide (Victoza®)
dans une étude de non-infériorité
menée sur 24 semaines
(Fig. 8)
(14).
COMMENT EXPLIQUER
LE HIATUS ENTRE
L’ÉPIDÉMIOLOGIE ET
L’INTERVENTION ?
Plusieurs explications peuvent
être apportées :
• durée insusante des études
d’intervention;
• amélioration de la prise en
charge des autres facteurs de
risque cardiovasculaire ;
• dilution de l’eet potentiel d’une
intervention sur la GPP;
• contrôle de la GPP insusant
dans les études d’intervention;
• intervention glycémique trop
tardive/risque cardiovasculaire et
maladie cardiovasculaire.
Le plus probable étant que la
GPP n’est pas seulement un fac-
teur mais aussi un marqueur
14
Glyc
é
mie (mmol/L)
Liraglutide 1,8 mg 1x/j (n = 233)
ligne de base
semaine 26
* p < 0,0001
BYETTA® 10 µg 2x/j (n = 231)
ligne de base
semaine 26
* p < 0,0001
** p = 0,0005
** p < 0,0001
** p = 0,0005
**
*
*
Déjeuner : p = NS
13
12
11
Avant petit-déjeuner
90’ après petit-déjeuner
Avant déjeuner
90’ après déjeuner
Avant dîner
90’ après dîner
Au coucher
10
9
8
7
6
0
Figure 8 - Différence sur le profil glycémique entre les 2 analogues du GLP-1 (14).
de risque cardiovasculaire et il
y a donc nécessité d’une prise
en charge globale et précoce de
tous les paramètres métabo-
liques associés à l’hyperglycé-
mie postprandiale.
CONCLUSION
Les objectifs à atteindre avec l’en-
semble de ces molécules est pos-
sible, mais il faut tenir compte du
rôle probablement favorisant des
hypoglycémies sur le risque car-
diovasculaire et des eets secon-
daires de ces molécules à manier
parfois avec précaution après un
événement cardiovasculaire aigu
(syndrome coronarien aigu, pon-
tage coronarien).
C’est la raison pour laquelle le
Groupe Coronaire et Diabète, dans
ses nouvelles recommandations
à paraître, suggère la sollicitation
d’un diabétologue par l’équipe de
cardiologie dans les jours qui sui-
vent un événement cardiovascu-
laire aigu. n
Mots clés : Diabète de type 2,
Glycémie postprandiale
1. Monnier L. Thérapeutique. In : Diabétologie. Paris : Masson, 2010 : 3-5.
2. IDF-European Guidelines. 2007.
3. Slama G. Contribution des glycémies postprandiales à l’évaluation de
l’HbA1c. Médecine des maladies métaboliques, 2007 ; 1 : 35-40.
4. Monnier L, Lapinski H, Colette C. Contributions of fasting and postpran-
dial plasma glucose increments to the overall diurnal hyperglycemia of
type 2 diabetic patients : variations with increasing levels of HbA(1c). Dia-
betes Care 2003 ; 26 : 881-5.
5. Monnier L, Colette C, Dunseath GJ, Owens DR. The loss of postprandial
glycemic control precedes stepwise deterioration of fasting with worse-
ning diabetes. Diabetes Care, 2007 ; 30 : 263-9.
6. DECODE Study Group, the European Diabetes Epidemiology Group.
Glucose tolerance and cardiovascular mortality : comparison of fasting
and 2-hour diagnostic criteria. Arch Intern Med, 2001 ; 161 : 397-405.
7. Chiasson JL, Josse RG, Gomis R et al. Acarbose treatment and the risk of
cardiovascular disease and hypertension in patients with impaired glu-
cose tolerance. The STOP-NIDDM trial. JAMA, 2003 ; 290 : 486-94.
8. Esposito K, Giugliano D, Nappo F, Marfella R. Regression of carotid athe-
rosclerosis by control of postprandial hyperglycemia in type 2 diabetes
mellitus. Circulation, 2004 ; 110 : 214-9.
9. The NAVIGATOR Study Group. Effect of nateglinide on the incidence of
diabetes and cardiovascular events. N Engl J Med, 2010 ; 362 : 1463-76.
10. Raz I, Wilson PW, Strojek K et al. Effects of prandial versus fasting gly-
cemia on cardiovascular outcomes in type 2 diabetes : the HEART2D trial.
Diabetes Care, 2009 ; 32 : 381-6.
11. Aschner P, Kipnes MS, Lunceford JK et al. Effect of the dipeptidyl pep-
tidase-4 inhibitor sitagliptin as monotherapy on glycemic control in pa-
tients with type 2 diabetes. Diabetes Care, 2006 ; 29 : 2632-7.
12. Wolf R. Poster. ADA 69th Scientific Sessions. New Orleans, LA, 2009.
13. DeFronzo RA, Okerson T, Viswanathan P et al. Effects of exenatide ver-
sus sitagliptin on postprandial glucose, insulin and glucagon secretion,
gastric emptying, and caloric intake : a randomized, cross-over study. Curr
Med Res Opin, 2008 ; 24 : 2943-52.
14. Buse JB, Rosenstock J, Sesti G et al. Liraglutide once a day versus exe-
natide twice a day for type 2 diabetes : a 26-week randomised, parallel-
group, multinational, open-label trial (LEAD-6). Lancet, 2009 ; 374 : 39-47.
BiBliographie
1
/
5
100%