File

I. Circulation placentaire
A. Placentation: vers une optimisation des échanges
B. Circulation utéro-placentaire
C. Circulation foeto-placentaire
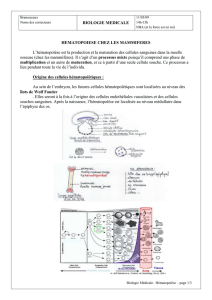
II. Hématopoïèse embryonnaire
A. Généralités
B. Les différents sites de l’hématopoïèse
1. La vésicule vitelline
2. Le foie
3. La rate
4. La moelle osseuse
C. Les différentes lignées hématopoïétiques
Physiologie - La circulation placentaire – L’hématopoïèse embryonnaire
PHYSIOLOGIE FOETO-PLACENTAIRE
PHYSIOLOGIE FOETO-PLACENTAIRE
Cours 2 - La circulation placentaire – L’hématopoïèse
embryonnaire
Pr Sophie BAUMANN
Ce document est un support de cours datant de l’année 2013-2014 disponible sur www.tsp7.net 1

Physiologie - La circulation placentaire – L’hématopoïèse embryonnaire
I. CIRCULATION PLACENTAIRE
Rappel : le placenta humain est un organe :
•Villeux : constitué de villosités placentaires ou choriales (contiennent la circulation embryonnaires ou foe-
tale et forment le placenta) ;
•Chorio-allantoïdien : organe d’échanges entre la mère et le fœtus;
•Hémochorial : le chorion, d’origine fœtale, baigne dans le sang maternel.
(Aucun contact direct entre le sang maternel et sang fœtal)
A. Optimisation des échanges
–Les villosités placentaires sont formées à partir du cytotrophoblaste, du syncytiotrophoblaste et du mésenchyme
extra-embryonnaire.
• Villosités primaires : vers le 15ème jour
•Villosités secondaires : 18ème jour
•Villosités tertiaires (ou définitives *) : 21ème jour
*Bien sur elles continuent à subir une maturation (jusqu’à la fin de la grossesse) surtout jusqu’au 4ème mois
–Maturation des villosités tertiaires :
Vers 12 SA (aménorrhée) ** Fin de grossesse
2 à 3 capillaires par villosité Augmentation du nombre de capillaires : 6 à 8 par
villosités
Mésenchyme ++ Le mésenchyme diminue
Cytotrophoblaste continu Cytotrophoblaste discontinu qui persiste en quelques
cellules isolées
Syncytiotrophoblaste + Diminution du syncytiotrophoblaste
La surface d’échange est augmentée
** Aménorrhée : absence de règles
Différences : Arborescence plus développée au ni-
veau des villosités libres, donc la surface des
échanges est augmentée, réseaux capillaire plus
développé et quasi disparition du ST, du mésen-
chyme et seul une partie du CT reste sous forme
de cellules discontinues.
Au cours des 1ères semaines de la grossesse, des
cellules cytotrophoblastiques pénètrent dans la
lumière des artères spiralées (rappel : artère de
la mère riche en oxygène et nutriments) de la ca-
duque basilaire. (elles modifient la plasticité des
artères)
Ce document est un support de cours datant de l’année 2013-2014 disponible sur www.tsp7.net 2

Physiologie - La circulation placentaire – L’hématopoïèse embryonnaire
Ces cellules détruisent et remplacent l’endothélium des vaisseaux maternels, envahissent la media, détruisant le
tissu élastique et musculaire. (augmentation de la lumière des artères diminution de leurs résistances, cela permet
donc un apport plus important au niveau du placenta)
À la fin du 1er trimestre, l’invasion artérielle atteint la jonction de la caduque basilaire avec le myomètre. Après
une pause de quelques semaines, l’invasion s’étend vers 16-18 semaines à la portion des artères spiralées du myo-
mètre et progresse jusqu’au niveau des artères radiaires. (toute la longueur des artères spiralées)
L’invasion trophoblastique modifie les propriétés élastiques des artères spiralées de l’endomètre, assurant une
vascularisation adaptée à la croissance rapide de l’unité fœto-placentaire.
Examen : Doppler avec les ultrasons : évalue la qualité de cette invasion trophoblastique. Il va apprécier la qualité du
flux sanguin dans les vaisseaux et est réalisé, le plus souvent, aux niveaux des artères utérines.
Les artères spiralées ont bien perdues toute leur élas-
ticité (le pic pour la systole est suivis par un
plateau ,diastole, et il y a une continuité entre les 2).
Artère spiralée à gardé sa tonicité souvent à cause d’une
mauvaise invasion trophoblastique (après le pic
systolique il n’y a plus pas de continuité avec la diastole).
Conséquences :
- Problème de croissance intra-utérin
- Pré-éclampsie : proteinurie maternelle, HTA, (svt
interruption de la grossesse avec une césarienne)
–Des problèmes en début de grossesse peuvent donner des problème en fin de grossesse.
B. La circulation utéro-placentaire
Autour de 12 semaines post-conception, la circulation placentaire maternelle s’établit véritablement. Le sang
maternel entre dans l’utérus via les artères utérines et les artères ovariennes, qui se divisent en artères radiées
puis en artères spiralées. Les artères spiralées apportent le sang maternel dans l’espace intervilleux du placenta.
Ce document est un support de cours datant de l’année 2013-2014 disponible sur www.tsp7.net 3

Physiologie - La circulation placentaire – L’hématopoïèse embryonnaire
(Les artères ovariennes aussi donnent des artères spiralées)
(Les artères ovariennes aussi donnent des artères spiralées). Les cotylédons sont approvisionnés par 80 à 100 ar-
tères spiralées qui percent la déciduale et irriguent les espaces intervilleux. Les espaces intervilleux contiennent en-
viron 150 ml de sang, qui est renouvelé 3 à 4 fois par minute.
! (Seuls les nombres sur le schéma sont à apprendre, et aussi le débit écrit en rouge)
(Le sang maternel va vraiment jaillir dans cet espace intervilleux où baignent les villosités choriales. Les échanges se
font au niveau des villosités flottantes et il va y avoir captation par les capillaires fœtaux d’O2 et de nutriments et re-
jet des déchets par les veines utéro-placentaires)
Ce document est un support de cours datant de l’année 2013-2014 disponible sur www.tsp7.net 4
= flottantes
Inter cotylédonaire

Physiologie - La circulation placentaire – L’hématopoïèse embryonnaire
(Il faut retenir la pression dans la chambre intervilleuse, dans les artères spiralées et dans les capillaires villosi-
taires et le débit sanguin dans la chambre intervilleuse) et surtout que la pression des capillaires villositaires est plus
important que celle de la chambre intervilleuse (sinon les échanges seraient impossibles)
Les mécanismes de brassage dans la chambre intervilleuse sont encore inconnus.
Le drainage du sang vers la circulation maternelle systémique s’effectue via des plexus veineux myométriaux or-
ganisés en un système anastomique.
Le débit sanguin utéro-placentaire représente 10 % du débit cardiaque maternel (soit 700 ml/min). Le débit san-
guin utéro-placentaire ne possède pas de mécanisme d’autorégulation (pas de vasoconstriction ni de dilatation). Il
est influencé par divers facteurs : pression artérielle maternelle, volémie maternel (par exemple : hémorragie ma-
ternelle), contraction utérine (pendant le travail, hypertonie utérine : pathologique), médicaments, toxiques
(exemple : nicotine entraînant une vasoconstriction) …
Toute chute du débit dans la circulation utérine peut entraîner une hypoxie fœtale.
C. La circulation fœto-placentaire
La circulation embryo-maternelle s’établit dès le 21-23ème jour après la fécondation. (Cœur qui bat au 21ème jour)
Chez l’embryon humain, entre les 21ème et 60ème jours de conception, les éléments mis en jeu dans la circulation
embryo-placentaire sont :
•Le réseau vasculaire des villosités placentaires,
•Les vaisseaux sanguins extra-embryonnaires (contenus dans la vésicule vitelline),
•Les vaisseaux sanguins intra-embryonnaires reliés directement au cœur primitif.
Ce document est un support de cours datant de l’année 2013-2014 disponible sur www.tsp7.net 5
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
1
/
12
100%