PDF, Job 206

COMMUNIQUÉ DE PRESSE – 20 JANVIER 2010
Inactivation du chromosome X : une nouvelle avancée dans la
compréhension les mécanismes mis en jeu
La structure de la région de l’ARN régulateur Xist, nécessaire à l’initiation de
l’inactivation du chromosome X chez les mammifères femelles, vient d’être établie.
Ces travaux sont réalisés par des chercheurs du laboratoire « ARN, RNP, structure-
fonction-maturation, Enzymologie Moléculaire et Cellulaire » (UMR7214, CNRS/UHP),
dirigé par Christiane Branlant, en collaboration avec une équipe de l’Institut Pasteur
à Paris. [publiés dans la revue PLoS Biology du 1
er
janvier 2010]
A l’exception des gamètes, les cellules des mammifères femelles contiennent deux
chromosomes X alors que celles des mâles n’en possèdent qu’un. Ces chromosomes
sexuels sont de taille très différente. Le chromosome Y qui caractérise les mâles est de
petite taille et contient beaucoup moins de gènes que le chromosome X. Afin d’éviter une
inégalité génétique et d’équilibrer le produit des gènes liés à l’X, les femelles inactivent un
de leurs chromosomes sexuels très tôt au cours du développement embryonnaire.
La chronologie de cette inactivation est désormais bien connue. Chez la souris, on sait que
le chromosome X d’origine paternelle est tout d’abord inactivé à un stade embryonnaire
très précoce (stade 4 cellules). Ce X paternel restera inactif dans les tissus extra-
embryonnaires (qui formeront le placenta et autres tissus de soutien). Quelques divisions
cellulaires plus tard, au stade 64 cellules, le X paternel est, par contre, réactivé dans toutes
les cellules qui formeront le futur embryon. S'en suit alors, une inactivation aléatoire soit du
chromosome X paternel soit du chromosome X maternel. Ce processus devient alors
irréversible et aboutit à la formation d’une mosaïque de populations cellulaires qui
expriment soit l’X d’origine maternelle soit l’X d’origine paternelle.
L’inactivation du X se traduit par l'extinction de l’expression de la quasi-totalité des 2 000
gènes portés par ce chromosome. Un locus unique, le centre d'inactivation du chromosome
X (Xic pour X inactivation center), en est à l'origine. Celui-ci gouverne la synthèse d’un ARN
régulateur appelé Xist de 17 000 nucléotides (X inactive specific transcript). Ce transcrit est
non codant c'est-à-dire non traduit en protéine. Produit en grande quantité, il finit par
tapisser entièrement le chromosome X dont il est issu, et le rend inactif en lui interdisant
l’accès de la machinerie de la transcription (voir figure). Une région particulière de l’ARN
Xist, notée région A, riche en éléments répétés et dont la séquence est fortement
conservée entre les espèces, est nécessaire pour l’initiation du processus d’extinction.
A ce jour, la structure de l’ARN Xist, et en particulier celle de la région A, sont peu connues.
Les chercheurs du Laboratoire « ARN-RNP, structure fonction-maturation, enzymologie
moléculaire et structurale » à Nancy en collaboration avec des chercheurs de l’Institut
Pasteur, ont donc réalisé la première étude structurale de l’ARN Xist. Plus précisément, ils
ont établi, par une combinaison nouvelle d'approches chimiques, biochimiques et
physicochimiques, la structure bidimensionnelle de la région A à la fois chez l’homme et la
souris. Les structures qu’ils ont établies battent en brèche les hypothèses jusque là
formulées sur le mode d'action de cette région.

Par une approche originale de recherche de partenaires protéiques, ils ont également
montré que le complexe PRC2 (Polycomb Repressive Complex 2) est recruté par la région
A de l’ARN Xist. Ce complexe protéique qui catalyse la modification post-traductionnelle
des protéines histones
1
, participe à la répression transcriptionnelle des gènes du
chromosome X. Les éléments structuraux requis pour ce recrutement ont également été
définis.
Certaines modifications des extrémités N-terminales des histones comme des
phosphorylations, des acétylations ou des méthylations entraînent des modifications de la
structure de la chromatine et en conséquence des variations de l’expression des gènes.
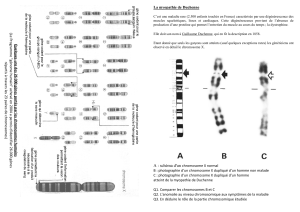
Révélation par immunofluorescence d’un chromosome X tapissé par l’ARN Xist (en vert) dans un
noyau d’une cellule femelle. © S. Maenner et al.
Définition
1
Les histones sont des protéines basiques en contact étroit avec l'ADN. Certaines modifications des extrémités N-
terminales des histones comme des phosphorylations, des acétylations ou des méthylations entraînent des
modifications de la structure de la chromatine et en conséquence des variations de l’expression des gènes.
Contacts
- Coordinateur du projet
Christiane Branlant – Laboratoire ARN-RNP I Christiane.Branlant@maem.uhp-nancy.fr I
03 83 68 43 05 I
- Presse CNRS délégation Centre-Est
service communication I Jean-François Tritz I com@dr6.cnrs.fr I 03 83 85 60 38 I 06 24 43 71 86 I
- Presse Université Henri Poincaré
service communication I Claire Bergerot I Claire.Bergerot@uhp-nancy.fr I 03 83 68 21 09
I
1
/
2
100%