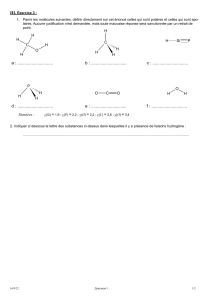
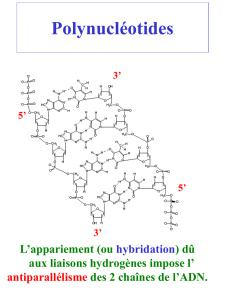
Cours biologie cellulaire Deug SV1

Cours biologie cellulaire
GLBI_102
L1, Portail Chimie,
Géosciences et PEIP
Introduction

PLAN
Voir sommaire du polycopié

La cellule: base de l’unité et de la
diversité du monde vivant (p17)
Théorie cellulaire (1838, Schleidens & Schwann)
et théorie de l’évolution (Darwin)
Toute forme vivante est faite de cellules
Toute cellule dérive d’une cellule pré-existante
Corrolaire: fin de la génération spontanée et du
créationisme.
Unité et diversité structurale
C’est un volume de cytoplasme entouré par une
membrane cytoplasmique et contenant un noyau
et différentes structures. Mais … différenciation
Unité et diversité fonctionnelle
C’est la plus petite organisation moléculaire qui
possède les propriétés du vivant: contrôle des
échanges, métabolisme, croissance et
multiplication. Mais … différenciation
La biologie cellulaire étudie l’organisation
et le fonctionnement de la cellule.

Evolution et tailles des cellules
Procaryotes Pas d’organites cellulaires, pas de noyau.
3,5 Milliards
1,5 Milliards

Formes de cellules
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
1
/
39
100%