Oxydations phosphorylantes

D- Oxydations phosphorylantes (phosphorylations oxydatives)
I- Rappels sur l'oxydoréduction
En oxydant est un composé qui a tendance a porter un ou plusieurs électrons, il se
transforme en un réducteur suivant l'équation rédox.
L'oxydant toujours a gauche.
L'agent ne peut pas réduire n'importe quel système. On a un pouvoir réducteur du couple
rédox.
On détermine le potentiel de réduction du couple rédox, il s'exprime par:
Réaction dʼoxydo-réduction : transfert dʼé- dentre 2 entités chimiques ou biochimiques : un
oxydant et un réducteur.
Lʼoxydant est lʼespèce qui capture 1 ou 2 e-.
Le réducteur est lʼespèce qui cède 1 ou 2 e-.
1
D – OXYDATIONS PHOSPHORYLANTES
(PHOSPHORYLATION OXYDATIVE)
I – Rappels préliminaires sur l’oxydo-réduction
II – Introduction
III – Organisation de la chaîne respiratoire
IV – Mécanisme de formation de l’ATP
V – Bilan énergétique
VI – Régulation
VII – Physiologie et pathologie
PRODUCTION DE L
PRODUCTION DE L’
’ENERGIE
ENERGIE
I
I –
–RAPPELS SUR L
RAPPELS SUR L’
’OXYDO
OXYDO-
-REDUCTION (1)
REDUCTION (1)
Oxydant + n e
-
réducteur
E = E
0
-
RT
nF
ln [red]
[ox]
Réaction d ’oxydo-réduction : 2 couples rédox (couple 1 est l ’oxydant)
ox1 + red 2 red1 + ox2
Un agent oxydant donné ne peut oxyder que certains systèmes
Un agent réducteur donné ne peut réduire que certains systèmes:
Potentiel de réduction:
Réaction d ’oxydo-réduction : transfert d’électrons entre 2 entités
chimiques ou biochimiques: un oxydant et un réducteur.
L’oxydant est l’espèce qui capture 1 ou 2 électrons
Le réducteur est l’espèce qui cède 1 ou 2 électrons
I
I –
–RAPPELS SUR L
RAPPELS SUR L’
’OXYDO
OXYDO-
-REDUCTION (2)
REDUCTION (2)
!
!!!E = E
1
-
E
2
=!
!!!E
0
-
RT
nF
ln [red1] [ox2]
[ox1] [red2]
( E
01
-E
02
)
Différence de potentiels de réduction :
Biochimie :
Biochimie : !
!!!
!
!!!E
E’
’
0
0
!
!!!E = !
!!!E
0’
-
RT
RT
nF ln [red1] [ox2]
[ox1] [red2]
Calcul numérique :
!
!!!E = !
!!!E
0’
-
0,06
nlog
10
[red1] [ox2]
[ox1] [red2]
La loi de Nernst relie la valeur de
La loi de Nernst relie la valeur de !
!!!
!
!!!E et celle de
E et celle de !
!!!
!
!!!G :
G :
!
!!!
!
!!!G =
G = -
-n F
n F!
!!!
!
!!!E ou
E ou !
!!!
!
!!!G
G’
’
0
0
=
= -
-n F
n F!
!!!
!
!!!E
E’
’
0
0
Les électrons vont passer du couple rédox 2 (le réducteur)
de bas potentiel standard E’
02
vers le couple rédox 1
( l’oxydant) de plus haut potentiel standard E’
01
.
!
!!!E’
0
= E’
01
-E’
02
est positif et donc !
!!!G’
0
est négatif.
I
I –
–RAPPELS SUR L
RAPPELS SUR L’
’OXYDO
OXYDO-
-REDUCTION (3)
REDUCTION (3)
Un agent oxydant donné ne peut oxyder que certains systèmes.
Un agent réducteur donné ne peut réduire que certains systèmes :
1
D – OXYDATIONS PHOSPHORYLANTES
(PHOSPHORYLATION OXYDATIVE)
I – Rappels préliminaires sur l’oxydo-réduction
II – Introduction
III – Organisation de la chaîne respiratoire
IV – Mécanisme de formation de l’ATP
V – Bilan énergétique
VI – Régulation
VII – Physiologie et pathologie
PRODUCTION DE L
PRODUCTION DE L’
’ENERGIE
ENERGIE
I
I –
–RAPPELS SUR L
RAPPELS SUR L’
’OXYDO
OXYDO-
-REDUCTION (1)
REDUCTION (1)
Oxydant + n e
-
réducteur
E = E
0
-
RT
nF
ln [red]
[ox]
Réaction d ’oxydo-réduction : 2 couples rédox (couple 1 est l ’oxydant)
ox1 + red 2 red1 + ox2
Un agent oxydant donné ne peut oxyder que certains systèmes
Un agent réducteur donné ne peut réduire que certains systèmes:
Potentiel de réduction:
Réaction d ’oxydo-réduction : transfert d’électrons entre 2 entités
chimiques ou biochimiques: un oxydant et un réducteur.
L’oxydant est l’espèce qui capture 1 ou 2 électrons
Le réducteur est l’espèce qui cède 1 ou 2 électrons
I
I –
–RAPPELS SUR L
RAPPELS SUR L’
’OXYDO
OXYDO-
-REDUCTION (2)
REDUCTION (2)
!
!!!E = E
1
-
E
2
=!
!!!E
0
-
RT
nF
ln [red1] [ox2]
[ox1] [red2]
( E
01
-E
02
)
Différence de potentiels de réduction :
Biochimie :
Biochimie : !
!!!
!
!!!E
E’
’
0
0
!
!!!E = !
!!!E
0’
-
RT
RT
nF ln [red1] [ox2]
[ox1] [red2]
Calcul numérique :
!
!!!E = !
!!!E
0’
-
0,06
nlog
10
[red1] [ox2]
[ox1] [red2]
La loi de Nernst relie la valeur de
La loi de Nernst relie la valeur de !
!!!
!
!!!E et celle de
E et celle de !
!!!
!
!!!G :
G :
!
!!!
!
!!!G =
G = -
-n F
n F!
!!!
!
!!!E ou
E ou !
!!!
!
!!!G
G’
’
0
0
=
= -
-n F
n F!
!!!
!
!!!E
E’
’
0
0
Les électrons vont passer du couple rédox 2 (le réducteur)
de bas potentiel standard E’
02
vers le couple rédox 1
( l’oxydant) de plus haut potentiel standard E’
01
.
!
!!!E’
0
= E’
01
-E’
02
est positif et donc !
!!!G’
0
est négatif.
I
I –
–RAPPELS SUR L
RAPPELS SUR L’
’OXYDO
OXYDO-
-REDUCTION (3)
REDUCTION (3)
On peut calculer la différence de potentiel de réduction delta E° = E1- E2
1
D – OXYDATIONS PHOSPHORYLANTES
(PHOSPHORYLATION OXYDATIVE)
I – Rappels préliminaires sur l’oxydo-réduction
II – Introduction
III – Organisation de la chaîne respiratoire
IV – Mécanisme de formation de l’ATP
V – Bilan énergétique
VI – Régulation
VII – Physiologie et pathologie
PRODUCTION DE L
PRODUCTION DE L’
’ENERGIE
ENERGIE
I
I –
–RAPPELS SUR L
RAPPELS SUR L’
’OXYDO
OXYDO-
-REDUCTION (1)
REDUCTION (1)
Oxydant + n e
-
réducteur
E = E
0
-
RT
nF
ln [red]
[ox]
Réaction d ’oxydo-réduction : 2 couples rédox (couple 1 est l ’oxydant)
ox1 + red 2 red1 + ox2
Un agent oxydant donné ne peut oxyder que certains systèmes
Un agent réducteur donné ne peut réduire que certains systèmes:
Potentiel de réduction:
Réaction d ’oxydo-réduction : transfert d’électrons entre 2 entités
chimiques ou biochimiques: un oxydant et un réducteur.
L’oxydant est l’espèce qui capture 1 ou 2 électrons
Le réducteur est l’espèce qui cède 1 ou 2 électrons
I
I –
–RAPPELS SUR L
RAPPELS SUR L’
’OXYDO
OXYDO-
-REDUCTION (2)
REDUCTION (2)
!
!!!E = E
1
-
E
2
=!
!!!E
0
-
RT
nF
ln [red1] [ox2]
[ox1] [red2]
( E
01
-E
02
)
Différence de potentiels de réduction :
Biochimie :
Biochimie : !
!!!
!
!!!E
E’
’
0
0
!
!!!E = !
!!!E
0’
-
RT
RT
nF ln [red1] [ox2]
[ox1] [red2]
Calcul numérique :
!
!!!E = !
!!!E
0’
-
0,06
nlog
10
[red1] [ox2]
[ox1] [red2]
La loi de Nernst relie la valeur de
La loi de Nernst relie la valeur de !
!!!
!
!!!E et celle de
E et celle de !
!!!
!
!!!G :
G :
!
!!!
!
!!!G =
G = -
-n F
n F!
!!!
!
!!!E ou
E ou !
!!!
!
!!!G
G’
’
0
0
=
= -
-n F
n F!
!!!
!
!!!E
E’
’
0
0
Les électrons vont passer du couple rédox 2 (le réducteur)
de bas potentiel standard E’
02
vers le couple rédox 1
( l’oxydant) de plus haut potentiel standard E’
01
.
!
!!!E’
0
= E’
01
-E’
02
est positif et donc !
!!!G’
0
est négatif.
I
I –
–RAPPELS SUR L
RAPPELS SUR L’
’OXYDO
OXYDO-
-REDUCTION (3)
REDUCTION (3)
En biochimie on utilise delta E'°: pH7 25°C
1
D – OXYDATIONS PHOSPHORYLANTES
(PHOSPHORYLATION OXYDATIVE)
I – Rappels préliminaires sur l’oxydo-réduction
II – Introduction
III – Organisation de la chaîne respiratoire
IV – Mécanisme de formation de l’ATP
V – Bilan énergétique
VI – Régulation
VII – Physiologie et pathologie
PRODUCTION DE L
PRODUCTION DE L’
’ENERGIE
ENERGIE
I
I –
–RAPPELS SUR L
RAPPELS SUR L’
’OXYDO
OXYDO-
-REDUCTION (1)
REDUCTION (1)
Oxydant + n e
-
réducteur
E = E
0
-
RT
nF
ln [red]
[ox]
Réaction d ’oxydo-réduction : 2 couples rédox (couple 1 est l ’oxydant)
ox1 + red 2 red1 + ox2
Un agent oxydant donné ne peut oxyder que certains systèmes
Un agent réducteur donné ne peut réduire que certains systèmes:
Potentiel de réduction:
Réaction d ’oxydo-réduction : transfert d’électrons entre 2 entités
chimiques ou biochimiques: un oxydant et un réducteur.
L’oxydant est l’espèce qui capture 1 ou 2 électrons
Le réducteur est l’espèce qui cède 1 ou 2 électrons
I
I –
–RAPPELS SUR L
RAPPELS SUR L’
’OXYDO
OXYDO-
-REDUCTION (2)
REDUCTION (2)
!
!!!E = E
1
-
E
2
=!
!!!E
0
-
RT
nF
ln [red1] [ox2]
[ox1] [red2]
( E
01
-E
02
)
Différence de potentiels de réduction :
Biochimie :
Biochimie : !
!!!
!
!!!E
E’
’
0
0
!
!!!E = !
!!!E
0’
-
RT
RT
nF ln [red1] [ox2]
[ox1] [red2]
Calcul numérique :
!
!!!E = !
!!!E
0’
-
0,06
nlog
10
[red1] [ox2]
[ox1] [red2]
La loi de Nernst relie la valeur de
La loi de Nernst relie la valeur de !
!!!
!
!!!E et celle de
E et celle de !
!!!
!
!!!G :
G :
!
!!!
!
!!!G =
G = -
-n F
n F!
!!!
!
!!!E ou
E ou !
!!!
!
!!!G
G’
’
0
0
=
= -
-n F
n F!
!!!
!
!!!E
E’
’
0
0
Les électrons vont passer du couple rédox 2 (le réducteur)
de bas potentiel standard E’
02
vers le couple rédox 1
( l’oxydant) de plus haut potentiel standard E’
01
.
!
!!!E’
0
= E’
01
-E’
02
est positif et donc !
!!!G’
0
est négatif.
I
I –
–RAPPELS SUR L
RAPPELS SUR L’
’OXYDO
OXYDO-
-REDUCTION (3)
REDUCTION (3)
1
D – OXYDATIONS PHOSPHORYLANTES
(PHOSPHORYLATION OXYDATIVE)
I – Rappels préliminaires sur l’oxydo-réduction
II – Introduction
III – Organisation de la chaîne respiratoire
IV – Mécanisme de formation de l’ATP
V – Bilan énergétique
VI – Régulation
VII – Physiologie et pathologie
PRODUCTION DE L
PRODUCTION DE L’
’ENERGIE
ENERGIE
I
I –
–RAPPELS SUR L
RAPPELS SUR L’
’OXYDO
OXYDO-
-REDUCTION (1)
REDUCTION (1)
Oxydant + n e
-
réducteur
E = E
0
-
RT
nF
ln [red]
[ox]
Réaction d ’oxydo-réduction : 2 couples rédox (couple 1 est l ’oxydant)
ox1 + red 2 red1 + ox2
Un agent oxydant donné ne peut oxyder que certains systèmes
Un agent réducteur donné ne peut réduire que certains systèmes:
Potentiel de réduction:
Réaction d ’oxydo-réduction : transfert d’électrons entre 2 entités
chimiques ou biochimiques: un oxydant et un réducteur.
L’oxydant est l’espèce qui capture 1 ou 2 électrons
Le réducteur est l’espèce qui cède 1 ou 2 électrons
I
I –
–RAPPELS SUR L
RAPPELS SUR L’
’OXYDO
OXYDO-
-REDUCTION (2)
REDUCTION (2)
!
!!!E = E
1
-
E
2
=!
!!!E
0
-
RT
nF
ln [red1] [ox2]
[ox1] [red2]
( E
01
-E
02
)
Différence de potentiels de réduction :
Biochimie :
Biochimie : !
!!!
!
!!!E
E’
’
0
0
!
!!!E = !
!!!E
0’
-
RT
RT
nF ln [red1] [ox2]
[ox1] [red2]
Calcul numérique :
!
!!!E = !
!!!E
0’
-
0,06
nlog
10
[red1] [ox2]
[ox1] [red2]
La loi de Nernst relie la valeur de
La loi de Nernst relie la valeur de !
!!!
!
!!!E et celle de
E et celle de !
!!!
!
!!!G :
G :
!
!!!
!
!!!G =
G = -
-n F
n F!
!!!
!
!!!E ou
E ou !
!!!
!
!!!G
G’
’
0
0
=
= -
-n F
n F!
!!!
!
!!!E
E’
’
0
0
Les électrons vont passer du couple rédox 2 (le réducteur)
de bas potentiel standard E’
02
vers le couple rédox 1
( l’oxydant) de plus haut potentiel standard E’
01
.
!
!!!E’
0
= E’
01
-E’
02
est positif et donc !
!!!G’
0
est négatif.
I
I –
–RAPPELS SUR L
RAPPELS SUR L’
’OXYDO
OXYDO-
-REDUCTION (3)
REDUCTION (3)
On peut savoir quel est celui qui va être oxydant ou réducteur.
La Loi de NERNST relie la valeur de delta E a la valeur de delta G:
1
D – OXYDATIONS PHOSPHORYLANTES
(PHOSPHORYLATION OXYDATIVE)
I – Rappels préliminaires sur l’oxydo-réduction
II – Introduction
III – Organisation de la chaîne respiratoire
IV – Mécanisme de formation de l’ATP
V – Bilan énergétique
VI – Régulation
VII – Physiologie et pathologie
PRODUCTION DE L
PRODUCTION DE L’
’ENERGIE
ENERGIE
I
I –
–RAPPELS SUR L
RAPPELS SUR L’
’OXYDO
OXYDO-
-REDUCTION (1)
REDUCTION (1)
Oxydant + n e
-
réducteur
E = E
0
-
RT
nF
ln [red]
[ox]
Réaction d ’oxydo-réduction : 2 couples rédox (couple 1 est l ’oxydant)
ox1 + red 2 red1 + ox2
Un agent oxydant donné ne peut oxyder que certains systèmes
Un agent réducteur donné ne peut réduire que certains systèmes:
Potentiel de réduction:
Réaction d ’oxydo-réduction : transfert d’électrons entre 2 entités
chimiques ou biochimiques: un oxydant et un réducteur.
L’oxydant est l’espèce qui capture 1 ou 2 électrons
Le réducteur est l’espèce qui cède 1 ou 2 électrons
I
I –
–RAPPELS SUR L
RAPPELS SUR L’
’OXYDO
OXYDO-
-REDUCTION (2)
REDUCTION (2)
!
!!!E = E
1
-
E
2
=!
!!!E
0
-
RT
nF
ln [red1] [ox2]
[ox1] [red2]
( E
01
-E
02
)
Différence de potentiels de réduction :
Biochimie :
Biochimie : !
!!!
!
!!!E
E’
’
0
0
!
!!!E = !
!!!E
0’
-
RT
RT
nF ln [red1] [ox2]
[ox1] [red2]
Calcul numérique :
!
!!!E = !
!!!E
0’
-
0,06
nlog
10
[red1] [ox2]
[ox1] [red2]
La loi de Nernst relie la valeur de
La loi de Nernst relie la valeur de !
!!!
!
!!!E et celle de
E et celle de !
!!!
!
!!!G :
G :
!
!!!
!
!!!G =
G = -
-n F
n F!
!!!
!
!!!E ou
E ou !
!!!
!
!!!G
G’
’
0
0
=
= -
-n F
n F!
!!!
!
!!!E
E’
’
0
0
Les électrons vont passer du couple rédox 2 (le réducteur)
de bas potentiel standard E’
02
vers le couple rédox 1
( l’oxydant) de plus haut potentiel standard E’
01
.
!
!!!E’
0
= E’
01
-E’
02
est positif et donc !
!!!G’
0
est négatif.
I
I –
–RAPPELS SUR L
RAPPELS SUR L’
’OXYDO
OXYDO-
-REDUCTION (3)
REDUCTION (3)
Les e- vont passer du couple rédox 2 (le réducteur) de bas potentiel standard Eʼ02 vers le
couple rédox 1 (lʼoxydant) de plus haut potentiel standard Eʼ01.
Il existe une relation entre la valeur de delta G est celle de delta E.

Pour que la réaction puisse avoir lieu dans le sens considéré, il faut que delta G°' soit
négatif, donc delta E'° POSITIF.
1
D – OXYDATIONS PHOSPHORYLANTES
(PHOSPHORYLATION OXYDATIVE)
I – Rappels préliminaires sur l’oxydo-réduction
II – Introduction
III – Organisation de la chaîne respiratoire
IV – Mécanisme de formation de l’ATP
V – Bilan énergétique
VI – Régulation
VII – Physiologie et pathologie
PRODUCTION DE L
PRODUCTION DE L’
’ENERGIE
ENERGIE
I
I –
–RAPPELS SUR L
RAPPELS SUR L’
’OXYDO
OXYDO-
-REDUCTION (1)
REDUCTION (1)
Oxydant + n e
-
réducteur
E = E
0
-
RT
nF
ln [red]
[ox]
Réaction d ’oxydo-réduction : 2 couples rédox (couple 1 est l ’oxydant)
ox1 + red 2 red1 + ox2
Un agent oxydant donné ne peut oxyder que certains systèmes
Un agent réducteur donné ne peut réduire que certains systèmes:
Potentiel de réduction:
Réaction d ’oxydo-réduction : transfert d’électrons entre 2 entités
chimiques ou biochimiques: un oxydant et un réducteur.
L’oxydant est l’espèce qui capture 1 ou 2 électrons
Le réducteur est l’espèce qui cède 1 ou 2 électrons
I
I –
–RAPPELS SUR L
RAPPELS SUR L’
’OXYDO
OXYDO-
-REDUCTION (2)
REDUCTION (2)
!
!!!E = E
1
-
E
2
=!
!!!E
0
-
RT
nF
ln [red1] [ox2]
[ox1] [red2]
( E
01
-E
02
)
Différence de potentiels de réduction :
Biochimie :
Biochimie : !
!!!
!
!!!E
E’
’
0
0
!
!!!E = !
!!!E
0’
-
RT
RT
nF ln [red1] [ox2]
[ox1] [red2]
Calcul numérique :
!
!!!E = !
!!!E
0’
-
0,06
nlog
10
[red1] [ox2]
[ox1] [red2]
La loi de Nernst relie la valeur de
La loi de Nernst relie la valeur de !
!!!
!
!!!E et celle de
E et celle de !
!!!
!
!!!G :
G :
!
!!!
!
!!!G =
G = -
-n F
n F!
!!!
!
!!!E ou
E ou !
!!!
!
!!!G
G’
’
0
0
=
= -
-n F
n F!
!!!
!
!!!E
E’
’
0
0
Les électrons vont passer du couple rédox 2 (le réducteur)
de bas potentiel standard E’
02
vers le couple rédox 1
( l’oxydant) de plus haut potentiel standard E’
01
.
!
!!!E’
0
= E’
01
-E’
02
est positif et donc !
!!!G’
0
est négatif.
I
I –
–RAPPELS SUR L
RAPPELS SUR L’
’OXYDO
OXYDO-
-REDUCTION (3)
REDUCTION (3)
2
Potentiels de r
Potentiels de ré
éduction standard des transporteurs d
duction standard des transporteurs d’é
’électrons
lectrons
impliqu
impliqué
és dans la cha
s dans la chaî
îne respiratoire
ne respiratoire
Réaction redox (demi-réaction) E’
0
(V)
2H++ 2e-H2-0,41
NAD++ H++ 2e-NADH - 0,32
NADH déshydrogénase (FMN) + 2H++ 2 e-
NADH déshydrogénase (FMN H2) - 0,30
Ubiquinone + 2H++ 2e-ubiquinol 0,04
Cytochrome b (Fe
3+
) + e-cytochrome b (Fe
2+
) 0,08
Cytochrome c
1
(Fe
3+
) + e-cytochrome c
1
(Fe
2+
) 0,22
Cytochrome c (Fe
3+
) + e-cytochrome c (Fe
2+
) 0,25
Cytochrome a (Fe
3+
) + e-cytochrome a (Fe
2+
) 0,29
Cytochrome a
3
(Fe
3+
) + e-cytochrome a
3
(Fe
2+
)0,55
1
O
2
+ 2H
+
+ 2e
-
H
2
O0,82
2
I
III
IV
II
II -
-INTRODUCTION
INTRODUCTION
Les mitochondries sont le lieu essentiel de la production
d’énergie chimique qui est stockée sous forme d’ATP:
elles consomment plus de 90% de l’oxygène utilisée par la cellule.
Les oxydations cellulaires impliquent majoritairement
des deshydrogénations où l’énergie chimique est conservée
sous forme de coenzymes réduits:
AH
2
+ FAD A + FADH
2
(lié à son apoenzyme)
BH
2
+ NAD
+
B + NADH + H
+
(coenzyme mobile)
Le transfert d’électrons se fait sous la forme:
2 H
+
+ 2 e
-
ou H
-
+ H
+
: Équivalents réducteurs
La chaîne respiratoire est formée de catalyseurs en ligne
qui transportent les électrons jusqu’à O
2
pour former H
2
O.
Cette suite de réactions d’oxydation est couplée à la
formation d’ATP: « Oxydations phosphorylantes ».
MME
MME
MMI
MMI
- complexes I à IV
- ATP synthase
- Translocases
Matrice mitochondriale
Matrice mitochondriale
- pyruvate deshydrogénase
- enzymes du cycle de Krebs
- enzymes de la !
!!!-oxydation
EIM
EIM
Canaux de
Canaux de porine
porine
MITOCHONDRIE ET COMPLEXES ENZYMATIQUES
MITOCHONDRIE ET COMPLEXES ENZYMATIQUES III
III -
-ORGANISATION DE LA CHAINE
ORGANISATION DE LA CHAINE
Succession de complexes multiprotéiques:
dont les sous-unités dépendent du génome nucléaire (64)
et du génome mitochondrial (13)
-protéines fonctionnant avec le coenzyme soluble NAD
+
-flavoprotéines: coenzymes FMN ou FAD
-
cytochromes : protéines à fer héminique
-protéines fer-soufre : fer non héminiqueliéàdes S de CYS
-un transporteur non protéique, l’ubiquinoneou coenzyme Q
En condition standard de chimie pour le couple H+/H2 on aurait 0.
Lʼoxydant est le composé qui va avoir le potentiel de réduction standard le plus élevé
(0,82).
II- Introduction
Cette cellule a pu vivre en aérobiose par rapport aux cellules primitives qui vivaient en
anaérobiose.
Les mitochondries sont le lieu essentiel de la production d'énergie chimique qui est
stockée sous forme d'ATP : elles consomment plus de 90% de l'oxygène utilisé par la
cellule.
- Les oxydations cellulaire impliquent majoritairement des déshydrogénations où l'énergie
chimique est conservée sous forme de coenzyme réduits.
2
Potentiels de r
Potentiels de ré
éduction standard des transporteurs d
duction standard des transporteurs d’é
’électrons
lectrons
impliqu
impliqué
és dans la cha
s dans la chaî
îne respiratoire
ne respiratoire
Réaction redox (demi-réaction) E’
0
(V)
2H++ 2e-H2-0,41
NAD++ H++ 2e-NADH - 0,32
NADH déshydrogénase (FMN) + 2H++ 2 e-
NADH déshydrogénase (FMN H2) - 0,30
Ubiquinone + 2H++ 2e-ubiquinol 0,04
Cytochrome b (Fe
3+
) + e-cytochrome b (Fe
2+
) 0,08
Cytochrome c
1
(Fe
3+
) + e-cytochrome c
1
(Fe
2+
) 0,22
Cytochrome c (Fe
3+
) + e-cytochrome c (Fe
2+
) 0,25
Cytochrome a (Fe
3+
) + e-cytochrome a (Fe
2+
) 0,29
Cytochrome a
3
(Fe
3+
) + e-cytochrome a
3
(Fe
2+
)0,55
1
O
2
+ 2H
+
+ 2e
-
H
2
O0,82
2
I
III
IV
II
II -
-INTRODUCTION
INTRODUCTION
Les mitochondries sont le lieu essentiel de la production
d’énergie chimique qui est stockée sous forme d’ATP:
elles consomment plus de 90% de l’oxygène utilisée par la cellule.
Les oxydations cellulaires impliquent majoritairement
des deshydrogénations où l’énergie chimique est conservée
sous forme de coenzymes réduits:
AH
2
+ FAD A + FADH
2
(lié à son apoenzyme)
BH
2
+ NAD
+
B + NADH + H
+
(coenzyme mobile)
Le transfert d’électrons se fait sous la forme:
2 H
+
+ 2 e
-
ou H
-
+ H
+
: Équivalents réducteurs
La chaîne respiratoire est formée de catalyseurs en ligne
qui transportent les électrons jusqu’à O
2
pour former H
2
O.
Cette suite de réactions d’oxydation est couplée à la
formation d’ATP: « Oxydations phosphorylantes ».
MME
MME
MMI
MMI
- complexes I à IV
- ATP synthase
- Translocases
Matrice mitochondriale
Matrice mitochondriale
- pyruvate deshydrogénase
- enzymes du cycle de Krebs
- enzymes de la !
!!!-oxydation
EIM
EIM
Canaux de
Canaux de porine
porine
MITOCHONDRIE ET COMPLEXES ENZYMATIQUES
MITOCHONDRIE ET COMPLEXES ENZYMATIQUES III
III -
-ORGANISATION DE LA CHAINE
ORGANISATION DE LA CHAINE
Succession de complexes multiprotéiques:
dont les sous-unités dépendent du génome nucléaire (64)
et du génome mitochondrial (13)
-protéines fonctionnant avec le coenzyme soluble NAD
+
-flavoprotéines: coenzymes FMN ou FAD
-
cytochromes : protéines à fer héminique
-protéines fer-soufre : fer non héminiqueliéàdes S de CYS
-un transporteur non protéique, l’ubiquinoneou coenzyme Q
"
Ces deux équations fournissent les e- à la chaine respiratoire.
Le transfert d'électrons se fait sous la forme :
2
Potentiels de r
Potentiels de ré
éduction standard des transporteurs d
duction standard des transporteurs d’é
’électrons
lectrons
impliqu
impliqué
és dans la cha
s dans la chaî
îne respiratoire
ne respiratoire
Réaction redox (demi-réaction) E’
0
(V)
2H++ 2e-H2-0,41
NAD++ H++ 2e-NADH - 0,32
NADH déshydrogénase (FMN) + 2H++ 2 e-
NADH déshydrogénase (FMN H2) - 0,30
Ubiquinone + 2H++ 2e-ubiquinol 0,04
Cytochrome b (Fe
3+
) + e-cytochrome b (Fe
2+
) 0,08
Cytochrome c
1
(Fe
3+
) + e-cytochrome c
1
(Fe
2+
) 0,22
Cytochrome c (Fe
3+
) + e-cytochrome c (Fe
2+
) 0,25
Cytochrome a (Fe
3+
) + e-cytochrome a (Fe
2+
) 0,29
Cytochrome a
3
(Fe
3+
) + e-cytochrome a
3
(Fe
2+
)0,55
1
O
2
+ 2H
+
+ 2e
-
H
2
O0,82
2
I
III
IV
II
II -
-INTRODUCTION
INTRODUCTION
Les mitochondries sont le lieu essentiel de la production
d’énergie chimique qui est stockée sous forme d’ATP:
elles consomment plus de 90% de l’oxygène utilisée par la cellule.
Les oxydations cellulaires impliquent majoritairement
des deshydrogénations où l’énergie chimique est conservée
sous forme de coenzymes réduits:
AH
2
+ FAD A + FADH
2
(lié à son apoenzyme)
BH
2
+ NAD
+
B + NADH + H
+
(coenzyme mobile)
Le transfert d’électrons se fait sous la forme:
2 H
+
+ 2 e
-
ou H
-
+ H
+
: Équivalents réducteurs
La chaîne respiratoire est formée de catalyseurs en ligne
qui transportent les électrons jusqu’à O
2
pour former H
2
O.
Cette suite de réactions d’oxydation est couplée à la
formation d’ATP: « Oxydations phosphorylantes ».
MME
MME
MMI
MMI
- complexes I à IV
- ATP synthase
- Translocases
Matrice mitochondriale
Matrice mitochondriale
- pyruvate deshydrogénase
- enzymes du cycle de Krebs
- enzymes de la !
!!!-oxydation
EIM
EIM
Canaux de
Canaux de porine
porine
MITOCHONDRIE ET COMPLEXES ENZYMATIQUES
MITOCHONDRIE ET COMPLEXES ENZYMATIQUES III
III -
-ORGANISATION DE LA CHAINE
ORGANISATION DE LA CHAINE
Succession de complexes multiprotéiques:
dont les sous-unités dépendent du génome nucléaire (64)
et du génome mitochondrial (13)
-protéines fonctionnant avec le coenzyme soluble NAD
+
-flavoprotéines: coenzymes FMN ou FAD
-
cytochromes : protéines à fer héminique
-protéines fer-soufre : fer non héminiqueliéàdes S de CYS
-un transporteur non protéique, l’ubiquinoneou coenzyme Q
- La chaine respiratoire est formée de catalyseurs en ligne qui transportent les électrons
jusqu'à O2, pour former H2O. Cette suite de réaction d'oxydation est couplée à la
formation d'ATP à partir dʼune molécule dʼADP et dʼun phosphate «#oxydations
phosphorylantes.#»
Suite de complexes protéiques qui sont des catalyseurs qui vont transportés les électrons
jusquʼà lʼoxygène moléculaire pour former de lʼeau. En effet NAD ne réagit pas
directement avec lʼoxygène.

Mitochondrie et complexe enzymatique
2
Potentiels de r
Potentiels de ré
éduction standard des transporteurs d
duction standard des transporteurs d’é
’électrons
lectrons
impliqu
impliqué
és dans la cha
s dans la chaî
îne respiratoire
ne respiratoire
Réaction redox (demi-réaction) E’
0
(V)
2H++ 2e-H2-0,41
NAD++ H++ 2e-NADH - 0,32
NADH déshydrogénase (FMN) + 2H++ 2 e-
NADH déshydrogénase (FMN H2) - 0,30
Ubiquinone + 2H++ 2e-ubiquinol 0,04
Cytochrome b (Fe
3+
) + e-cytochrome b (Fe
2+
) 0,08
Cytochrome c
1
(Fe
3+
) + e-cytochrome c
1
(Fe
2+
) 0,22
Cytochrome c (Fe
3+
) + e-cytochrome c (Fe
2+
) 0,25
Cytochrome a (Fe
3+
) + e-cytochrome a (Fe
2+
) 0,29
Cytochrome a
3
(Fe
3+
) + e-cytochrome a
3
(Fe
2+
)0,55
1
O
2
+ 2H
+
+ 2e
-
H
2
O0,82
2
I
III
IV
II
II -
-INTRODUCTION
INTRODUCTION
Les mitochondries sont le lieu essentiel de la production
d’énergie chimique qui est stockée sous forme d’ATP:
elles consomment plus de 90% de l’oxygène utilisée par la cellule.
Les oxydations cellulaires impliquent majoritairement
des deshydrogénations où l’énergie chimique est conservée
sous forme de coenzymes réduits:
AH
2
+ FAD A + FADH
2
(lié à son apoenzyme)
BH
2
+ NAD
+
B + NADH + H
+
(coenzyme mobile)
Le transfert d’électrons se fait sous la forme:
2 H
+
+ 2 e
-
ou H
-
+ H
+
: Équivalents réducteurs
La chaîne respiratoire est formée de catalyseurs en ligne
qui transportent les électrons jusqu’à O
2
pour former H
2
O.
Cette suite de réactions d’oxydation est couplée à la
formation d’ATP: « Oxydations phosphorylantes ».
MME
MME
MMI
MMI
- complexes I à IV
- ATP synthase
- Translocases
Matrice mitochondriale
Matrice mitochondriale
- pyruvate deshydrogénase
- enzymes du cycle de Krebs
- enzymes de la !
!!!-oxydation
EIM
EIM
Canaux de
Canaux de porine
porine
MITOCHONDRIE ET COMPLEXES ENZYMATIQUES
MITOCHONDRIE ET COMPLEXES ENZYMATIQUES III
III -
-ORGANISATION DE LA CHAINE
ORGANISATION DE LA CHAINE
Succession de complexes multiprotéiques:
dont les sous-unités dépendent du génome nucléaire (64)
et du génome mitochondrial (13)
-protéines fonctionnant avec le coenzyme soluble NAD
+
-flavoprotéines: coenzymes FMN ou FAD
-
cytochromes : protéines à fer héminique
-protéines fer-soufre : fer non héminiqueliéàdes S de CYS
-un transporteur non protéique, l’ubiquinoneou coenzyme Q
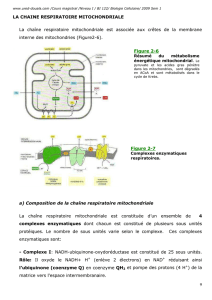
Elle est formée d'une membrane mitochondriale externe, interne et d'une matrice.
MME: perméable aux ions et aux petites molécules avec présence de petits canaux: des
porines. (poreuses aux ions et aux petites molécules)
MMI: imperméables aux ions et en particulier au H+ . nécessité d'un transport actif pour
ces différents composés.
Les deux membranes sont séparés par un espace intermembranaire.
MMI reçoit les différents complexes de la chaines respiratoire (I a IV), de complexe de
l'ATP synthase (V) et des translocases.
On a également une matrice mitochondriale dans laquelle on retrouve la pyruvate
deshydrogénase, les enzymes du cycle de krebs et des enzymes de la béta oxydation.
Les mitochondries sont le générateur de la cellules car cʼest au niveau de la mitochondrie
que la plus grande partie dʼénergie va etre emmagasinée, provenant des oxydations
cellulaires. (des désydrogénations : lʼénergie est conservée sous forme de coenzymes
réduits)
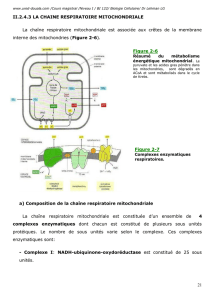
III- Organisation de la chaine respiratoire
"
Succession de complexes multiprotéiques dont les sous unités dépendent du génome
nucléaire (64) et du génome mitochondrial (13)
Ces différents complexes sont :
- protéines qui fonctionnent avec le NAD+ (coenzyme soluble, mobile)
- flavoprotéines : coenzymes flaviniques : FMN ou FAD
- cytochromes : protéines à fer héminique (fer sous forme Fe2+ ou Fe3+)
- protéines fer-soufre: fer non héminique lié au soufre.
3
III
III -
-ORGANISATION DE LA CHAINE
ORGANISATION DE LA CHAINE
Succession de complexes multiprotéiques:
-protéines àcoenzyme NAD
+
-flavoprotéines: coenzymes FMN ou FAD
-cytochromes : protéines àfer héminique
-protéines fer-soufre : fer non héminiqueliéàdes S
Cys–S
Cys S
Fe
Fe
S–Cys
S
Cys
Exemple:
Exemple:
III
III -
-ORGANISATION DE LA CHAINE
ORGANISATION DE LA CHAINE
Succession de complexes multiprotéiques:
-protéines àcoenzyme NAD
+
-flavoprotéines: coenzymes FMN ou FAD
-cytochromes : protéines àfer héminique
-protéines fer-soufre : fer non héminiqueliéàdes S
-un transporteur non protéique, l’ubiquinone/ubiquinol
ou coenzyme Q (voir cours coenzymes)
Groupes transporteurs d
Groupes transporteurs d ’é
’électrons
lectrons
1°- Complexe I (47 sous-unités): NADH
NADH deshydrog
deshydrogé
énase
nase
-plusieurs protéines Fe–S
-1 flavoprotéineàFMN : FP1
L’accepteur est l’ubiquinone
R
Ré
éaction simple :
action simple :
red2 ox1 ox2 re
red2 ox1 ox2 red1
d1
ubiquinone
ubiquinone ubiquinol
ubiquinol
La réaction de transfert d’é est couplée au transfert de 4 protons
de la matrice (N) vers l ’EIM (P):
NADH + H
+
+ UQ NAD
+
+ UQH
2
Nouvelle r
Nouvelle ré
éaction exprimant ce transfert :
action exprimant ce transfert :
+
NADH + 5 H
Ma
+ UQ NAD
+
+ UQH
2
+ 4 H
+
Cy
+
!
!!!E’
0
= E’
0
1
-E’
0
2
= 0,04 - (- 0,32) = + 0,36 V
!
!!!G’
0
= -nF!
!!!E’
0
= - 69 kJ/mol
4 H
4 H
+
+
Glycérol-3-
Phosphate
( du cytosol)
FAD
Espace
Espace
Intermembranaire
Intermembranaire
Glycérol-3-P
deshydrogénase
Fe–S
(FAD)
ETFP
(FAD)
FAD
Acyl-CoA
Acyl-CoA
déshydrogénase
Matrice
Matrice
Fe–S
FMN
CI
CII
FAD
Fe–S
Succinate Fumarate
NAD+
NADH
+ H+
MMI
MMI
UQ
UQ
- un transporteur non protéique, l'ubiquinone ou coenzyme Q.

ubiquinone: état oxydé
ubiquinol: état réduit
Groupes transporteurs d'électrons (complexes qui fonctionnent les uns après les autres).
Il existe différents complexes :
1- Complexe 1
NADH deshydrogénase: il récupère les équivalents réducteurs a partir du NADH. Il
possède 47 sous unités.
Ce complexe comporte par exemple plusieurs protéines fer-soufre et une flavoprotéines à
FMN (FP1), et énormément d'autres sous unités.
L'accepteur est l'ubiquinone,les équivalents réducteurs passent sur l'ubicuinone.
3
III
III -
-ORGANISATION DE LA CHAINE
ORGANISATION DE LA CHAINE
Succession de complexes multiprotéiques:
-protéines àcoenzyme NAD
+
-flavoprotéines: coenzymes FMN ou FAD
-cytochromes : protéines àfer héminique
-protéines fer-soufre : fer non héminiqueliéàdes S
Cys–S
Cys S
Fe
Fe
S–Cys
S
Cys
Exemple:
Exemple:
III
III -
-ORGANISATION DE LA CHAINE
ORGANISATION DE LA CHAINE
Succession de complexes multiprotéiques:
-protéines àcoenzyme NAD
+
-flavoprotéines: coenzymes FMN ou FAD
-cytochromes : protéines àfer héminique
-protéines fer-soufre : fer non héminiqueliéàdes S
-un transporteur non protéique, l’ubiquinone/ubiquinol
ou coenzyme Q (voir cours coenzymes)
Groupes transporteurs d
Groupes transporteurs d ’é
’électrons
lectrons
1°- Complexe I (47 sous-unités): NADH
NADH deshydrog
deshydrogé
énase
nase
-plusieurs protéines Fe–S
-1 flavoprotéineàFMN : FP1
L’accepteur est l’ubiquinone
R
Ré
éaction simple :
action simple :
red2 ox1 ox2 re
red2 ox1 ox2 red1
d1
ubiquinone
ubiquinone ubiquinol
ubiquinol
La réaction de transfert d’é est couplée au transfert de 4 protons
de la matrice (N) vers l ’EIM (P):
NADH + H
+
+ UQ NAD
+
+ UQH
2
Nouvelle r
Nouvelle ré
éaction exprimant ce transfert :
action exprimant ce transfert :
+
NADH + 5 H
Ma
+ UQ NAD
+
+ UQH
2
+ 4 H
+
Cy
+
!
!!!E’
0
= E’
0
1
-E’
0
2
= 0,04 - (- 0,32) = + 0,36 V
!
!!!G’
0
= -nF!
!!!E’
0
= - 69 kJ/mol
4 H
4 H
+
+
Glycérol-3-
Phosphate
( du cytosol)
FAD
Espace
Espace
Intermembranaire
Intermembranaire
Glycérol-3-P
deshydrogénase
Fe–S
(FAD)
ETFP
(FAD)
FAD
Acyl-CoA
Acyl-CoA
déshydrogénase
Matrice
Matrice
Fe–S
FMN
CI
CII
FAD
Fe–S
Succinate Fumarate
NAD+
NADH
+ H+
MMI
MMI
UQ
UQ
Ox 1= ubiquinone reçoit les électrons
red 2 = NADH.
Transfert des H+ et des électrons sur l'ubiquinone.
Le transfert des électrons se fait dans le sens du NADH.
Delta E'° = + 0,36 V.
On a une variation de delta G°', très forte, négative (réaction exergonique).
La réaction de transfert des électrons est couplés au transfert de 4 protons de la matrice
vers l'espace intermembranaire (positivement) et négativement du coté de la matrice.
Nouvelle réaction exprimant ce transfert:
3
III
III -
-ORGANISATION DE LA CHAINE
ORGANISATION DE LA CHAINE
Succession de complexes multiprotéiques:
-protéines àcoenzyme NAD
+
-flavoprotéines: coenzymes FMN ou FAD
-cytochromes : protéines àfer héminique
-protéines fer-soufre : fer non héminiqueliéàdes S
Cys–S
Cys S
Fe
Fe
S–Cys
S
Cys
Exemple:
Exemple:
III
III -
-ORGANISATION DE LA CHAINE
ORGANISATION DE LA CHAINE
Succession de complexes multiprotéiques:
-protéines àcoenzyme NAD
+
-flavoprotéines: coenzymes FMN ou FAD
-cytochromes : protéines àfer héminique
-protéines fer-soufre : fer non héminiqueliéàdes S
-un transporteur non protéique, l’ubiquinone/ubiquinol
ou coenzyme Q (voir cours coenzymes)
Groupes transporteurs d
Groupes transporteurs d ’é
’électrons
lectrons
1°- Complexe I (47 sous-unités): NADH
NADH deshydrog
deshydrogé
énase
nase
-plusieurs protéines Fe–S
-1 flavoprotéineàFMN : FP1
L’accepteur est l’ubiquinone
R
Ré
éaction simple :
action simple :
red2 ox1 ox2 re
red2 ox1 ox2 red1
d1
ubiquinone
ubiquinone ubiquinol
ubiquinol
La réaction de transfert d’é est couplée au transfert de 4 protons
de la matrice (N) vers l ’EIM (P):
NADH + H
+
+ UQ NAD
+
+ UQH
2
Nouvelle r
Nouvelle ré
éaction exprimant ce transfert :
action exprimant ce transfert :
+
NADH + 5 H
Ma
+ UQ NAD
+
+ UQH
2
+ 4 H
+
Cy
+
!
!!!E’
0
= E’
0
1
-E’
0
2
= 0,04 - (- 0,32) = + 0,36 V
!
!!!G’
0
= -nF!
!!!E’
0
= - 69 kJ/mol
4 H
4 H
+
+
Glycérol-3-
Phosphate
( du cytosol)
FAD
Espace
Espace
Intermembranaire
Intermembranaire
Glycérol-3-P
deshydrogénase
Fe–S
(FAD)
ETFP
(FAD)
FAD
Acyl-CoA
Acyl-CoA
déshydrogénase
Matrice
Matrice
Fe–S
FMN
CI
CII
FAD
Fe–S
Succinate Fumarate
NAD+
NADH
+ H+
MMI
MMI
UQ
UQ
Cette réaction est la plus importante car la transfert de protons permet la synthèse d'ATP.
Complexe 1: transfert de H+ sur FMN, puis 2 vont sur l'ubiquinone qui est un composé qui
peut bouger à l'intérieur de la membrane mitochondriale interne. Et 4H+ vont dans
l'espace intermembranaire

3
III
III -
-ORGANISATION DE LA CHAINE
ORGANISATION DE LA CHAINE
Succession de complexes multiprotéiques:
-protéines àcoenzyme NAD
+
-flavoprotéines: coenzymes FMN ou FAD
-cytochromes : protéines àfer héminique
-protéines fer-soufre : fer non héminiqueliéàdes S
Cys–S
Cys S
Fe
Fe
S–Cys
S
Cys
Exemple:
Exemple:
III
III -
-ORGANISATION DE LA CHAINE
ORGANISATION DE LA CHAINE
Succession de complexes multiprotéiques:
-protéines àcoenzyme NAD
+
-flavoprotéines: coenzymes FMN ou FAD
-cytochromes : protéines àfer héminique
-protéines fer-soufre : fer non héminiqueliéàdes S
-un transporteur non protéique, l’ubiquinone/ubiquinol
ou coenzyme Q (voir cours coenzymes)
Groupes transporteurs d
Groupes transporteurs d ’é
’électrons
lectrons
1°- Complexe I (47 sous-unités): NADH
NADH deshydrog
deshydrogé
énase
nase
-plusieurs protéines Fe–S
-1 flavoprotéineàFMN : FP1
L’accepteur est l’ubiquinone
R
Ré
éaction simple :
action simple :
red2 ox1 ox2 re
red2 ox1 ox2 red1
d1
ubiquinone
ubiquinone ubiquinol
ubiquinol
La réaction de transfert d’é est couplée au transfert de 4 protons
de la matrice (N) vers l ’EIM (P):
NADH + H
+
+ UQ NAD
+
+ UQH
2
Nouvelle r
Nouvelle ré
éaction exprimant ce transfert :
action exprimant ce transfert :
+
NADH + 5 H
Ma
+ UQ NAD
+
+ UQH
2
+ 4 H
+
Cy
+
!
!!!E’
0
= E’
0
1
-E’
0
2
= 0,04 - (- 0,32) = + 0,36 V
!
!!!G’
0
= -nF!
!!!E’
0
= - 69 kJ/mol
4 H
4 H
+
+
Glycérol-3-
Phosphate
( du cytosol)
FAD
Espace
Espace
Intermembranaire
Intermembranaire
Glycérol-3-P
deshydrogénase
Fe–S
(FAD)
ETFP
(FAD)
FAD
Acyl-CoA
Acyl-CoA
déshydrogénase
Matrice
Matrice
Fe–S
FMN
CI
CII
FAD
Fe–S
Succinate Fumarate
NAD+
NADH
+ H+
MMI
MMI
UQ
UQ
2- Complexe 2
4 sous unités
Succinate deshydrogénase : une des enzymes du cycle de Krebs.
On a comme substrat de départ le succinate.
Cette réaction couple le cycle de krebs et la chaine respiratoire
On a des protéines fer-soufre et des flavoprotéines à FAD (FP2)
Les H+ et les électrons passent sur l'ubiquinone pour donner de l'ubiquinol.
Delta G0' est relativement faible en valeur absolue, il n'y a pas de possibilité de transfert
de protons.
4
2°- Complexe II (4 sous-unités)
Succinate
Succinate deshydrog
deshydrogé
énase
nase (fait aussi partie du cycle de Krebs)
(fait aussi partie du cycle de Krebs)
-protéines Fe–S
-flavoprotéineàFAD : FP2
R
Ré
éaction :
action :
red2 ox1 ox2 red1
red2 ox1 ox2 red1
FADH
2
+ UQ FAD + UQH
2
!
!!!E’
0
= 0,04 - (- 0,06) = 0,10 V
!
!!!G’
0
= - 19 kJ/mol
*
*Deux autres systèmes enzymatiques injectent également des é
au niveau de l’ubiquinone (sans passer par CI ni CII):
-
-acyl
acyl-
-coA
coA deshydrog
deshydrogé
énase
nase
-
-glyc
glycé
érol
rol-
-3
3-
-P
P deshydrog
deshydrogé
énase
nase
FAD + succinate FADH
2
+ Fumarate
3°- Complexe III (11 sous-unités)
- protéines Fe–S
- cytochromes b et c
1
R
Ré
éaction simple :
action simple :
Ubiquinol
Ubiquinol -
-cytochrome c oxydor
cytochrome c oxydoré
éductase
ductase
UQH
2
+ 2 cyt c (Fe
3+
)UQ + 2 cyt c (Fe
2+
) + 2 H
+
Ce complexe fonctionne comme une pompe à protons :
UQ + 2 cyt c (Fe
2+
) + 4 H
+
UQH
2
+ 2 cyt c (Fe
3+
) + 2H
Ma
+
Cy
De UQH
2
au cyt c : !
!!!E’
0
= 0,25 - 0,04 = 0,21 V
!
!!!G’
0
= - 41 kJ/mol
L
L’
’accepteur est le cytochrome c
accepteur est le cytochrome c qui est mobile
qui est mobile à
àla surface
la surface
externe de la MMI
externe de la MMI
UQ
UQ
4 H
4 H
+
+
Espace
Espace
Intermembranaire
Intermembranaire
Matrice
Matrice
Mitochondriale
Mitochondriale
CI
II
Succinate
NAD+
NADH
+ H+
CIII CIV
4 H
4 H
+
+
2H
2H
+
+
Fumarate
Cyt c
1
2
O
2
+ 2 H
+
H
2
O
MMI
MMI
C
C
2e
2e-
-
4°- Complexe IV (13 sous-unités)
Cytochrome oxydase
Cytochrome oxydase
-cyta et a
3
-2 ions Cu
A
et Cu
B
cruciaux pour le transfert d’électrons
*
*2 cyt c (Fe
2+
) + 4 H
Ma
+
+
1/2 O
2
2 cyt c (Fe
3+
) + 2 H
Cy
+ H
2
O
+
-Réduction de 1/2 O
2
en H
2
O implique l’intervention de 2 électrons
-Le flux de chaque électron entraîne le mouvement d’1 proton
de la matrice vers l ’EIM : 2 H
+
Du cyt c à O
2
: !
!!!E’
0
= 0,81 - 0,25 = 0,56 V
!
!!!G’
0
= - 108 kJ/mol
Il y a d'autres systèmes enzymatique qui vont également transférer des électrons au
niveau de l'ubiquinone (sans passer par C I et C II).
- acyl-CoA deshydrogénase (fonctionne avec FAD) : béta oxydation des acides gras
- glycérol 3 phosphate deshydrogénase (fonctionne avec le FAD) : navette de transfert des
e-.
Ces systèmes vont injecter des électrons au niveau de l'ubiquinone par leur propre
système enzymatique.
L'ubiquinone reçoit des électrons du complexe I, II et a partir de différentes flavoprotéines
qui correspondent a des réactions enzymatiques qui mettent en jeu principalement des
flavoprotéines.
Le complexe 1 va sur l'ubiquinone, le complexe 2 aboutit a l'ubiquinone, et ca va vers le
complexe 3
3- Complexe 3
Ubiquinol- cytochrome c oxydoréductase : passage des e- de lʼubiquinone vers le
cytochrome c (différent du c1), il sert de transporteur.
11 sous unités.
Protéines fer-soufre et cytochrome b et C1
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
1
/
13
100%