Bancarel J. Déficit en glucose - 6 - École du Val-de

Mise au point
médecine et armées, 2010, 38, 1, 125-130 125
Déficit en glucose-6-phosphate déshydrogénase: intérêt du
dépistage systématique dans les forces armées.
La déficience en glucose-6-phosphate déshydrogénase est l’anomalie génétique la plus fréquente au monde. Considérée
comme rare en France, elle fait encourir aux porteurs un risque d’anémie aiguë par hémolyse et contre indique l’ingestion
de certains aliments ou l’utilisation de traitements médicamenteux, notamment certains antipaludéens. Quelques forces
armées pratiquent de façon systématique la recherche de cette déficience. Après un rappel historique, épidémiologique et
physiopathologique, nous exposerons l’intérêt potentiel de son dépistage pour le personnel militaire.
Mots-clés: Anémie. Hémolyse. Dépistage. Glucose-6-phosphate déshydrogénase. Paludisme.
Résumé
Glucose-6-phosphate dehydrogenase deficiency is the most common genetic defect worldwide. Considered rare in
France, it untails a risk for the carriers of an acute hemolytic anemia that contraindicates eating certain food and using
medicine including some antimalarial treatments. Some armed forces carry out a systematic screening of this deficiency.
After a historical, epidemiological, physiopathological mention, we will be discussing the interest of such a systematic
screening for military personnel.
Keywords: Anemia. Hemolysis. Malaria. Screening. Glucose-6-phosphate dehydrogenase.
Abstract
Introduction.
La déficience en glucose-6-phosphate déshydrogénase
(G6PD) est l’anomalie génétique la plus fréquente au
monde et concernerait 420 millions de personnes. Sa
découverte entraîne la nécessité de ne plus consommer
d’aliments pouvant contenir des fèves et limite
l’utilisation de médicaments aussi courants que l’aspirine,
le paracétamol, l’acide ascorbique, les fluoroquinolones,
certains sulfamides ou plus spécifiques comme les
dérivés de la quinine.
Après quelques rappels historiques, nous détail-
lerons les particularités de cette affection, leurs
implications possibles en pratique médico-militaire
et nous discuterons l’intérêt d’un dépistage systématique
pour les forces armées.
Rappels historiques.
Dès l’Antiquité, l’ingestion de fèves a été reconnue
comme responsable d’anémie et la relation entre une
anémie aiguë et la prise de certains médicaments est
établie en 1926 par Cordes (1). La primaquine, utilisée en
traitement prophylactique du paludisme lors des
opérations dans le sud-est asiatique de la Seconde Guerre
mondiale par les militaires américains, a été mise en cause
dans la survenue d’anémies aiguës chez les soldats noirs
par Hockwald en 1952 (2). Le lien entre ces anémies
« faviques » de l’antiquité et médicamenteuses est établi
par Carson (3) en 1956 avec la découverte de la déficience
en G6PD. La détermination de son caractère héréditaire et
sa transmission par le chromosome X date de 1958 (4).
Depuis, les recherches effectuées ont permis de mieux
comprendre les aspects génétiques, moléculaires et
physiopathologiques en cause.
J. BANCAREL, médecin principal, P. CAUSSE-LE-DORZE, médecin en chef,
C. TRACCARD, médecin principal.
Correspondance: J. BANCAREL, médecin adjoint chargé du personnel navigant,
service médical de la base aérienne 120, 10 rue du commandant Marzac,
CAZAUX – 33260 La teste de buch.
E-mail: [email protected]
J. Bancarel a, P. Causse-Le-Dorze a, C. Traccard a.
a
Service médical de la base aérienne 120, 10 rue du commandant Marzac, CAZAUX – 33260 La teste de Buch.
GLUCOSE-6-PHOSPHATE DEHYDROGENASE DEFICIENCY: SYSTEMATIC SCREENING INTEREST FOR ARMED FORCES.
Article reçu le 31 aout 2009, accepté le 24 novembre 2009.

La déficience en glucose-6-
phosphate déshydrogénase.
Responsable de manifestations cliniques très variées
selon la profondeur de l’atteinte génétique, l’affection
commence à bénéficier d’une meilleure connaissance
de ses mécanismes intimes. D’une répartition
géographique particulière, elle touche préférentiel-
lement l’Afrique sub-saharienne, le pourtour de la
méditerranée, le Proche- Orient, le sud-est asiatique, les
États-Unis d’Amérique, l’Amérique latine et les Antilles.
De ce fait, elle a toujours été considérée comme une
affection rare en Europe et en particulier en France (entre
120000 et 250000 déficitaires), probablement en sous
estimant l’impact des flux migratoires qui intéressent
notre pays et la fréquence de l’affection dans les
départements ou territoires d’outre-mer (5).
Aspects génétiques.
Le gène codant la G6PD est porté par le bras long du
chromosome X, en position q28. Il est localisé à proximité
de celui responsable de l’hémophilie A.
La maladie est transmise sur le mode récessif. Les
garçons hémizygotes (ont un chromosome X porteur de
l’anomalie et un chromosome Y) et les f illes homozygotes
(leurs deux chromosomes X sont porteurs de l’anomalie)
expriment totalement le déficit. Les filles hétérozygotes
présentent une forme variable, en général très modeste,
du déficit du fait de l’inactivation par lyonisation du X
déficitaire. Mécanisme décrit par Lyon en 1961 (6), il
s’agit d’un processus de compensation génique propre au
chromosome X qui aboutit à l'inactivation aléatoire de
l'un des deux chromosomes dans chacune des cellules.
Pour la majorité des gènes portés par l'X, l'expression d'un
seul allèle suffit. Le fonctionnement de cette régulation
génique n'est que partiellement compris.
La maladie touche donc essentiellement le sexe
masculin (90 %) et sa transmission se fait par le sexe
féminin en général « porteur sain ».
Plusieurs mutations du gène ont été décrites, entraînant
la production d’une protéine plus ou moins fonctionnelle.
Le séquençage moléculaire complet du gène a permis de
caractériser un grand nombre de variants associés à ce
déficit et leur expression clinique.
Aspects biochimiques et physio-
pathologiques.
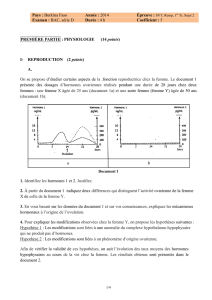
La déficience en G6PD altère le fonctionnement de
la voie des pentoses, une des quatre voies principales
du métabolisme énergétique (fig. 1). En effet, elle est
l’enzyme permettant la réduction du nicotinamide
adénine dinucléotide phosphate (NADP+) en
nicotinamide adénine dinucléotide phosphate réduit
(NADPH) par récupération d’atomes d’hydrogène du
glucose 6-phosphate qui devient 6-phosphoglucono-
lactone. Cette oxydoréduction cyclique est entretenue
grâce au retour à l’état NADP+ du NADPH par l’abandon
de son hydrogène au profit du glutathion oxydé
(GS-SG) qui devient du glutathion réduit (G-SH). Ce
mécanisme est une phase essentielle de lutte contre le
stress oxydatif cellulaire (7).
Les érythrocytes, par essence énucléés, possèdent une
quantité finie de G6PD. Ils ne peuvent ni la renouveler, ni
l’augmenter faute de matériel génétique et de production.
Selon la profondeur de l’anomalie génétique, la G6PD
érythrocytaire peut avoir une durée de vie limitée, parfois
très inférieure à la durée de vie normale de l’hématie qui
est de 120 jours. Le sujet déficitaire dispose donc d’un
126 j. bancarel
Figure 1. Aperçu du cycle des pentoses.
G6PD: Glucose-6-phosphate déshydrogénase. NADP +: nicotinamide adénine dinucléotide
phosphate. NADPH: nicotinamide adénine dinucléotide phosphate réduit. GS-SG : glutathion
oxydé. G-SH: glutathion réduit.

stock d’érythrocytes incapables de résister à un stress
oxydatif. Ce pool est d’autant plus grand que la durée
de vie de l’enzyme est courte. En présence de molécules
nocives (médicaments, vicine et covicine contenues
dans les fèves), ces érythrocytes dont le stock de G6PD
est épuisé ne pourront pas réduire le NADP+ en NADPH.
Il n’y a plus de production de glutathion réduit faute
de NAPDH, donc plus de protection cellulaire contre
le stress oxydatif.
Par ailleurs, une étude récente sur la primaquine,
connue pour être dangereuse en cas de déficience en
G6PD, vient de montrer le rôle que jouent les diverses
variantes des monooxygénases cytochromes P450
dans la survenue d’effets hématotoxiques (8). En effet,
selon le sous-type de cytochrome P450 testé, la production
de métabolites oxydants ou de méthémoglobine est
variable et une inhibition sélective de certains
cytochromes a amené une diminution significative de
la toxicité de la primaquine.
L’exploration de ces mécanismes cellulaires améliore
la compréhension du stress oxydatif, responsable de la
fragilisation membranaire de l’hématie et de l’altération
irréversible de l’hémoglobine qui va précipiter sous
forme de corps de Heinz intra érythrocytaires. La lyse
cellulaire amène à une anémie hémolytique avec son
cortège de manifestations cliniques et de complications
potentiellement mortelles.
Le dépistage est fait, en France, lors de la découverte
d’une anémie hémolytique. Dans un certain nombre de
pays où la prévalence de l’affection est bien plus
importante, un dépistage systématique néonatal est
pratiqué. Le « fluorescent spot test » est utilisé le plus
fréquemment en raison de son faible coût. Il consiste
en un prélèvement de sang sur un papier absorbant,
auquel on adjoint du Glucose-6-Phosphate et du
NADP. La production de NADPH sera visible après
incubation en produisant une fluorescence à l’examen
avec une lampe ultra-violette.
La méthode de référence est la mesure spectro-
photométrique de l’activité enzymatique et elle est
pratiquée en cas de positivité du « spot test ».
Manifestations cliniques.
Elles sont intimement liées à la mutation en cause.
Actuellement près de cent vingt mutations ayant
une expression clinique sont répertoriées et portent le
nom du lieu où elles ont été mises en évidence.
L’Organisation mondiale de la santé (OMS) (7) préfère à
ce catalogue une classification prenant en compte
l’activité enzymatique et l’intensité des manifestations
cliniques associées (tab. I).
Il est possible de découvrir la déficience en G6PD au
cours d’un accident hémolytique lié à une substance
oxydative, sans avoir jamais eu de manifestation clinique
préalable. En raison du polymorphisme de l’affection, la
réaction d’un sujet en contact avec une substance donnée
n’est pas prédictible. Il est donc important, dès que le
diagnostic a été porté, de respecter scrupuleusement les
consignes de non exposition aux molécules à risque.
L’Agence française de sécurité sanitaire des produits de
santé publie un document complet de 65 pages référençant
l’ensemble des substances pharmacologiques
susceptibles d’interagir avec la déficience en G6PD (9).
Ce document doit servir de base documentaire à tout
médecin confronté à un patient porteur de l’anomalie.
La liste exhaustive des substances à éviter contient
plus d’une quarantaine de médicaments dangereux.
Elle comprend l’aspirine ou le paracétamol à doses
supra-thérapeutiques (tab. II). Ce tableau est à compléter
par la liste des substances actives pour lesquelles les
centres régionaux de pharmacovigilance mentionnent
une précaution d’emploi ou une contre-indication mais
dont l’évaluation a montré qu’il n’existait pas de risque
identifié d’hémolyse chez les sujets déficitaires en G6PD
(10). Il ne faut pas oublier d’y ajouter la primaquine, en
partie grâce à laquelle des avancées significatives ont pu
se faire dans la connaissance du déficit en G6PD, qui est
curieusement absente de cette liste.
Problématique médico-militaire.
Dans certaines armées, et notamment celles des États-
Unis d’Amérique, le dépistage est systématique à
l’engagement dans la Navy et l’Air force, au titre de
l’active ou de la réserve (11). Lors d’un déploiement en
zone impaludée, chaque militaire déficient en G6PD est
porteur d’un document alertant « G6PD deficient : no
primaquine ». En outre, le détachement permanent de
l’armée de l’Air de la République de Singapour dont le
service médical de la base aérienne de Cazaux assure le
soutien applique les mêmes directives pour son personnel
(12). Chaque dossier médical est porteur en couverture de
la mention « G6PD present » ou « G6PD deficient », à
l’encre rouge, au même titre que les allergies connues.
127
déficit en glucose-6-phosphate déshydrogénase : intérêt du dépistage systématique dans les forces armées
Type Intensité
du déficit
Activité
enzymatique
Expression
clinique
Variants
G6PD
fréquents
Classe I sévère
<10% de
l’activité
normale
Hémolyse
chronique rare
Classe II sévère
<10% de
l’activité
normale
Hémolyse
intermittente
G6PD B ou
« méditerranéen »
Mahidol; Canton
Classe III modéré
10 % à 60 %
de l’activité
normale
Hémolyse
suite à un
stress
oxydatif.
G6PD A
Classe IV pas de
déficit
60 % à 150 %
de l’activité
normale
-G6PD B;
G6PD A
Classe V activité
accrue
> 150 % de
l’activité
normale
- rare
Tableau I. Classification OMS des variants enzymatiques de la G6PD en cinq
classes, dont trois déficitaires.

Déficience en G6PD et paludisme.
Il existe un lien étroit entre déficience en G6PD et
résistance au paludisme (13). En effet, l’absence de
G6PD dans les hématies est un frein au développement du
Plasmodium falciparum ce qui procure une protection
relative vis-à-vis des accès palustres graves (14). Une
phagocytose précoce des érythrocytes infectés participe
également à cette relative résistance.
Pouvant être considéré comme un aspect « bénéfique »
de l’affection, ce relatif avantage est compensé largement
par les inconvénients liés à l’impossibilité d’utiliser
dans de bonnes conditions de sécurité en opération
extérieure certains traitements prophylactiques ou
curatifs disponibles dans les armées, françaises ou
étrangères (tab. III). La primaquine n’est pas citée dans
ce tableau car elle ne figure pas sur la liste officielle de
l’Agence française de sécurité sanitaire des produits de
santé (AFSSaPS).
En France, la généralisation de la doxycycline comme
traitement prophylactique n’expose pas à un accident
en cas de déficience en G6PD. En revanche, en cas
d’accès palustre grave à Plasmodium falciparum, la
quinine reste le traitement de référence. La dotation du
Service de santé des armées (SSA) en mission extérieure
pour la prise en charge de ce type de pathologie utilise à
juste titre le QUINIMAX®, association de quinine, de
quinidine, de cinchonine et de cinchonidine. Cela signifie
que tout militaire français sur un théâtre d’opération
recevra pour le traitement d’un accès palustre grave
du QUINIMAX®sans que son statut vis-à-vis de la
déficience en G6PD soit connu.
Intérêt du dépistage systématique.
Au delà de la problématique palustre, des antibiotiques
très couramment utilisés en opérations extérieures dans
le traitement des diarrhées invasives, des infections
urinaires ou broncho-pulmonaires, ont un potentiel
hémolytique important et sont formellement contre-
indiqués en cas de déficience en G6PD.
Les situations d’isolement ou imposant des conditions
d’exercice médical parfois sommaires en opérations
sont fréquentes. Ceci implique, avec peu de moyens, de
prendre en charge efficacement ou rapidement une
128 j. bancarel
I- Les médicaments formellement contre-indiqués:
Antibiotiques et antiseptiques
Acide Nalidixique, Dapsone, Nitrofurantoine, Sulfadiazine (voie orale),
Sulfafurazol, Sulfaguanidine, Sulfaméthoxazole, Triméthoprime.
Antalgiques
Métamizole sodique, Noramidopyrine.
Anti inflammatoire
Sulfasalazine (voie orale).
Divers
Rasburicase.
II- Les médicaments nécessitant des précautions d’emploi:
Type 1: les médicaments déconseillés
(sauf situation particulière) pour lesquels des cas
d’hémolyse aiguë ont été rapportés:
Antibiotiques et antiseptiques
Ciprofloxacine (voies orale et injectable), Lévofloxacine (voies orale
et injectable), Norfloxacine (voie orale), Spiramycine, Sulfadiazine
(voie locale).
Antidiabétique oral
Glibenclamide.
Antipaludéen
Chloroquine.
Divers
Dimercaprol, Phytoménadione (= vitamine K1).
Type 2: les médicaments déconseillés
(sauf situation particulière) en raison d’appartenance
à une classe pharmacologique à risque, ou en raison
d’un risque potentiel d’hémolyse:
Antibiotiques et antiseptiques
Acide pipémidique, Enoxacine, Fluméquine, Loméfloxacine,
Moxifloxacine, Ofloxacine (voies orale et injectable), Péfloxacine (voies
orale et injectable), Sulfacétamide, Sulfadoxine, Sulfaméthizol.
Antidiabétiques oraux
Carbutamide, Glibornuride, Gliclazide, Glimépiride, Glipizide.
Antipaludéen
Quinine.
Divers
Hydroxychloroquine, Prilocaïne, Phénazone (voie locale), Quinine (dans
d’autres indications que le traitement du paludisme).
Type 3: les médicaments déconseillés à dose élevée
(c’est-à-dire supérieure à la dose usuelle journalière):
Acide Acétylsalicylique, Acide Ascorbique, Bénorilate, Carbasalate
calcique, Paracétamol.
Tableau II. Médicaments incriminés dans les accidents liés à un déficit
en G6PD.
Tableau III. Médicaments antipaludiques ayant une interaction avec le
déficit en G6PD.
Cas d’hémolyse aiguë Chloroquine
Risque potentiel d’hémolyse Quinine
Utilisation possible
avec précautions
Dihydroquinidine
Quinidine
Méfloquine
Proguanil

hémolyse induite par une thérapeutique. Cette particularité
fait poser la question de l’intérêt d’un dépistage
systématique avec inscription dans le dossier médical
réduit dans le but d’éviter une situation dangereuse.
Dans une logique globale de maîtrise des risques et de
prévention des accidents liés à l’activité militaire, dans
une démarche d’amélioration de l’équipement du
combattant et de sa protection, il paraît légitime de
s’interroger également sur des évolutions possibles en
termes de prédictibilité de certains incidents médicaux.
Le cas récent d’un patient originaire du Cantal,
hospitalisé à l’Hôpital d’instruction des armées Robert
Picqué, qui a contracté un Plasmodium vivax au cours
d’une opération extérieure, vient rappeler que le
diagnostic peut être fait lors de la recherche opportune
d’une éventuelle déficience en G6PD avant mise sous
primaquine. Il n’avait jamais eu de manifestation clinique
préexistante et son origine du centre de la France n’aurait
pas appelé l’attention.
Le développement des missions extérieures
multinationales et l’engagement des militaires français
dans des missions sous mandat international ne
permettent pas de présumer de la prise en charge d’un
militaire français par nos confrères alliés. Pour ceux-ci,
l’absence de notification d’une déficience en G6PD
pourrait être interprétée, à tort, comme un équivalent de
« G6PD présent ». Cela pose également la question de
l’harmonisation des pratiques médicales dans les
opérations interalliées, des documents médicaux
disponibles (livrets médicaux plus ou moins « réduits »…)
et des informations qu’ils contiennent : vaccinations,
allergies connues et… déficience en G6PD ?
À titre d’exemple, dans le milieu civil, depuis
février 2008, le ministère de la Santé, de la Jeunesse et des
Sports tient à la disposition des praticiens une carte
plastifiée à destination de leurs patients porteurs du
déficit (15). Elle comporte des informations pour les
professionnels de santé amenés à proposer des soins dans
le cadre de l’urgence ainsi que des données sur la
profondeur du déficit du patient: activité enzymatique,
antécédents d’hémolyse…
Alors que le coût du dépistage qualitatif par « fluorescent
spot test » est modique, celui d’un dépistage par mesure de
l’activité enzymatique par spectrophotométrie est de
10,80 euros, lorsqu’il est remboursé par la sécurité sociale
(cotation B40, comme une numération formule sanguine
avec plaquettes). Son prix de revient pour l’institution
militaire serait probablement plus faible, avec un coût
intégrant les frais de fonctionnement du laboratoire et les
réactifs, évaluée 6 euros.
Les armées qui pratiquent de façon systématique le
dépistage, plus concernées du fait d’une fréquence de
l’anomalie supérieure à celle qui est estimée pour la
France, disposent de données fiables quant à la prévalence
exacte de l’affection au sein des forces et sur l’intérêt de
pratiquer un dosage préventif. Les mesures prises en
conséquence permettent de signaler toute déficience et
cet aspect devient un critère à prendre en compte dans les
décisions de prescription thérapeutique et d’aptitude.
Même si la conjonction paludisme grave et déficit en
G6PD paraît peu probable pour un militaire français, cette
situation n’est pas à exclure.
D’après les données démographiques militaires
du rapport du Haut Comité d’évaluation de la condition
militaire de 2005 (16), nous pouvons tenter d’estimer
le nombre de militaires potentiellement porteurs de
la déficience en G6PD. Près de 350 000 personnels
militaires dont 85 % d’hommes sont en service
actuellement. Près de 50 000 d’entre eux sont projetés
chaque année en opération extérieure ou outre-mer.
En retenant la fréquence estimée en France de 0,39 %, et
en ne comptant pas le personnel féminin pour lequel
l’homozygotie ou l’hétérozygotie symptomatique
restent rares, cela conduit à penser que plus de 1 000
militaires masculins sont potentiellement porteurs
de l’anomalie. Pour mémoire, la fréquence estimée
en Martinique et Guadeloupe est de 12 % et non pas
de 0,39 % (5).
Par ailleurs, on ne peut pas ignorer que la part de la
population française qui puise ses origines dans des zones
géographiques où la déficience en G6PD est fréquente est
en augmentation. Or la population militaire est un reflet
de la population française.
La sélection des sujets relevant d’un intérêt particulier
de dépistage car pouvant être considérés comme porteurs
éventuels de l’anomalie ne peut pas se concevoir en
France sur l’appartenance à une ethnie à risque ou sur des
origines géographiques particulières.
Stratégies de dépistage.
La pratique d’un test de dépistage qualitatif faisant
appel au « fluorescent spot test » nécessite peu de moyens.
Il est facile à réaliser, nécessite une goutte de sang sur un
papier absorbant, une lampe à ultra-violet et quelques
gouttes de réactifs. Il prend environ quinze minutes et est
sensible à 98,2 % et spécifique à 97,1 % (17). Une
campagne de dépistage à grande échelle concernant
l’ensemble du personnel militaire est envisageable, y
compris dans les services médicaux d’unité, à l’occasion
de la visite systématique annuelle. Pour les nouvelles
recrues, la réalisation du test peut se faire lors de la visite
de sélection. Du fait de l’excellente sensibilité et
spécificité du « fluorescent spot test », la pratique du test
de référence avec dosage de l’activité enzymatique
pourra être réservée aux personnes ayant eu un dépistage
qualitatif positif. Il est possible d’avoir, en l’espace d’un
an, une image parfaite de la fréquence de l’affection dans
l’ensemble des forces armées avec un investissement
matériel et humain peu important.
Une alternative à la recherche systématique pour tous
les militaires, qu’applique l’United States Army, consiste
à réserver le dépistage aux militaires partant en opérations
extérieures. Cela limite encore plus l’impact financier
d’un tel dépistage, d’autant qu’il se fait une fois par
individu et que le personnel concerné appartient souvent
à des unités opérationnelles identifiées. Le nombre de
50 000 militaires français par an en opérations extérieures
est donc à pondérer dans le sens où ce contingent est
souvent constitué des mêmes personnes qui partent
plusieurs fois en mission dans la même année ou les
années suivantes. De plus, il existe vraisemblablement un
pool de personnel « mobile » fréquemment engagé en
opérations tout comme il doit exister un pool de personnel
129
déficit en glucose-6-phosphate déshydrogénase : intérêt du dépistage systématique dans les forces armées
 6
6
1
/
6
100%