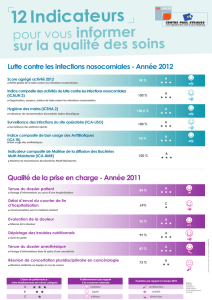
Graphique 1

UNIVERSITESIDIMOHAMMEDBENABDELLAH
FACULTEDEMEDECINEETDEPHARMACIE
FES
AnnéeThèseN°/201004010
UNIVERSITESIDIMOHAMMED
BENABDELLAH
FES
ÉPIDÉMIOLOGIEDESINFECTIONSNOSOCOMIALES
ENMILIEUDERÉANIMATION
(Aproposde147cas)
THESE
PRESENTEEETSOUTENUEPUBLIQUEMENTLE15/03/2010
PAR
Néele15Octobre1983àMeknès
Mlle.QASSIMILOUBNA
POURL'OBTENTIONDUDOCTORATENMEDECINE
MOTS-CLES:
Épidémiologie-Infection-Réanimation
JURY
M. Professeur
.KHATOUFMOHAMMED
Professeur
.HARANDOUMUSTAPHA
Professeur
M.SBAIHICHAM
Professeur
KANJAANABIL...................................................
d’Anesthésieréanimation
M............................................
agrégéd’Anesthésieréanimation
M............................................
agrégéd’Anesthésieréanimation
...........................................
assistantd’Anesthésieréanimation
JUGE
PRESIDENTETRAPPORTEUR
MEMBREASSOCIE

1
LISTE DES ABREVIATIONS
ACD : Acidocétose Diabétique
Ac. Clavulanique : acide clavulanique
ATB : Antibiotique
AVC Accident vasculaire cerebral
BGN : Bacille à gram négatif
BPCO : Bronchopneumopathie chronique obstructive
C-CLIN : Centre de coordination de lutte contre les infections
nosocomiales
CDC :Center for diseases control
C3G : Céphalosporine de 3eme génération
CGP : Cocci à gram positif
CHU : Centre hospitalier universitaire
CLIN : Comité de lutte contre les infections nosocomiales
CMV : Cytomégalovirus
CTIN : Comité technique national des infections nosocomiales
CTIN ILS : Comité technique national des infections nosocomiales et des
infections liées aux soins
DDS : Décontamination digestive séléctive
CVC : Cathéterisme veineux central
DID : Diabéte insulino-dépendant
E.Coli :Escherichia coli
ECBU : Examen cytobactériologique des urines
Fig :Figure
HELICS :Hospital in Europe link for infection control through surveillance
H.I :Haemophilus influenza
HTA : Hypertension artérielle
ICU : Intensive care unit
IN : Infection nosocomiale
InVS : Institut na tional de veille sanitaire
INV : Infection nosocomiale virale
ISO : Infection du site opératoire
IUN : Infection urinaire nosocomiale
KES : Klebsiella enterobacter serratia
KT : Cathéter
LBA : Lavage broncho-alvéolaire
LCR : Liquide céphalorachidien
MOD : Multiple organ dysfunction
MN : Méningite nosocomiale

2
N : Nombre
NNIS : National nosocomial infection surveillance
ONEBRA : Observatoire national de l’épidémiologie de la résistance
bactérienne aux antibiotiques
P.aeruginosa : Pseudomonas aeruginosa
PI : Patient infecté
PNI : Patient non infecté
PN : Pneumopathie nosocomiale
PNAVM : Pneumopathie nosocomiale associé à la ventilation mécanique
PPO : Péritonites postopératoire
RAISIN : Réseau d’alerte d’investigation et de surveillance des infections
nosocomiales
S.A : Staphylocoque aureus
SCN : Staphylocoque à coagulase négative
SDMV : Syndrome de défaillance multiviscérale
SDRA : Syndrome de détresse respiratoire aigu
SFAR : la Société française d’anesthésie et de réanimation
SRLF :Société de réanimation de langue française
SIRS : Syndrome inflammatoire de réponse systémique
SOFA : Sepsis related organ failure assessement
SQC : Semi quantitative culture
TSU : Trimetoprime sulfaméthoxazole
VIH : Virus de l’immunodéficience humaine
VM : Ventilation mécanique

3
PLAN
INTRODUCTION .............................................................................................. 7
GENERALITES ...................................................................................................... 10
I-HISTORIQUE ................................................................................................. 11
II-DEFINITION DES INFECTIONS NOSOCOMIALES (IN) ........................................ 13
III-LES DIFFFERENTS SITES D’INFECTIONS NOSOCOMIALES ................................ 13
1- Infections superficielles du site opératoire ................................................ 13
2- Infection profonde su site opératoire ........................................................ 14
3- Infection urinaire : bactériurie asymptomatique ........................................ 15
4- Infection urinaire : bactériurie symptomatique .......................................... 15
5- Bactériémie : septicémie primaire ............................................................. 16
6- Infection respiratoire basse (pneumonie) .................................................. 16
7- Infection sur cathéter ............................................................................... 18
8-Les méningites nosocomiales .................................................................... 19
9-Les péritonites postopératoires .................................................................. 19
IV-DEFINITION DES ETATS INFECTIEUX ............................................................ 20
1- Sepsis ...................................................................................................... 20
2 -Sepsis sévère ............................................................................................ 22
3- Choc septique .......................................................................................... 22
4- Syndrome de défaillance multi-viscérale ................................................... 22
V-RAPPEL SUR LA PATHOGENIE DE L’INFECTION .............................................. 22
1-Facteurs de l’infection ............................................................................... 22
1-1-Les moyens de défense de l’organisme ............................................... 22
1-2-Réservoirs et sources .......................................................................... 24
2-Germes en cause ....................................................................................... 24
2-1-Les bactéries ...................................................................................... 24
2-2-Les autres agents................................................................................ 28
TRANSMISSION .............................................................................................. 30
I-MECANISMES DE TRANSMISSIN ...................................................................... 31
II-MODES DE TRANSMISSION ........................................................................... 31
LES ANTIBIOTIQUES ........................................................................................ 34
I-LES BETALACTAMINES ................................................................................... 35
II-LES AMINOGLYCOSIDES ................................................................................ 38
III-LES QUINOLONES ........................................................................................ 39
IV-LES GLYCOPEPTIDES ................................................................................... 40
V-LES FUSIDANINES ......................................................................................... 40
VI-LES IMIDAZOLES ......................................................................................... 41
RESISTANCE BACTERIENNE AUX ANTIBIOTIQUES ................................................ 42

4
PREVENTION .................................................................................................. 45
I-SURVEILLANCE EPIDEMIOLOGIQUE ................................................................. 47
1-Objectifs d’un système de surveillance....................................................... 47
2-Sources de données................................................................................... 48
3-Organisation et stratégie de surveillance .................................................... 49
4-L’apport de l’informatique à la surveillance des IN ..................................... 52
II-LES MESURES GENERALES DE PREVENTION ................................................... 53
1- Mesures d’isolement et précautions concernant le personnel .................... 53
2- Recommandations pour la prévention des principales IN ........................... 55
2-1-Les infections respiratoires ................................................................ 55
2-2-Les infections urinaires ...................................................................... 56
2-3-Les infections liées aux dispositifs intravasculaires ............................. 58
III-LE BON USAGE DES ATB ............................................................................. 59
IV-PROCEDES DE DECONTAMINATION ......................................................... 62
MATERIEL ET METHODES ................................................................................ 63
I-MATERIEL ..................................................................................................... 64
1- Description du service de réanimation au CHU HASSANII de Fès ................ 64
2- Critères d’inclusion .................................................................................. 64
II-METHODES .................................................................................................. 64
1- Recueil des données ................................................................................ 64
2- Analyse statistique ................................................................................... 68
3-Calcul des différentes densités ................................................................... 68
RESULTATS.................................................................................................... 69
I-CARACTERISTIQUES DE LA POPULATION ETUDIEE ............................................ 70
1 -Age ............................................................................................................ 70
2- Sexe ........................................................................................................... 70
3- Motif d’hospitalisation ................................................................................ 71
3-1-Pathologie médicale ............................................................................... 71
3-2-Pathologie traumatique .......................................................................... 72
3-3-Pathologie chirurgicale .......................................................................... 72
4- Le séjour en réanimation ............................................................................ 73
II-CARACTERISTIQUE DES PATIENTS INFECTES ................................................... 73
1- Age ............................................................................................................ 73
2- Sexe ........................................................................................................... 73
3-Les antécédents .......................................................................................... 73
4- Motif d’hospitalisation ................................................................................ 74
4-1-Pathologie médicale .............................................................................. 74
4-2-Pathologie chirurgicale .......................................................................... 74
4-3-Pathologie traumatique .......................................................................... 75
5-Notion de prise antérieure des antibiotiques ................................................ 75
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
 133
133
 134
134
 135
135
 136
136
 137
137
 138
138
 139
139
 140
140
 141
141
 142
142
 143
143
 144
144
 145
145
 146
146
 147
147
 148
148
 149
149
 150
150
 151
151
 152
152
 153
153
 154
154
 155
155
 156
156
 157
157
 158
158
 159
159
 160
160
 161
161
 162
162
 163
163
 164
164
 165
165
 166
166
 167
167
 168
168
 169
169
 170
170
 171
171
 172
172
 173
173
 174
174
 175
175
 176
176
 177
177
 178
178
 179
179
 180
180
 181
181
 182
182
 183
183
 184
184
 185
185
 186
186
 187
187
1
/
187
100%