CORRIGE BAC SVT spé 2014 PARTIE COMMUNE. Partie I

CORRIGE BAC SVT spé 2014 D.Veillat
PARTIE COMMUNE.
Partie I : Diversité génétique.
La reproduction sexuée se traduit par I ‘association de 2 cellules sexuelles, les gamètes (un gamète
d’origine maternelle, l’autre d’origine paternelle), qui par le biais de la fécondation est à l’origine
d’un individu original. Ce type de reproduction permet de créer un certain de combinaisons
chromosomiques qui est à I’origine de Ia diversité phénotypique de Ia population étudiée, et plus
généralement de toutes les espèces ayant une reproduction sexuée.
1° les allèles.
La plupart des gènes présentent des variantes à l’origine de conséquences physiques variées pour un
même caractère.
1° La méiose.
Au cours de sa formation, chaque gamète reçoit au hasard un chromosome de chaque paire soit n
chromosomes, c'est-à-dire deux fois moins que les autres cellules de l'organisme à 2n chromosomes.
Tous les gamètes produits par un individu sont génétiquement différents, c'est-à-dire qu'ils ne
possèdent pas le même programme génétique. Lors de leur formation ils reçoivent au hasard un
chromosome de chaque paire de la cellule mère et ainsi un seul allèle pour chaque gène.
La méiose comprend deux étapes : une division réductionnelle et une division équationnelle.
Chacune de ces étapes est composée de 4 phases, la prophase, la métaphase, l’anaphase et la
télophase.
SCHEMA DE LA MEIOSE :
Le schéma ci-contre montre qu’au
cours de la division réductionnelle :
les chromosomes homologues se
séparent. A la fin de cette division, il y
a 2 cellules filles à n chromosomes à 2
chromatides par chromosome. La
répartition des chromosomes
homologues pendant cette phase se
fait au hasard (brassage inter-
chromosomique) et il peut se former
plusieurs combinaisons (2n, n étant le
nombre de paires de chromosomes
caractéristique de l’espèce).
Pendant la seconde division : les chromatides de chaque chromosome se séparent ; à la fin de cette
division, il y a 4 cellules filles à n chromosomes ayant 1chromatide chacun.
2° La fécondation :

A la fécondation, la cellule-œuf obtenue (zygote) reçoit un chromosome d’origine paternelle et un
chromosome d’origine maternelle pour chaque paire. La moitié des chromosomes d’une cellule-œuf
proviennent du père, l’autre moitié de la mère.
3° Brassage de deux gènes indépendants chez la drosophile par méiose et fécondation: on se
propose de montrer à l’aide de l’exemple proposé à l’étude, que les mécanismes de la méiose et de
la fécondation sont à l’origine de la grande variété des phénotypes individuels au sein d’une même
espèce. Les deux gène étudiés sont indépendants : corps clair (e+ dominant), corps sombre (e-
récessif) et ailes longues (vg+ dominant), ailes courtes (vg- récessif).
A. Croisement de deux souches pures
Dans le cas présenté ici, les deux souches que l’on croise sont pures :
Mâle : Femelle :
e+/e+ ; vg+/vg+ e-/e- ; vg-/vg-
méiose ->-------------------------------------------------------------------------------------------------------
gamètes : e+ ; vg+ e- ;vg-
fécondation ->---------------------------------------------------------------------------------------------
GénérationF1 : e+/e- ; vg+/vg-
Le phénotype de tous les individus de la génération F1 est « corps clair, ailes longues »
B. Croisement d’une souche « double hétérozygote »(F1) avec une souche « double récessif ». Si
l’on croise un individu de la génération F1 avec un individu double récessif, le même
raisonnement donne ceci :
Individu « F1 » Individu « double récessif »
e+/e- ; vg+/vg- e-/e- ; vg-/vg-
méiose -----------------------------------------------------------------------------------------------------
gamètes : e+ ; vg+
e- ;vg-
4 possibilités e+ ; vg- e- ;vg-
e- ; vg+
fécondation -------------------------------------------------------------------------------------------
Génération F2 : e+/e- ; vg+/vg- ou e-/e- ; vg-/vg- ou e+/e- ; vg-/vg- ou e-/e- ; vg+/vg-
Phénotypes parentaux Nouveaux phénotypes
On comprend que :
La méiose est à l’origine de gamètes variés. Le croisement entre Fl et le double récessif donne des
individus de phénotype parental, mais aussi des individus de 2 nouveaux phénotypes .
Ainsi, la fécondation amplifie-t-elle le brassage chromosomique de la méiose. Plus le nombre de
chromosomes de l’espèce est élevé, plus la variété des phénotypes au sein d’une espèce l’est aussi.
Conclusion :
C’est par la séparation des chromosomes homologues que se fait la répartition des gènes
indépendants, au hasard, au cours de la méiose. Au cours de la fécondation, le hasard de la

rencontre des gamètes multiplie les nombreuses combinaisons génétiques des gamètes. Les
possibilités d’apparition d’individus uniques dans chaque espèce sont donc très élevées, ce qui
contribue à l’augmentation de la diversité génétique au sein d’une espèce. On notera pour
information que dans le cas des gènes liés, il existe aussi un brassage possible par le biais du crossing-
over, ce qui augmente encore les possibilités de répartition des gènes au cours de la reproduction
sexuée.
Partie 2 : QCM sur l’orogenèse alpine.
Réponses :
1- Un mouvement le long dune faille inverse associé à une compression.
2- Formation d’une racine crustale et d’un relief constitué de sédiments plissés et charriés.
3-Les traces dune lithosphère océanique formée au préalable dans un contexte de divergence.
4-Une ancienne marge passive associée à une divergence.
5- La disparition des reliefs avait débuté il y a – 35 MA.
BAC 2014 - Exercice candidats non-spé- Corrigé
Introduction
Les contractions des muscles striés squelettiques sont commandées par l’activité des motoneurones
présents dans la corne antérieure de la substance grise de la moelle épinière. L’analyse des
documents proposés montre que des circonstances pathologiques comme l’anxiété peuvent dérégler
certains des mécanismes de contrôle de ces neurones provoquant ainsi des convulsions musculaires.
Document 1
Le document indique que l’administration de picrotoxine à l’animal reproduit les convulsions
musculaires associées à l’anxiété. Le fait que la picrotoxine soit un antagoniste du neurotransmetteur
GABA suggère que les symptômes musculaires de l’anxiété pourraient être liés à un déficit en GABA
dans le système nerveux central. Les expériences présentées dans les documents 2 et 3 permettent
de soumettre cette hypothèse à l’expérience.
Document 2
Le document 2 présente les relations synaptiques entre les terminaisons axonales des neurones
présynaptiques 1 et 2 et un motoneurone médullaire postsynaptique. Les enregistrements obtenus
montrent que les neurones 1 et 2 ont des effets opposés sur le potentiel membranaire du
motoneurone et donc sur son activité. La stimulation du neurone 1 provoque une hyperpolarisation
du motoneurone dont le potentiel transmembranaire passe transitoirement de – 70 mV à – 90 mV. Il
s’agit d’un potentiel postsynaptique inhibiteur (PPSI) qui ne se propage pas puisque aucune variation
de potentiel n’apparaît au niveau de l’axone du motoneurone. Le neurone 1 est un neurone
inhibiteur du motoneurone.
En revanche, la stimulation du neurone 2 provoque une dépolarisation, le potentiel membranaire
passant de – 70 mV à – 30 mV. C’est un potentiel postsynaptique excitateur (PPSE). Ce PPSE
déclenche l’émission d’un potentiel d’action le long de l’axone du motoneurone. Il s’agit d’une
brusque dépolarisation d’une centaine de mV d’amplitude qui se propage le long de l’axone. Le
neurone 2 est donc un neurone excitateur du motoneurone et sa stimulation déclenche l’émission de

potentiels d’action et la contraction des fibres musculaires connectées au motoneurone (unité
motrice).
Lorsque les neurones 1 et 2 sont stimulés simultanément, le motoneurone intègre ces deux types de
signaux opposés. Il en réalise la somme algébrique (sommation spatiale) et il en résulte une
dépolarisation de – 70 mV à – 55 mV qui ne déclenche pas l’émission d’un potentiel d’action. On en
déduit que le seuil de stimulation du motoneurone est compris entre – 55 mV et – 30 mV. En effet,
une stimulation supplémentaire par le neurone 2 (sommation temporelle) amène le potentiel
membranaire du motoneurone à – 40 mV ce qui provoque l’émission d’un potentiel d’action.
Ainsi, tout déséquilibre dans l’activité des neurones 1 et 2 au profit des neurones excitateurs est
susceptible de produire les contractions musculaires intempestives liées à l’anxiété.
Document 3
Ce document montre les effets de deux neurotransmetteurs antagonistes sur le motoneurone qui
reproduisent les mêmes effets que la stimulation des neurones 1 et 2. Lorsque du GABA est injecté
dans la fente synaptique F1 correspondant à la synapse avec le neurone inhibiteur, il produit un PPSI
similaire à celui obtenu par stimulation du neurone 1. Le GABA est en revanche sans effet sur la
synapse avec le neurone excitateur. À l’inverse, l’injection d’acétylcholine en F2 produit un PPSE
similaire à celui obtenu par stimulation du neurone 2 alors qu’elle est sans effet en F1. On en déduit
que des récepteurs postsynaptiques spécifiques du GABA et de l’acétylcholine sont présents dans la
membrane postsynaptique du motoneurone respectivement en F1 et F2 et qu’ils modulent le
potentiel de membrane en fonction de la quantité de neurotransmetteur reçue.
Conclusion
Si un déséquilibre s’installe entre libération de GABA et libération d’acétylcholine au niveau du
motoneurone en raison d’une activité accrue du neurone 2 ou d’une baisse d’activité du neurone 1
d’origine centrale et liée à l’anxiété, le motoneurone qui intègre ces signaux afférents augmente son
activité produisant ainsi des contractions des fibres musculaires qu’il innerve.
BAC 2014 – Exercice de spécialité – Corrigé :
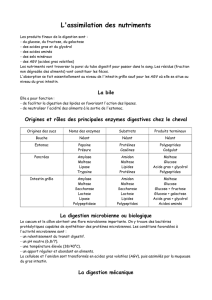
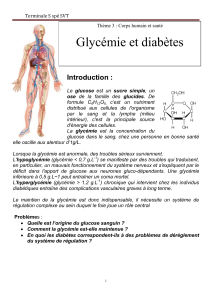
Le diabète est une hyperglycémie, c’est à dite une glycémie supérieure à 1,2 g.l-1 de sang ; un
fabricant de jus de fruits se propose de réduire l’apport de glucose alimentaire en produisant un jus
de banane appauvri en amidon et en glucose. [Pour les enfants ! Et les adultes diabétiques, alors ?]
Le document 1 montre qu’à quantité de glucides identique (< 7%), le fabricant se donne pour objectif
d’obtenir un jus de banane essentiellement riche en maltose. Il s’agit donc de transformer un jus
riche en amidon et glucose qui sont hyperglycémiants en un jus riche en maltose non
hyperglycémiant. Il s’agit donc de transformer amidon et glucose du jus initial en maltose.
Le document 2 montre la structure des glucides impliqués :
Naturellement, le jus de banane déjà riche en glucose verra l’amidon transformé en glucose par
l’appareil digestif :
L'amidon ingéré commence à être hydrolysé dans la bouche par l'amylase salivaire :

Les dextrines qui en résultent sont hydrolysées en maltose dans le duodénum, sous l'action de
l'amylase pancréatique :
La maltase du suc intestinal achève la digestion, en catalysant l'hydrolyse du maltose en 2 molécules
de glucose, ce que montre le document :
L’ensemble de ces processus s’effectue à une température optimale de 37°C.
Le jus de fruit de banane initial est donc un pourvoyeur important de glucose. Comment contourner
ce processus digestif naturel pour obtenir un jus essentiellement riche en maltose donc non
hyperglycémiant et peu sucré afin de ne pas habituer les enfants diabétiques au goût sucré?
Dans le document 3a , il est montré que le meilleur moyen d’éliminer l’amidon du jus de banane
initial est de l’hydrolyser en maltose en le soumettant à l’action de l’amylase à 37°C pendant 8
minutes. En effet, après 8 minutes de soumission de l’amidon à l’amylase, on a un test à l’eau iodée
négatif signifiant l’absence d’amidon.
Le test au Réactif de Fehling indique la présence d’un sucre réducteur (le maltose) mais le glucotest
est négatif. Il n’y a pas de production de glucose par action de l’amylase sur l’amidon.
A 2°, la vitesse de réaction est trop lente, à 85°C l’enzyme est dénaturée. Les enzymes fonctionnent
en effet dans des conditions de température et de PH précises.
L’amylase transforme l’amidon en maltose.
Que faire du glucose ? Le document 3b montre qu’il existe une enzyme spécifique (action et substrat)
permettant la synthèse de maltose à partir du glucose :
Maltase-synthase
2 glucose 1maltose
La maltase-synthase transforme le glucose en maltose.
Le fabricant de jus de fruit dispose donc de deux enzymes spécifiques, l’amylase et la maltase-
synthase permettant d’obtenir un jus appauvri en amidon et glucose tous deux transformés en
maltose. Il ne doit pas introduire la maltase dans son processus de fabrication, cette dernière
catalysant la transformation du maltose en glucose hyperglycémiant.
Conclusion :
On peut imaginer le processus de production d’un jus de banane pour diabétiques par usage
d’enzymes spécifiques in vitro à 37°C pendant quelques minutes (durée dépendant des facteurs
physiques et chimiques tels que PH et concentration en enzyme ou en substrat):
 6
6
1
/
6
100%