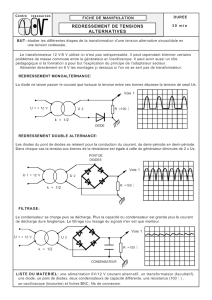
Version

Electronique 1
Cours 6:
Revision de la premiere partie
2
Introduction
• Interet: conduction dans semiconducteurs
• Courant: deplacement de charges
• Charges se trouvent des les atomes
• Pour deplacer les atomes il faut:
1) Les detacher
2) Les deplacer
• Commencons avec #1 (les detacher)…
3
Modele de Bohr
• Si on pensait a un atome comme ceci:
•On voit:
• Les electrons proches du + sont attires plus fort
• Les electrons plus loins sont moins attires
• Plus loins: plus tendance a se detacher
+
-
-

4
Modele Quantique
• Idee generale:
• “moins attire = plus facile a bouger”
• “Plus loins = plus faciles a bouger”
• Mais, COMBIEN d’electrons sont loins et
combien sont proches?
• Il faut savoir ou les electrons se trouvent
• Il faut donc voir le modele quantique
5
Modele Quantique
• Comment sont caracterises les electrons?
• Premierement, il y a la distance
• On va appeller ca le nombre quantique
primaire n
•nest un entier positif (non-nul)
+
-
-
n=1
n=2
6
Modele Quantique
• On dessine les atomes avec des orbites
circulaires: ce n’est pas toujours le cas
• Les formes sont donnees par le nombre
quantique secondaire l.
•lpeut avoir une valeur de 0a (n-1)
• Si un atome avait 2 niveaux n (n=1 et n=2)
• A la distance n=1, l=0 (un seul lici)
• A la distance n=2, l=0 OU l=1 (2 lpossibles ici)

7
Modele Quantique
• Les electrons:
• Sont a des distances differentes (n)
• Ont des formes d’orbites differents (l)
• Les orbites sont aussi orientes de facons
differentes
• Pensez aux trois orientations du double
lobe
8
Modele Quantique
• Ca nous amene au nombre quantique
magnetique (ml)
• Les orientations vont de –la +l
• Pour chaque l, il y a (2*l)+1 orientations
• Ex: Double lobe, c’est l=1
• La formule montre qu’il y a 3 orientations.
• Finalement: pour chaque orientation, il y a
2 spins (ms): spin up ou spin down.
9
Modele Quantique
• Resumons:
• On peut etre a plusieurs orbites (n)
• CHAQUE orbite a des formes differentes (l)
• CHAQUE forme a des orientations differentes (ml)
• CHAQUE orientation a 2 spins (ms)
• On peut donc ENUMERER les electrons
• On saura combien d’electrons sont les
plus loins (ceux qui peuvent conduire).

10
Distribution
• Electrons:
• On ne sait pas ou ils sont
• On ne sait pas comment ils se deplacent
• On connait au moins quelques petites
choses
• A T=0K, ils sont TOUS dans leurs orbites
• A T > 0K, certains ont assez d’energie pour aller
dans une autre orbite
11
Distribution
•A T > 0K:
• On ne sait pas QUELS electrons ont assez
d’energie
• On a une idee generale de quelle proportion
d’electrons a assez d’energie
• Distribution statistique:
• Distribution de Fermi-Dirac
()
kTEE F
e
Ef /
11
)( −
+
=
A temperature T, c’est quoi la probabilite de trouver un electron a E?
12
Distribution
• On estime la probabilite de trouver des
electrons a une energie donnee
•E
F:Niveau de fermi (plutot Ei)
• Energie ou on a ½ chance de trouver un electron
• Exemple d’utilisation:
• On veut connaitre la probabilite de trouver un
electron a l’energie minimale de la bande de
conduction a 310K.

13
Distribution
• C’est bien de connaitre la probabilite
• Mais j’ai besoin d’une QUANTITE…
• On utilise la formule generale:
• Par exemple:
• On joue a “pile” ou “face” 40 fois. Combien de fois
est-ce que j’aurai “face”?
eProbabilit# ⋅= EssaisQuantite
()
foisQuantite 202/140 =⋅=
14
Distribution
• Ici, on aurait
• La densite d’etat sera donnee: NVet NC
• Pour savoir “combien d’electrons en
conduction”, on ferait l’integrale:
• Apres simplification, on obtient:
)()( EfDensiteEn ⋅=
(
)
kTEE
VFV
eNp /
0−
=
()
kTEE
CFC
eNn /
0−−
=
∫
∞
⋅=
C
E
dEEfDensiten )(
0
15
Distribution
• Pour le silicium intrinseque, p0=n0.
• On va appeller ca piet ni (donc, pi=ni)
• Le niveau de fermi intrinseque sera Ei
• On peut aussi doper le silicium pour
augmenter la conductivite: extrinseque
• Type-N: On dope avec plus d’electrons
• Type-P: On dope avec plus de trous
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
1
/
15
100%