Les chambres implantables pour accès veineux en oncologie

9
Bulletin Infirmier du Cancer Vol.13-n°1-janvier-février-mars 2013
e plus en plus de soignants en services hos-
pitaliers et à domicile sont confrontés à des
patients porteurs de chambres implantables.
Ce système présentant de nombreux avantages, il nous
est apparu, à travers les partages d’expériences avec nos
confrères, que chaque établissement, chaque service,
voire chaque infirmier avait de bonnes connaissances
sur ces dispositifs, mais que chacun pratiquait diffé-
remment, sans forcément suivre les procédures locales
ou même les recommandations nationales et/ou inter-
nationales.
C’est pourquoi il nous a semblé important de faire un
point sur les risques inhérents à l’utilisation de ces dispo-
sitifs et sur les bonnes pratiques permettant de les éviter.
Tout d’abord, rappelons que « chambre à cathéter
implantable » (CCI), « Port-a-Cath » (PAC) ou « site implan-
table » sont autant de termes utilisés pour définir le même
système. Il s’agit d’un réservoir sous-cutané en titane ou
plastique comportant une épaisse membrane en silicone
(septum), qui est connectée à un cathéter souple, en sili-
cone ou en polyuréthane. Ce dernier est radio-opaque
et s’introduit dans une veine centrale (jugulaire ou sous-
clavière et plus rarement fémorale). Son extrémité est
située à la jonction de la veine cave supérieure et de
l’oreillette droite. La pose du PAC est habituellement réa-
lisée sous anesthésie locale.
Ce dispositif va permettre les perfusions et les injec-
tions de produits intraveineux, ainsi que la réalisation
des prélèvements sanguins. Il est préconisé pour des
traitements d’une durée supérieure à 3 mois.
Il est apparu en oncologie au début des années 1980
afin de diminuer le risque d’extravasation et de préserver
l’état des veines périphériques qui ont tendance à se sclé-
roser du fait de la toxicité des produits de chimiothérapies.
En France, l’utilisation des dispositifs est régie par
différents articles du décret N°2002-802 du 29 juillet
2004 du Code de Santé Publique.
L’article R.4311-2 rappelle que les soins infirmiers
« sont réalisés en tenant compte de l’évolution des
sciences et des techniques », ce qui implique que chaque
soignant doit régulièrement se mettre à jour dans ses
connaissances afin de réactualiser ses pratiques.
Cette idée n’est pas sans rappeler celle évoquée par
la circulaire DGS/DH/DRT n° 98-228 du 9 avril 1998
relative aux précautions standard qui indique que
les « protocoles doivent être connus du personnel et leur
application régulièrement évaluée ».
L’article R.4311.5 met en avant l’importance de res-
pecter les mesures d’hygiène (patient, environnement,
pansement) et de surveiller les différents types de cathé-
ters, ceci relevant directement du rôle propre de l’infir-
mier.
Pratique et technique
D
Les chambres
implantables pour accès
veineux en oncologie :
complications
et prévention
Céline Barbu1, Sébastien Bugeia2, Eric Desruennes3
1Infirmière en oncologie, Institut Gustave Roussy, 94800 Villejuif, France
2Infirmier en oncologie, Clinique des Grangettes, 1224 Chêne-Bougeries, Suisse
3Anesthésiste, Unité Voies veineuses centrales, Institut Gustave Roussy, Villejuif, France
Pratique n°1-13:nouvelles AFIC n°1vol5 28/02/13 14:34 Page9
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 03/06/2017.

10
Bulletin Infirmier du Cancer Vol.13-n°1-janvier-février-mars 2013
L’article R.4311.7 insiste sur l’importance de la « sur-
veillance de cathéters veineux centraux et de montages
d’accès vasculaires implantables mis en place par un
médecin » et détaille les différents soins sur prescription
médicale relatifs aux accès veineux centraux (injection,
prélèvements sanguins, perfusions, pansements spéci-
fiques).
Cette liste non exhaustive de références législatives
nous paraît importante à rappeler car chacun doit prendre
conscience qu’au-delà d’une qualité des soins à pratiquer,
il en va de l’engagement de sa propre responsabilité.
En France, environ 150 000 chambres sont posées
chaque année. Même si l’utilisation des PAC présente
de nombreux avantages, nous ne pouvons nier que des
complications peuvent apparaître. Il est primordial pour
les infirmiers de repérer les signes et de connaître les
bons gestes, pour en assurer la prévention, mais aussi
les interventions à mettre en place en cas de survenue
d’un problème.
Nous nous intéresserons à chacune des complica-
tions potentielles suivantes :
– la thrombose ;
– l‘obstruction ;
– l‘infection ;
– l‘extravasation ;
– la désunion du cathéter de la chambre ;
– l‘embolie gazeuse ;
– le retournement, l’usure et l’érosion de la chambre.
La thrombose
La présence prolongée d’un cathéter dans la veine
sous-clavière ou jugulaire peut irriter la paroi veineuse
et est de ce fait un facteur prédisposant au développe-
ment d’un caillot de sang (thrombus) [1].
L’incidence des thromboses sur cathéters veineux
centraux rapportée chez les patients atteints de cancer
varie selon les études. Dans la revue publiée par Klerk
et al. en 2003, l’incidence des thromboses sur cathéter
chez les patients atteints de cancer se situe entre 0 et
20 % [1]. Le travail de Verso et al. en 2003 chiffre cette
incidence aux environs de 4 à 5 % (0 à 28 % selon les
études) lorsqu’elles sont symptomatiques, et à 30 %
(27 % à 66 %) quand les thromboses sont détectées de
façon systématique par phlébographie [1]. Les études
les plus récentes rapportent un taux de thromboses simi-
laire avec ou sans traitement préventif (environ 5 % de
thromboses symptomatiques).
Le risque est différent en fonction du type de néopla-
sie : il est plus élevé chez les patients porteurs d’adéno-
carcinomes muco-sécrétants du tube digestif, de cancers
pancréatique, pulmonaire ou ovarien, de leucémie aiguë
promyélocytaire ou de syndrome myélo-prolifératif [2].
La position du cathéter est, elle aussi, un facteur favo-
risant la thrombose. Un cathéter trop court ou posé en
fémoral est plus sujet aux thrombus. En revanche, le
risque est diminué si le PAC est inséré du côté droit du
thorax [3]. Pour diminuer le risque de thrombose, mais
également la survenue de problèmes de fonctionne-
ment, la position recommandée de l’extrémité du cathé-
ter est la jonction veine cave supérieure/oreillette droite
qui se projette sur une radiographie de thorax environ
1 à 2 corps vertébraux sous la carène (figure 1).
Il est essentiel de savoir repérer la thrombose. Elle
se manifeste, en général, par un œdème du bras du côté
du PAC, une douleur, l’apparition d’une circulation vei-
neuse collatérale, parfois la palpation d’un cordon vei-
neux induré, et par un fébricule à 38°C.
L’examen permettant de poser le diagnostic est
l’écho-Doppler qui va permettre de visualiser le caillot.
Le traitement consiste en l’administration d’héparines
de bas poids moléculaire (HBPM) pour une durée de 3
à 6 mois. En cas de mauvaise position de l’extrémité du
cathéter (cathéter court) ou en cas d’absence d’amélio-
ration, l’ablation de la chambre pourra être discutée.
La prévention de ce risque passe par la vérification
Pratique et technique
Figure 1 : L’extrémité du cathéter doit se projeter en regard
de la 1re ou 2evertèbre sous la bifurcation bronchique.
Pratique n°1-13:nouvelles AFIC n°1vol5 28/02/13 14:34 Page10
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 03/06/2017.

11
Bulletin Infirmier du Cancer Vol.13-n°1-janvier-février-mars 2013
après la pose du bon positionnement de l’extrémité du
cathéter par une radiographie pulmonaire, la vérifica-
tion systématique du reflux sanguin et le rinçage après
chaque utilisation de la chambre.
Toutes ces pratiques sont aussi importantes les unes
que les autres pour diminuer le risque d’obstruction.
L’obstruction
Nous nous sommes tous un jour trouvés confrontés,
lors d’une injection de sérum physiologique, à une résis-
tance ou un mauvais débit. Il s’agit là des premiers signes
d’une obstruction, qui peut aller jusqu’à l’impossibilité
totale d’injecter quelque produit que ce soit.
La fréquence de cette complication est de 2 à 5 %.
Elle peut être secondaire à plusieurs facteurs : mauvaise
position du cathéter, présence d’un caillot dans la lumière
ou à l’extrémité inférieure du cathéter, dépôt de fibrine
ou précipitation de produits dans la lumière du cathé-
ter ou le réservoir de la chambre.
Avant de se lancer dans des manœuvres de désobs-
truction, il est important de vérifier sur la dernière radio-
graphie pulmonaire que le cathéter est bien positionné.
Dans certains cas, un manchon de fibrine peut entraî-
ner une obstruction partielle à l’extrémité distale du
cathéter. Ainsi, le reflux est impossible (la pression néga-
tive entraîne un effet clapet) mais l’injection se passe
sans souci, dans ce cas une opacification du cathéter
pourra être réalisée ce qui permettra de visualiser le
manchon fibrineux.
Mais que faire en cas d’obstruction totale ? Qui n’a pas
déjà observé un(e) collègue inexpérimenté(e) essayer
d’injecter avec force ?
La première chose à faire est d’essayer des manœuvres
douces d’aspiration/injection avec une seringue de 10 mL
de sérum physiologique. En cas d’échec, le traitement à
mettre en place, sur prescription médicale, consiste à
appliquer un thrombolytique. Deux produits peuvent être
utilisés : l’urokinase (Actosolv®) ou l’alteplase (Actilyse®)
[4]. Il convient de les utiliser comme suit :
– conservation des deux produits avant reconstitu-
tion entre +2° et +8 °C ;
– posologie :
1) urokinase : diluer 100 000 UI d’urokinase (poudre)
dans 5 mL de solvant et compléter avec 15 mL de sérum
physiologique afin d’obtenir un volume de 20 mL ; la
concentration obtenue est de 5 000 UI/ml ; injecter 1 à
2 mL de la solution finale dans la chambre implantable ;
2) Actilyse®: reconstituer les 2 mg avec les 2 mL de
solvant et injecter la totalité (ou du moins ce que vous
pouvez) au niveau de la valve bidirectionnelle de l’ai-
guille de Huber ; attention l’Actilyse® est incompatible
avec les solutions glucosées.
– En cas d’impossibilité totale d’injecter dans la
chambre, un protocole à 2 aiguilles peut être appli-
qué. L’aiguille reliée au thrombolytique étant clampée,
aspirer sur l’autre aiguille le plus fort possible afin de
créer une pression négative dans la chambre, puis clam-
per cette aiguille et déclamper l’aiguille reliée au throm-
bolytique qui va être aspiré dans la chambre du fait de
la dépression qui y a été créée (figure 2).
– Laisser en place 1 à 2 heures puis, dans la mesure
du possible, réaspirer le produit. En cas de reflux san-
guin, bien rincer le dispositif avec du sérum phy-
siologique.
– Si aucun reflux n’est constaté : injecter une 2edose
identique à la 1re et laisser en place le plus longtemps
possible (voire une nuit entière).
– Si malgré tout le dispositif reste obstrué, il n’est pas
utile d’essayer une 3edose, il faut alors prévoir le chan-
gement de PAC.
• Il est bon de rappeler que toute manœuvre de
désobstruction sous pression est formellement
contre-indiquée car elle entraîne une hyperpression
avec risque de désunion du cathéter et de la chambre.
Afin de prévenir ce risque d’obstruction, il est impor-
tant de toujours vérifier la présence du reflux sanguin
et la régularité du débit. Le rinçage avec au minimum
1 mL de sérum physiologique entre 2 produits différents
est indispensable. Il l’est également après un prélève-
ment sanguin, une transfusion et l’alimentation paren-
térale où celui-ci se fera de façon pulsée.
Pratique et technique
Figure 2 : Protocole à deux aiguilles.
Pratique n°1-13:nouvelles AFIC n°1vol5 28/02/13 16:54 Page11
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 03/06/2017.

12
Bulletin Infirmier du Cancer Vol.13-n°1-janvier-février-mars 2013
Il est recommandé de brancher le sang, les dérivés
sanguins et la nutrition parentérale sur le site proximal
(au plus proche du patient) afin de faciliter le rinçage
du dispositif de perfusion.
Il est également conseillé de préférer les systèmes
actifs d’injection (pompes), plutôt que la perfusion par
gravité, afin de diminuer le risque de reflux sanguin.
Enfin, il est évident qu’un rinçage de qualité lors du
retrait de l’aiguille de Huber/ Gripper®de la chambre
est essentiel. Les récentes recommandations préconi-
sent que le PAC soit rincé avec 10 mL de solution saline
en 3 poussées successives en faisant pivoter l’aiguille
sur 360°. L’ablation de l’aiguille se fait toujours en pres-
sion positive pour éviter le reflux sanguin [5], biseau de
l’aiguille vers la lumière du cathéter.
Avec certaines aiguilles de dernière génération, la
pression positive se fait automatiquement au retrait de
l'aiguille du septum.
Pendant longtemps, l’héparine a été utilisée dans le
rinçage des PAC. Les arguments avancés contre son uti-
lisation sont nombreux : durée de vie limitée, hypocal-
cémie, risque de thrombopénie induite par l’héparine
(TIH), incompatibilité avec le produit perfusé. Après
avoir comparé plusieurs études [6], en 2000, l’HAS signale
que le rinçage avec du sérum physiologique est aussi
efficace et moins contraignant que le sérum hépariné.
Toutes ces manipulations ne sont pas sans risques et
nous pouvons rapidement contaminer une partie du sys-
tème qui doit être et rester stérile.
L’infection
En dehors des ablations réalisées en fin de traitement,
l’infection est la 1re cause d’ablation d’une chambre
implantable. C’est une complication fréquente avec une
prévalence comprise entre 5 % et 10 % en onco-héma-
tologie. Ce risque est souvent lié au non-respect des
règles d’hygiènes et d’asepsie. Il est bien évidemment,
proportionnel aux nombres de manipulations.
La contamination par les germes peut se faire de dif-
férentes façons :
– extra-luminale : les germes contaminent la chambre
à partir de l’incision (infections liées à la pose de la
chambre) ou le long de l’aiguille de Huber au moment
de sa pose ou en cours de perfusion, les germes pro-
viennent alors de la flore cutanée du patient ou de la
flore exogène apportée lors des soins ;
– endo-luminale : lors de l’utilisation à partir des
aiguilles ou de la manipulation des diverses connexions
de la ligne voire plus rarement par contamination des
solutés perfusés (la nutrition parentérale augmente le
taux d’infection à Candida) ;
– hématogène : contamination de la portion intra-
vasculaire du cathéter, à partir d’un foyer infectieux à
distance lors d’un épisode bactériémique, en particulier
en cas de neutropénie.
Nous remarquons que cette complication incombe
principalement aux soignants qui, pour différentes rai-
sons, baissent leur garde et ne respectent pas les règles
de bonnes pratiques en matière d’asepsie.
On distingue 2 types d’infections liées au PAC : l’in-
fection purement locale et les infections systémiques
(fièvre sans signes locaux, bactériémie, septicémie).
En ce qui concerne l’infection locale, le diagnostic
se fait sur la clinique. Les symptômes retrouvés, le plus
souvent, sont les douleurs au niveau du PAC et la consta-
tation de signes locaux d’inflammation (rougeur, indu-
ration, sérosité).
Pour ce qui est des infections systémiques, le signe
principal est l’hyperthermie avec ou sans frissons. L’exa-
men qui va nous permettre de confirmer l’infection est
la réalisation au même moment d’hémocultures cou-
plées sur le PAC et en périphérie. L’hémoculture péri-
phérique doit être faite en premier pour éviter un faux
positif dû au rinçage de la chambre après l’hémoculture
centrale. On peut affirmer que la chambre est infectée :
– si le rapport de la concentration en micro-orga-
nismes (UFC/ml) de l’hémoculture prélevée sur cathé-
ter avec la concentration en micro-organismes de l’hé-
moculture périphérique est ≥ 5 ;
– ou lorsqu’avec la méthode quantitative de Brun-
Buisson le résultat est ≥ 1 000 UFC*/mL ou avec la
méthode semi-quantitative de Maki est > 15 UFC [7] ;
– ou si l’hémoculture sur la chambre pousse plus vite
qu’en périphérie avec une différence de plus de
2 heures ; cette méthode est plus facile à réaliser et tend
à remplacer les deux précédentes.
Les germes le plus souvent retrouvés sont le sta-
phylocoque à coagulase négative (29 %), le staphylo-
coque doré (19 %), le pseudomonas aéruginosa (12 %),
les entérobactéries (23 %) et les levures (7 %) [8].
En fonction du germe retrouvé, le traitement pres-
crit sera différent.
Pour les staphylocoques à coagulase négative et les
entérobactéries, le traitement conservateur par antibio-
thérapie locale (verrou antibiotique [9]) et systémique (si
Pratique et technique
Pratique n°1-13:nouvelles AFIC n°1vol5 28/02/13 14:34 Page12
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 03/06/2017.

13
Bulletin Infirmier du Cancer Vol.13-n°1-janvier-février-mars 2013
hémocultures périphériques positives) sera mis en place.
En ce qui concerne une colonisation par Candida
spp. (albicans, glabrata...), S. Aureus et P. aeruginosa,
l’ablation de la chambre est systématique, de même
qu’en cas d’infection locale, de choc septique ou en cas
d’échec du traitement antibiotique dans un délai de 48-
72 heures (se manifestant par une non-régression des
signes cliniques). Le retrait se fera sous anesthésie locale.
Avant la pose d’une nouvelle chambre, en un autre
site anatomique, il est recommandé de respecter un délai
d’au moins 48 heures d’antibiothérapie efficace et de
s’assurer de la négativation des dernières hémocultures
périphériques.
Il faut savoir que l’utilisation en routine d’un verrou
ou d’un flush antibactérien (antibiotique ou autre) n’a
pas d’intérêt pour prévenir les infections sur PAC.
La prévention de ce risque est primordiale et peut se
faire à différents moments de l’utilisation de la chambre
implantable [10] :
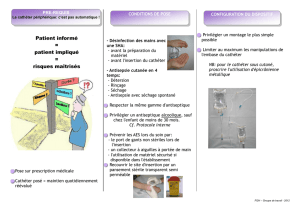
Tout d’abord, et cette mesure est indispensable, l’an-
tisepsie des mains des soignants doit se faire avant et
après chaque soin sur PAC. L’utilisation d’une solution
hydro-alcoolique par friction n’est plus à démontrer et
doit être systématique. Il convient aussi de respecter des
règles strictes à différents moments clés des soins réali-
sés autour d’une chambre implantable.
C’est le cas lors de la pose de l’aiguille de
Huber/Gripper®, qui est une manipulation qui se doit
d’être stérile :
– le soignant et le patient doivent porter un masque
pour éviter l’apport de germes par voie aérienne (pos-
tillons) ;
– une dénudation suffisante du patient doit permettre
une large désinfection cutanée ;
– la dépilation du site d’insertion de l’aiguille est décon-
seillée mais si elle est indispensable pour assurer une
bonne tenue du pansement, la tonte sera privilégiée ;
– la peau doit être préparée par une antisepsie en 4
temps comportant une détersion avec un savon anti-
septique, un rinçage avec du sérum physiologique, un
séchage suivi d’une désinfection avec un produit anti-
septique alcoolique en non stérile, enfin une seconde
désinfection avec le même produit après avoir mis les
gants stériles ;
– le matériel utilisé se doit d’être stérile et à usage
unique ;
– un champ stérile peut être utilisé pour la ponction
de la chambre, plus particulièrement pour la pratique à
domicile ; il devra être troué et pré-fendu afin de ne pas
engendrer de faute d’asepsie à la fin du geste ;
– l’emploi de pansement transparent semi-perméable
stérile (répondant à la norme EN 13726-2) est préférable
car il permet l’inspection du site de ponction, il doit être
occlusif ;
– il ne faut pas superposer deux pansements semi-
perméables du fait du risque infectieux par excès
d’humidité ;
– le soignant doit informer le patient que les douches
sont prohibées lorsque l’aiguille est en place sur le PAC
car elle favorise le décollement du pansement et, de ce
fait, la prolifération des germes (surtout ceux contenus
dans l’eau) si la réfection n’est pas immédiate.
Au-delà du moment de la pose, d’autres précautions
sont à prendre pendant que l’aiguille est en place.
L’infirmier doit :
– limiter et regrouper les manipulations, utiliser des
compresses imbibées d’antiseptique ;
– désinfecter les raccords avant toute injection ; il est
conseillé de les protéger s’ils risquent d’entrer en contact
avec le lit du patient (boîtier ou compresses régulière-
ment imprégnées d’un antiseptique) ;
– changer les rampes et refaire le pansement tous les
4 jours ;
– refaire sans délai tout pansement souillé ou
décollé ;
– changer l’aiguille de Huber tous les 8 jours pour
les patients qui sont perfusés en continu ;
– changer les tubulures toutes les 48h à 72h ;
– maintenir le système le plus clos possible, penser
à changer le bouchon stérile après chaque manipula-
tion au niveau du robinet et ne jamais laisser le système
ouvert sans bouchon de verrouillage ;
– assurer la traçabilité des soins dans les transmis-
sions ou les diagrammes de soins pour savoir quand le
changement de matériel a été et doit être effectué.
Enfin, il paraît évident de suivre également certaines
règles lors du retrait de l’aiguille :
– le soignant et le patient doivent porter un masque ;
– il faut préférer les seringues préremplies, sinon le
sérum physiologique de rinçage doit être en unidose ;
– la peau doit être désinfectée après le retrait de l’ai-
guille ;
– le pansement réalisé doit être stérile, sec et occlu-
sif, et doit rester en place au moins 1 heure.
L’éducation du malade sur son hygiène corporelle
est également importante pour prévenir le risque infec-
Pratique et technique
Pratique n°1-13:nouvelles AFIC n°1vol5 28/02/13 14:34 Page13
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 03/06/2017.
 6
6
 7
7
 8
8
1
/
8
100%