Le présent fichier est une publication en ligne reçue en

Le présent fichier est une publication en ligne reçue en dépôt légal, convertie en format PDF et
archivée par Bibliothèque et Archives nationales du Québec. L’information contenue dans le
fichier peut donc être périmée et certains liens externes peuvent être inactifs.
Version visionnée sur le site Internet d’origine le 11 avril 2014.
Section du dépôt légal

© APES tous droits réservés Pharmactuel 2014;47(1) 9
éditorial
Intérêt de la thérapie ciblée pour le cancer du poumon non
à petites cellules de stade avancé
Lise Tremblay1,2,3, M.D., FRCPC
1Pneumologue, Institut universitaire de cardiologie et de pneumologie de Québec, Québec, (Québec) Canada;
2Chercheure, Centre de recherche, Institut universitaire de cardiologie et de pneumologie de Québec, Québec, (Québec) Canada;
3Professeure agrégée de clinique, Faculté de médecine, Université de Laval, Québec, (Québec) Canada
Soumis le 2 février 2014; Accepté après révision le 9 février 2014
prise en charge des patients. Il s’agit fort probablement de
l’avancée la plus spectaculaire des dernières décennies dans
le traitement du cancer du poumon. Les grandes sociétés en
oncologie, dont l’American Society of Clinical Oncology, ont
recommandé que la recherche de ces marqueurs soit faite
chez tous les patients qui en sont au stade métastatique
afin d’offrir dès le début le meilleur traitement possible8.
Plusieurs études de phase III ont confirmé la supériorité
des thérapies ciblées sur la chimiothérapie cytotoxique en
termes de taux de réponse, de survie sans progression et
de qualité de vie9,10. Toutefois, aucun avantage sur la survie
n’a pu être démontré, car la majorité des patients recevant
initialement de la chimiothérapie avaient reçu un inhibiteur
de la tyrosine kinase en deuxième intention.
Récemment, une étude a permis de clarifier la prise en charge
des patients en deuxième ligne, dont le statut mutationnel de
l’EGFR et de l’ALK est négatif. Auparavant, on utilisait soit
une chimiothérapie cytotoxique à base de docétaxel ou de
pemetrexed, soit un inhibiteur de la tyrosine kinase. Le choix
ne reposait que sur le profil d’effets secondaires, puisque
l’efficacité de ces traitements était semblable. L’étude TAILOR
(Tarceva Italian Lung Optimization trial) a démontré que
l’effet du docétaxel était supérieur à celui de l’erlotinib
pour les patients ayant un statut mutationnel négatif11. Cela
implique une utilisation plus judicieuse des inhibiteurs de la
tyrosine kinase, soit pour les patients porteurs de marqueurs
moléculaires et non pour tous les patients.
Les pharmaciens étant grandement engagés dans les
cliniques d’oncologie, l’utilisation optimale des thérapies
ciblées représentera un défi qu’ils devront relever. Le
traitement des cancers passe actuellement par l’utilisation
d’une médication orale, comme le gefitinib ou le crizotinib.
Les pharmaciens communautaires doivent aussi s’engager
dans le suivi des effets indésirables et de l’adhésion à ces
nouveaux traitements.
Les avancées récentes des recherches sur la biologie
moléculaire relatives au cancer du poumon ont amélioré
la compréhension de cette maladie fort complexe. La
personnalisation de la prise en charge permet d’offrir
un traitement individualisé. L’émergence de plusieurs
marqueurs laisse à penser que l’évolution des nouveaux
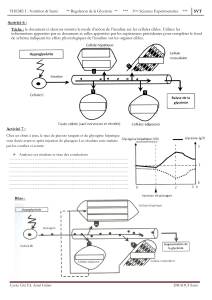
Le cancer du poumon occupe le deuxième rang parmi les
cancers le plus fréquemment diagnostiqués et représente
la première cause de décès par cancer au Québec1. Malgré
les avancées de sa prise en charge, le pronostic demeure
sombre.
Le traitement du cancer pulmonaire non à petites cellules
(CPNPC) de stade métastatique a considérablement évolué
au cours des dernières années. Boumedien fait état dans
le présent numéro d’un article révisant la prise en charge
du cancer du poumon, en s’attardant particulièrement
aux nouveaux traitements2. Bien qu’il y ait plusieurs sous-
types histologiques connus, le CPNPC était habituellement
considéré comme une seule et même maladie. L’association
d’un sel de platine et d’une chimiothérapie cytotoxique de
troisième génération était l’option proposée aux patients dont
la condition générale permettait de recevoir un traitement.
Au début des années 2000, des données sont apparues sur
les traitements de deuxième intention3,4, démontrant une
amélioration de la survie semblable à celle observée en
première ligne.
Pour la première fois, la survie médiane avait franchi le
cap des 12 mois grâce à une personnalisation de la prise en
charge. On a démontré les effets de l’histologie sur la réponse
à la chimiothérapie5. Les carcinomes non épidermoïdes
peuvent désormais être traités à l’aide d’une association de
sel de platine et de pemetrexed. L’introduction de stratégies
de maintenance a permis d’améliorer la survie d’une
population particulière6,7. Les patients ayant une maladie
non progressive après une chimiothérapie d’induction
peuvent bénéficier d’un prolongement de la chimiothérapie.
Le développement des thérapies ciblées représente un
tournant majeur dans la prise en charge de ces patients. Il
est le résultat d’une évolution de la compréhension du cancer
du poumon : nous comprenons maintenant que le CPNPC ne
correspond pas à une seule maladie, mais bien à plusieurs
tumeurs comportant des caractéristiques génétiques qui leur
sont propres. L’identification des mutations activatrices du
récepteur du facteur de croissance épidermique (epidermal
growth factor receptor, EGFR) et du réarrangement du gène
de la protéine kinase anaplasique du lymphome (anaplastic
lymphoma kinase, ALK) a changé de façon importante la
Pour toute correspondance : Lise Tremblay, Institut universitaire de cardiologie et de pneumologie de Québec, 2725, chemin de Sainte-Foy, Québec (Québec) G1V 4G5, CANADA;
Téléphone : 418 656-4747; Télécopieur : 418 656-4762; Courriel : lise.tr[email protected]

10 Pharmactuel 2014;47(1) © APES tous droits réservés
Conflits d’intérêts
L’auteur a rempli et soumis le formulaire de l’ICMJE pour
la divulgation de conflits d’intérêts potentiels. Madame
Tremblay a été conférencière pour les compagnies Lilly,
Roche et Pfizer.
traitements n’en est qu’à ses débuts. Pour la première fois
depuis des années, le visage du cancer du poumon est en
train de changer.
Financement
Aucun financement en relation avec le présent article n’a été
déclaré par l’auteur.
5. Scagliotti GV, Parikh O, Von Pawel J, Biesma
B, Vansteenkist J, Manegold C et coll. Phase III
study comparing cisplatin plus gemcitabine with
cisplatin plus pemetrexed in chemotherapy-naï-
ve patients with advanced-stage non-small-cell
lung cancer. J Clin Oncol 2008;26:3543-51.
6. Ciuleanu T, Brodowicz T, Zielinski C, Kim JH, Kr-
zakowski M, Laack E. Maintenance pemetrexed
plus best supportive care versus placebo plus
best supportive care for non-small-cell lung can-
cer: a randomised, double-blind, phase 3 study.
Lancet 2009;374:1432-40.
7. Cappuzzo F, Ciuleanu T, Stelmakh L, Cicenas S,
Szczéna A, Juhasz E et coll. Erlotinib as main-
tenance treatment in advanced non-small-cell
lung cancer: a multicentre, randomised, pla-
cebo, controlled phase 3 study. Lancet Oncol
2010;11:521-9.
8. Keedy V, Temin S, Somerfield M, Beasley M,
Johnson D, McShane L et coll. American Society
of Clinical Oncology Provisional Clinical Opinion:
1. Société canadienne du cancer. Agence de la
santé publique du Canada et Santé Canada.
Statistiques canadiennes sur le cancer 2012.
[en ligne] http://www.cancer.ca/~/media/cancer.
ca/CW/cancer%20information/cancer%20101/
Canadian%20cancer%20statistics/Canadian-
Cancer-Statistics-2012---French.pdf (site visité
le 20 avril 2013).
2. Boumedien F. La pharmacothérapie person-
nalisée et la pharmacogénétique. Pharmactuel
2014;47:28-39.
3. Shepherd FA, Rodrigues Pereira J, Ciuleanu T,
Tan EH, Hirsh V, Thongprasert S et coll. Erlotinib
in previously treated non-small-cell lung cancer.
N Engl J Med 2005;353:123-32.
4. Hanna N, Shepherd FA, Fossella FV, Pereira JR,
De Marinis F, Von Pawel J et coll. Randomized
phase III trial of pemetrexed versus docetaxel
in patients with non-small-cell lung cancer pre-
viously treated with chemotherapy. J Clin Oncol
2004;22:1589-97.
Références
Epidermal growth factor receptor (EGFR) muta-
tion testing for patients with advanced non-
small-cell lung cancer considering first-line EGFR
tyrosine kinase inhibitor therapy. J Clin Oncol
2011; 29: 2121-7.
9. Mok TS, Wu YL, Thongprasert S, Yang CH, Chu
DT, Saijo N et coll. Gefitinib or carboplatin–pacli-
taxel in pulmonary adenocarcinoma. N Engl J
Med 2009;361:947-57.
10. Shaw AT, Kim DW, Nakagawa K, Seto T, Crino
L, Ahn MJ et coll. Crizotinib versus chemothe-
rapy in advanced ALK-positive lung cancer. N
Engl J Med 2013;368:2385-94.
11. Garassino MC, Martelli O, Broggini M, Farina G,
Veronese S, Rulli E et coll. Erlotinib versus doce-
taxel as second-line treatment of patients with
advanced non-small-cell lung cancer and wild-
type EGFR tumours (TAILOR) : a randomised
controlled trial. Lancet Oncol 2013;14:981-8.

© APES tous droits réservés Pharmactuel 2014;47(1) 11
lettre au rédacteur
Perspective pharmaceutique de la recherche clinique sur
les médicaments au Québec et en France
Aurélie Guérin1,2, Cynthia Tanguay3, B Sc., M.Sc., Denis Lebel4, B.Pharm., M.Sc., FCSHP,
Olivier Bourdon5,6, D.Pharm., Ph.D., Jean-François Bussières7,8, B.Pharm., M.Sc., MBA, FCSHP
1Assistante de recherche, Unité de recherche en pratique pharmaceutique, Centre hospitalier universitaire Sainte-Justine, Montréal (Québec) Canada;
2Interne en pharmacie, Faculté de pharmacie, Université de Paris XI, Paris, France;
3Coordonnatrice, Unité de recherche en pratique pharmaceutique, Centre hospitalier universitaire Sainte-Justine, Montréal (Québec) Canada;
4Pharmacien, Adjoint au chef, soins pharmaceutiques, enseignement et recherche, Département de pharmacie et Unité de recherche en pratique phar-
maceutique, Centre hospitalier universitaire Sainte-Justine, Montréal (Québec) Canada;
5Pharmacien, Chef du département de pharmacie, Centre hospitalier universitaire Robert-Debré, Paris, France;
6Professeur, Faculté des sciences pharmaceutiques et biologiques, Université Paris Descartes, Paris, France;
7Pharmacien, Chef du département de pharmacie et de l’Unité de recherche en pratique pharmaceutique, Centre hospitalier universitaire Sainte-Justine,
Montréal (Québec) Canada;
8Professeur titulaire de clinique, Faculté de pharmacie, Université de Montréal, Montréal (Québec) Canada
Reçu le 30 septembre 2013; Accepté après révision le 22 novembre 2013
Pour toute correspondance : Jean-François Bussières, Centre hospitalier universitaire Sainte-Justine, 3175, chemin de la Côte-Sainte-Catherine, Montréal (Québec) H3T 1C5,
CANADA; Téléphone : 514 345-4603; Télécopieur : 514 345-4820; courriel : jfbussier[email protected].qc.ca
À propos du cadre normatif et de
l’organisation
La France et le Québec renvoient à des textes fondateurs
communs, tels que le Code de Nuremberg, le Rapport
Belmont et la Déclaration d’Helsinki2-4. Les bonnes pratiques
cliniques de l’International Conference on Harmonisation
publiées en 1996 ont été intégrées au cadre juridique ou
normatif de la France et du Canada5.
Au Canada, la recherche clinique est encadrée par les
compétences fédérales et les lois canadiennes, tandis
que l’organisation des soins de santé, les pratiques
professionnelles et le droit civil qui inclut le consentement à
la recherche par les patients, sont de compétence provinciale.
Les chercheurs québécois doivent se conformer à la Loi et
Règlement sur les aliments et drogues au Canada, notamment
le titre 5 du Règlement sur les aliments et drogues à propos
des « Drogues destinées aux essais cliniques sur des sujets
humains ». L’article C.05.010 du Règlement sur les aliments
et drogues précise que « le promoteur doit veiller à ce que
tout essai clinique soit mené conformément aux bonnes
pratiques cliniques »6. Les chercheurs au Québec doivent en
plus respecter les lois provinciales, notamment le Code civil
du Québec et la Loi sur les services de santé et les services
sociaux7-8.
Membre de l’Union européenne, la France doit s’assurer
que son cadre juridique national respecte les orientations
des institutions politiques européennes, notamment
celles de l’Agence européenne du médicament (EMA). À
l’échelle nationale, la Loi du 9 août 2004 a remplacé la Loi
Huriet-Sérusclat qui encadrait auparavant la recherche
biomédicale9. Ces modifications étaient nécessaires pour
transposer en droit français la loi qui doit être appliquée au
niveau européen : la directive européenne 2001/20/CE10. La
France doit également suivre le Code de la santé publique et
Étant un intervenant pivot en recherche clinique, le
pharmacien doit aussi bien demeurer à l’affût des
changements législatifs au sein de son environnement légal
que s’intéresser au cadre législatif proposé ailleurs dans le
monde. Prenant connaissance de modifications législatives
au Code civil du Québec le 14 juin 2013, nous nous sommes
intéressés à comparer l’encadrement législatif de la recherche
au Québec et en France1.
En effet, plusieurs modifications législatives ont récemment
été apportées au Code civil du Québec. Entre autres, le
terme « expérimentation » a été remplacé par la mention
« recherche susceptible de porter atteinte à l’intégrité ».
Désormais, l’évaluation obligatoire des projets de recherche
clinique par un comité d’éthique de la recherche est prévue
au Code civil du Québec et pas seulement aux Bonnes
pratiques cliniques internationales et canadiennes. Le
concept de « risque sérieux » a été remplacé par celui de
« proportionnalité ». On permet désormais à un mineur âgé
d’au moins 14 ans de consentir seul à certains projets de
recherche qui impliquent, selon l’avis du comité d’éthique à la
recherche, un risque minimal et si les circonstances cliniques
le justifient. Le concept de « soins innovateurs », qui était
parfois utilisé pour éviter certaines démarches nécessaires à
tout projet de recherche, a également été retiré. L’obtention
du consentement autre que par écrit est maintenant permis
dans les cas où les circonstances le justifient. Enfin, on a
confirmé le recours possible au mécanisme de traitement
des plaintes des usagers d’un établissement de santé, et ce,
pour les participants à un projet de recherche1.
À partir d’une brève revue documentaire, nous avons établi
un profil comparatif de l’organisation, du cadre normatif
et de la pratique pharmaceutique en recherche clinique au
Québec et en France afin de déterminer les points communs,
les différences et les améliorations à envisager.

12 Pharmactuel 2014;47(1) © APES tous droits réservés
la décision du 24 novembre 2006 fixant les règles de bonnes
pratiques cliniques11-12.
Des structures similaires assurent le respect des obligations
contenues dans les bonnes pratiques cliniques. Une autorité
de santé nationale (c.-à-d. l’Agence nationale de sécurité des
médicaments en France et Santé Canada au Canada) autorise
la tenue d’un essai clinique qui prend en compte les avantages
et les risques. Alors que l’enregistrement d’un essai clinique
dans un répertoire est obligatoire en France, il est encouragé
sans être obligatoire au Canada. Des autorités locales
(c.-à-d. le Comité de protection des personnes en France et
le Comité d’éthique de la recherche au Québec) approuvent
la tenue d’un essai clinique en tenant compte des aspects
éthiques et du consentement libre et éclairé. En France, l’avis
donné par un comité de protection des personnes a une valeur
nationale tandis qu’au Québec, l’avis donné a généralement
une valeur pour l’établissement. Un comité d’éthique de
la recherche peut toutefois reconnaître l’évaluation d’un
autre comité. La composition des comités d’éthique est très
différente entre ces deux pays. Le Comité de protection des
personnes français est composé de 14 membres, dont un
pharmacien hospitalier. Le Comité d’éthique de la recherche
québécois est composé d’un minimum de cinq membres;
le pharmacien n’est pas un membre statutaire du Comité
d’éthique de la recherche, bien qu’il puisse y siéger. Les
différences relevées pour les 14 domaines étudiés lors de
notre comparaison ont été regroupées dans le tableau I.
À propos de la pratique pharmaceutique
En France, la décision du 24 novembre 2006 rappelle
l’obligation de recourir au pharmacien hospitalier pour la
gestion des médicaments de recherche. Au Québec, cette
obligation est rappelée dans le Plan d’action ministériel en
éthique de la recherche et en intégrité scientifique, qui a été
publié par le ministère de la Santé et des Services sociaux du
Québec en 199813. Par contre, les bonnes pratiques cliniques
n’exigent pas la prestation de soins pharmaceutiques aux
patients participant à la recherche. En pratique, il existe
des situations qui permettent de contourner le pharmacien
hospitalier, et ce, tant en France qu’au Québec. À preuve,
des médecins, souvent aidés du personnel infirmier,
assurent la dispensation de médicaments de recherche en
cabinets privés. Dans ces cas, ni le pharmacien hospitalier
ni pharmacien communautaire ne sont conscients du fait
que certains de leurs patients reçoivent des médicaments de
recherche.
En France, aucune mention relative à la recherche clinique
sur les médicaments n’est présente dans le Code de
déontologie des pharmaciens. Au Québec, depuis 2008, le
chapitre VI contient sept articles consacrés aux obligations
du pharmacien en recherche clinique.
Enfin, en France, le pharmacien ne peut pas être chercheur
principal, tandis qu’au Québec, le pharmacien peut être
chercheur principal, mais l’équipe doit compter un médecin
chercheur qualifié.
Selon nous, le pharmacien hospitalier est incontournable
en recherche clinique. Chaque participant à un projet de
recherche demeure d’abord un patient qui prend
des médicaments et qui, a fortiori, requiert des soins
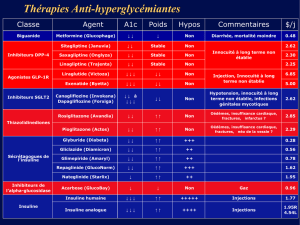
Tableau I. Différences entre le cadre normatif et l’organisation
de la recherche clinique en France et au Québec (Canada)
Domaines Différences
Cadre normatif France : cadre normatif international, européen et français
Québec* : cadre normatif international, canadien et québécois
Autorité
compétente
France : ANSM
Québec : Santé Canada
Demande
d’autorisation de
recherche clinique
France : demande d’AEC requise en phase I, II, III et IV
Québec : DEC requise en phase I, II, III; en phase IV, si le
médicament est utilisé à l’extérieur des limites de l’avis de
conformité (p. ex. indication ou cible non approuvées)
Délai de réception
de l’autorisation
France : 60 jours
Québec : 30 jours; Santé Canada émet une LNO
Répertoire des
essais cliniques
France : enregistrement sur EudraCT requis par l’ANSM avant de
faire une demande d’AEC
Québec : enregistrement sur l’une des banques de données de
l’OMS ou sur Clinicaltrials.gov encouragé par Santé Canada dans
un délai de 21 jours suivant le début de l’essai
Dénomination des
comités d’éthique
chargés de
l’évaluation
France : Comité de protection des personnes
Québec : CER désignés, CER non désignés et CE cliniques
Durée du mandat
des membres des
comités d’éthique
France : 3 ans
Québec : 4 ans
Nomination des
membres des
comités d’éthique
France : nomination par le préfet de région
Québec : recommandation du président du conseil
d’administration de l’établissement au ministère de la Santé et
des Services sociaux
Nombre de
comités d’éthique
France : 40 comités de protection des personnes
Québec : 220 (pour 155 établissements), soit 57 CER désignés,
32 CER non désignés et 131 CER cliniques
Portée de l’avis
des comités
d’éthique
France : l’avis donné a une valeur nationale
Québec : l’avis donné a une valeur pour l’établissement. Un
comité central peut émettre un avis à portée nationale. Un comité
d’éthique local peut entériner l’avis du comité d’éthique d’un autre
établissement.
Composition des
comités d’éthique
France : 14 membres
Québec : Cinq membres au minimum. Les membres doivent être
en majorité canadiens ou résidents permanents et composés
d’hommes et de femmes.
Consentement des
mineurs
France : donné par les deux titulaires de l’autorité parentale, sauf
si l’essai ne comporte que des risques et contraintes négligeables,
telles que le Comité d’éthique a établies ou si la recherche est liée
à l’occasion d’actes de soins ou si le 2e titulaire ne peut donner
son consentement dans des délais compatibles avec le protocole.
Le consentement du 2e titulaire peut être verbal ou téléphonique
avec écrit a posteriori.
Québec : donné par un titulaire de l’autorité parentale (un seul
parent suffit) et l’accord de l’enfant mineur.
Abandon ou
interruption d’un
essai clinique
France : le chercheur principal informe le promoteur et les
participants. Le promoteur informe l’ANSM et le Comité d’éthique
Québec : le chercheur principal informe le Comité d’éthique, le
promoteur et les organismes subventionnaires.
Archivage de la
documentation
France : 15 ans (médicaments dérivés du sang : 40 ans)
Québec : 25 ans
ANSM : Agence nationale de sécurité du médicament et des produits de santé; AEC : Autorisation
d’essais cliniques; CER : Comité éthique de la recherche; DEC : Demande d’essai clinique;
LNO : Lettre de non-objection; OMS : Organisation mondiale de la Santé
*Compte tenu des deux paliers de juridiction au Canada, la mention Canada ou Québec est
indiquée selon ce qui est applicable.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
1
/
56
100%