Lire l`article complet

CAS CLINIQUE
34
La Lettre du Gynécologue - n° 244 - septembre 1999
n parle d’anomalies de la détermination sexuelle
devant l’existence d’une discordance entre le sexe
génétique et le sexe gonadique. Cette dissociation
est liée à un échec de la détermination gonadique durant
l’embryogenèse. La recherche des gènes en cause s’est portée
initialement sur le chromosome Y, qui joue un rôle dominant
dans la détermination sexuelle dans le sens masculin. Le gène
SRY, gène clé de la différenciation de la gonade primitive en
testicule, a été isolé en 1990. Mais des anomalies à son niveau
ne suffisent pas à expliquer l’ensemble des troubles de la
détermination sexuelle observés (femmes XY et hommes XX).
Cette première étape de la différenciation sexuelle fait donc
intervenir d’autres gènes, dont certains ont été identifiés.
À partir de l’observation de deux patientes atteintes de dysgé-
nésie gonadique XY sans anomalie de SRY, nous aborderons
les différents gènes impliqués dans la détermination sexuelle.
OBSERVATIONS CLINIQUES
Première patiente
Mlle A., âgée de 17 ans, est venue consulter dans le service
pour aménorrhée primaire. Cette patiente, sans antécédent par-
ticulier, avait déjà consulté un gynécologue en ville à l’âge de
16 ans. Un premier bilan avait été effectué qui retrouvait des
gonadotrophines élevées (estradiol non dosé), un petit utérus et
deux ovaires mesurant respectivement 2,9 cm à droite et
1,5 cm à gauche à l’échographie pelvienne. Suite à ce bilan, un
traitement hormonal substitutif avait été prescrit et suivi pen-
dant une période de six mois, avec apparition d’hémorragies
de privation. À l’examen, la jeune fille présentait un morpho-
type féminin de grande taille (1,73 m pour 53 kg) associé à un
impubérisme, avec une pilosité axillaire quasiment absente, un
développement mammaire peu important et une pilosité
pubienne normale (score de Tanner : A1-S1-P4). On notait par
ailleurs une petite hypertrophie clitoridienne.
Le bilan réalisé a confirmé l’insuffisance ovarienne primitive,
avec un estradiol effondré (< 10 pg/ml), des gonadotrophines
élevées (FSH = 59 mUI/ml, LH = 12 mUI/ml). Les androgènes
étaient normaux (testostérone = 0,36 ng/ml, δ4-androstène-
dione = 1,6 ng/ml). Une nouvelle échographie pelvienne a
retrouvé un utérus de taille normale, avec des formations
arrondies situées de chaque côté de la vessie, difficiles à visua-
liser et pouvant correspondre à des petits ovaires denses. La
cœlioscopie réalisée afin de préciser l’étiologie de cette insuf-
fisance ovarienne a permis de découvrir un utérus hypopla-
sique et des ovaires réduits à des bandelettes fibreuses. L’his-
tologie a confirmé l’absence de parenchyme ovarien. Le
caryotype a permis de porter un diagnostic précis de dysgéné-
sie gonadique en mettant en évidence une formule XY. L’ana-
lyse du gène SRY n’a pas mis en évidence de mutation. Une
intervention chirurgicale est prévue afin de réaliser une gona-
dectomie.
Deuxième patiente
Mlle B. a consulté la première fois à l’âge de 18 ans pour une
aménorrhée primaire associée à un impubérisme. Elle avait
comme antécédent un rachitisme dans l’enfance. Cette patiente
présentait un morphotype féminin de taille moyenne (1,65 m
pour un poids de 54 kg). Le développement mammaire était peu
important, la pilosité axillaire normale et la pilosité pubienne
incomplète, avec présence d’un orifice vaginal court (profon-
deur de quelques millimètres). Les explorations biologiques ont
révélé une insuffisance ovarienne primitive, avec des gonadotro-
phines élevées (FSH = 61,5 mUI/ml, LH = 23,1 mUI/ml), un
estradiol bas (11 pg/ml), une testostérone normale (0,2 ng/ml)
avec un test à l’HCG négatif. La radiographie du poignet a mis
en évidence un retard d’âge osseux (13 ans). De plus, on retrou-
vait à l’échographie pelvienne une absence d’utérus et de vagin
et des petites formations situées de chaque côté de la vessie pou-
vant correspondre à des gonades. Le caryotype, là encore, a
révélé une formule XY, avec absence de mutation au niveau du
gène SRY. La recherche d’une duplication de DSS s’est égale-
ment révélée négative. Une laparotomie exploratrice a permis de
pratiquer une gonadectomie prophylactique. Lors de cette explo-
ration, ces gonades étaient surmontées d’une structure les cir-
conscrivant en casque et pouvant correspondre à une trompe
rudimentaire ou à un épididyme. L’histologie a retrouvé des
gonades rudimentaires, avec une ébauche de stroma ovarien et
un début de développement wolffien. Cette patiente a bénéficié
d’une périnéoplastie avec plastie vaginale permettant l’obtention
d’un vagin de 3-4 cm ; elle suit actuellement un traitement estro-
progestatif. Il s’agit donc d’une dysgénésie gonadique XY
mixte, comme le confirment l’absence d’organes génitaux
internes féminins (preuve d’une sécrétion d’hormone antimüllé-
rienne durant l’embryogenèse) et l’histologie, qui met en évi-
dence la trace d’un développement testiculaire.
Gènes de la détermination sexuelle :
à propos de deux observations
●
I. Leroux*
* Hôpital Necker, service du Pr Kuttenn, 149, rue de Sèvres, 75015 Paris.
O

RAPPEL DES ÉTAPES DE LA DIFFÉRENCIATION SEXUELLE
La différenciation sexuelle peut schématiquement être séparée
en deux étapes principales. La première est l’étape de déter-
mination gonadique ; elle est contrôlée par les gènes de la
détermination gonadique inclus dans le sexe génétique. La
deuxième est l’étape de différenciation sexuelle primaire.
Elle dépend de la sécrétion hormonale des gonades différen-
ciées et de la sensibilité des tissus cibles à ces sécrétions hor-
monales. Elle aboutit au sexe phénotypique (développement
des organes génitaux internes et externes).
La première étape de détermination sexuelle s’effectue à partir
de gonades indifférenciées bipotentielles qui vont se différen-
cier en testicule ou en ovaire, à partir de la sixième ou de la
septième semaine de vie intra-utérine chez l’homme (dixième
jour de gestation chez la souris).
On sait depuis le milieu du siècle (1959 : analyse du caryotype)
que le sexe gonadique est lié à la présence ou à l’absence de
chromosome Y, avec un effet dominant du chromosome Y quel
que soit le nombre de chromosomes X. En effet, les sujets XY,
XXY ou XXXY développent un phénotype masculin et les
sujets XO, XX ou XXX développent un phénotype féminin.
Chez la femme, la détermination gonadique est plus tardive
(figure 1). Elle a lieu en l’absence de chromosome Y et néces-
site la présence de deux chromosomes X.
Par ailleurs, les expériences du Pr Jost en 1950 ont mis en évi-
dence l’importance fondamentale de deux hormones sécrétées
par le testicule fœtal : l’hormone antimüllérienne et la testosté-
rone. Ces hormones sont indispensables à la différenciation
sexuelle dans le sens masculin (figure 2). L’hormone antimül-
lérienne (AMH) est produite par les cellules de Sertoli dès la
formation des tubes séminifères, avec un maximum d’activité
à la huitième semaine de gestation. Elle entraîne la régression
des canaux de Müller, responsable, chez la femme, du déve-
loppement de l’utérus, du tiers supérieur du vagin et des
trompes. La testostérone est sécrétée par les cellules de Leydig
à partir de la huitième semaine de gestation chez l’homme.
Elle induit le développement des structures génitales mâles à
partir des canaux de Wolff, qui formeront l’épididyme, les
canaux déférents et les vésicules séminales. La testostérone,
sous l’action de la 5α-réductase, se transforme en dihydro-
35
La Lettre du Gynécologue - n° 244 - septembre 1999
Sexe génétique
gènes de la détermination gonadique 1re étape : détermination gonadique
Sexe gonadique
± sécrétion hormonale 2eétape : différenciation sexuelle
Sexe phénotypique
Figure 1. Chronologie des différentes étapes de la différenciation sexuelle.
Âge
gestationnel
approx.
Développement
fœtal
(mm) GONADES
GONADE INDIFFÉRENCIÉE
Avec cellules germinales primordiales
TRACTUS GÉNITAL
Tubes séminifères
TESTICULE
60 jours
37-45 jours
43-50 jours
80 jours
11-12 sem.
20-25 sem.
0
10
20
30
40
50
60
70
80
90
100
110
120
200 ORGANOGENÈSE
OVARIENNE
Follicules primordiaux
Stroma
Cellules de Leydig
Début de la méiose
Sinus urogénital
Canaux müllériens
Régression
TRACTUS
GÉNITAL
FÉMININ
OGE
FÉMININS VAGIN
Organogenèse
vaginale
Organes génitaux
externes
PÉNIS PROSTATE

testostérone (DHT), qui induira la formation des organes géni-
taux externes chez l’homme (pénis, scrotum et prostate) à par-
tir du sinus urogénital.
L’effet du chromosome Y chez l’homme (et les mammifères)
est donc d’induire le développement du testicule qui, une fois
formé, va sécréter des hormones entraînant la différenciation
sexuelle dans le sens masculin. Ce rôle actif du chromosome Y
dans la détermination sexuelle a été attribué à la présence d’un
hypothétique gène unique appelé TDF (Testis Determining
Factor), qui a fait l’objet d’une longue recherche.
SRY : SEX-DETERMINING REGION Y CHROMOSOME GENE
Quête du gène de la détermination sexuelle :
TDF
L’étape cruciale dans la recherche du gène TDF a été l’analyse
moléculaire des hommes XX et des femmes XY (présentant
une dysgénésie gonadique pure). Cette analyse a permis de
démontrer que la majorité des hommes XX possédaient dans
leur génome des fragments d’ADN de longueur variable spéci-
fiques du chromosome Y, et que certaines femmes XY avaient
des délétions de fragments d’ADN correspondant à ceux
détectés chez la majorité des mâles XX.
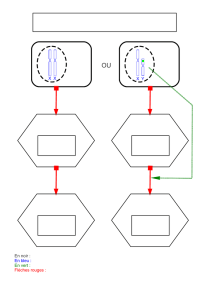
L’hypothèse proposée par Ferguson-Smith en 1966 s’avérait
exacte : les deux anomalies résultaient d’un échange méiotique
entre les deux chromosomes sexuels paternels (figure 3).
La partie du chromosome Y mobilisée dans un crossing-over
inclurait le locus TDF (cette hypothèse est en fait exacte pour
la majorité des hommes XX sans ambiguïté sexuelle et pour
une minorité de femmes XY).
Durant ces longues années de recherche, plusieurs gènes ont
été retenus, entre autres :
– Le gène HY, qui code pour un antigène du groupe sanguin
HY. Il a été proposé comme TDF en 1970. En fait, on s’est
vite aperçu que les mâles XX n’exprimaient pas HY. De plus,
HY était localisé sur le bras long du chromosome Y, alors qu’il
est vite apparu qu’il devait être localisé sur le bras court. Ce
n’était donc pas le bon candidat...
– Le gène ZFY (Zinc Finger Y), qui a été localisé par Page et
coll. sur le bras court du chromosome Y en 1987. Il avait de
nombreuses caractéristiques attendues du gène de la détermi-
nation sexuelle : il s’exprime dans les gonades mâles des sou-
ris avant la détermination gonadique, il est très conservé dans
l’évolution, et, par ailleurs, il code pour un facteur de régula-
tion (protéine à doigt de zinc) pouvant contrôler l’expression
d’autres gènes impliqués dans la différenciation testiculaire.
En fait, il s’est avéré que ZFY n’était pas le bon candidat non
plus, et ce pour plusieurs raisons : on a retrouvé un gène
homologue ZFX porté par le chromosome X ; ZFY est exprimé
dans de nombreux tissus en dehors des gonades ; chez les mar-
supiaux, ZFY est porté par les autosomes ; et, enfin, certains
mâles XX ne possèdent pas ZFY.
Par la suite, chez les patients mâles XX, a été mis en évidence
le transfert d’une très petite région du chromosome Y sur le
chromosome X, qui toutefois ne comportait pas ZFY. Ces
observations ont permis de définir un nouveau locus possible
pour le gène de la détermination testiculaire.
CAS CLINIQUE
36
La Lettre du Gynécologue - n° 244 - septembre 1999
Figure 2. Facteurs de l’induction testiculaire et de la différenciation
sexuelle masculine.
Chromosome
YDÉTERMINANT
GONADIQUE
YTESTICULE
Gonade
primitive
OVAIRE Cellules
de Sertoli Cellules
de Leydig
Canaux
de Wolff Dihydro-
testostérone
Épididyme
Déférent
Vesicules séminales Pénis
Scrotum
Facteur
antimüllérien
Régression des
canaux de Müller
Testostérone
Figure 3. Hypothèse de Ferguson-Smith.
Région
pseudo-autosomale TDF
Y
X
– TDF+ TDF
XY
Femme
XX
Homme

Le gène SRY a été identifié dans cette petite région distale du
chromosome Y adjacente à la région pseudo-autosomale par
Sainclair et coll. en 1990 (figure 4).
SRY = TDF
Plusieurs caractéristiques de SRY en font un excellent candidat
pour être le gène TDF : tout d’abord, c’est un gène conservé
chez la plupart des mammifères (essentiellement au niveau de
la boîte HMG) ; il est localisé sur le bras court du chromosome
Y ; il code pour une protéine se liant à l’ADN avec de pos-
sibles effets régulateurs sur la transcription des gènes (protéine
à domaine HMG - High Mobility Group) ; enfin, il est exprimé
au niveau de la crête génitale chez la souris entre J10 et J12,5
après fécondation, juste avant le développement des tubes
séminifères.
Les deux preuves principales ont été apportées par l’identifica-
tion de mutations simples sur le gène SRY des patientes XY
présentant une dysgénésie gonadique pure et par l’expérience
transgénique de Koopman et coll. en 1991. Cette expérience a
montré que l’injection d’un fragment d’ADN contenant l’ana-
logue murin de SRY chez des souris XX entraîne une inversion
de sexe chez ces souris.
Propriétés de SRY.SRY est un petit gène mono-exonique de
2 100 bases codant pour une protéine de 204 AA. Cette pro-
téine appartient à la famille des protéines à domaine HMG, qui
est un motif protéique de liaison à l’ADN. Ce domaine HMG
occupe une position centrale sur le gène SRY. Il a un rôle cru-
cial dans l’activité de SRY, comme en témoignent les diffé-
rentes mutations retrouvées chez les femmes XY, qui se
situent à son niveau (une seule mutation décrite en dehors de la
boîte HMG, figure 5).
La liaison du domaine HMG à l’ADN se fait par l’intermé-
diaire d’une séquence d’oligonucléotides bien définie
(AACAATG). Elle est responsable d’une altération de la géo-
métrie de l’ADN, avec torsion des doubles brins, qui pourrait
être à l’origine de la régulation de la transcription d’autres
gènes. Par cet effet de torsion, SRY rapprocherait des facteurs
protéiques et des séquences d’ADN jusque-là séparés, permet-
tant la réalisation d’un complexe multiprotéique transcription-
nel. Cette action est nécessaire à l’activité de SRY : les muta-
tions de SRY présentes chez les femmes XY altèrent plus cet
effet de torsion que la capacité de liaison à l’ADN.
Si, chez la souris, il a été montré que SRY avait un rôle d’acti-
vateur de la transcription, rien n’est démontré chez l’homme.
En 1993, Mc Elreavy et coll. ont émis l’hypothèse que SRY
serait un inhibiteur de la transcription. Cette hypothèse repose
sur l’analyse de la transmission des cas familiaux de mâle XX
avec ambiguïté et hermaphrodisme vrai qui ne porte pas SRY
(figure 6). L’analyse révèle la transmission d’une anomalie de
type autosomique récessif. Afin d’expliquer toutes les anoma-
lies possibles, Mc Elreavy a émis une hypothèse : SRY inhibe-
rait un gène Zqui, à l’état normal, réprimerait l’expression des
gènes spécifiques mâles. Dans les cas familiaux de mâles XX
sans SRY, la présence d’une anomalie au niveau du gène Z(à
transmission autosomique récessive) suffirait à expliquer le
morphotype masculin par l’absence de répression des gènes
masculins.
Chez les femmes XY, les mutations décrites jusqu’à présent
sur SRY sont situées au niveau du cadre de lecture. Il s’agit
essentiellement de mutations de novo, mais il existe aussi des
cas de transmission familiale père/fille. Ces exemples de péné-
trance variable plaident en faveur soit d’une expression
variable de la mutation, soit d’une interaction de SRY avec
d’autres allèles non liés à Y.
37
La Lettre du Gynécologue - n° 244 - septembre 1999
Figure 5. Hypothèse de Mc Elreavy pour la détermination sexuelle :
SRY antagonise Z, un inhibiteur des gènes spécifiques mâles.
A. Normal XY male
Z
SRY
On
Male-specific
genes
B. Normal XX female
C. XX male D. XY female
Z
Off
Male-specific
genes
Z i
SRY
Off
Male-specific
genes
Z –
On
Male-specific
genes
E. XY female with
DSS
duplication
DSS
Off
Male-specific
genes
SRY
DSS
Figure 4. Évolution des connaissances dans la localisation des gènes de
la détermination sexuelle.
Région
pseudo-
autosomale
1959
Yp
Yq
(140 kb) 60 kb
(140 kb)
TDF ZFY
SRY
1966 1986 1987 1989 1990
35 kb
Figure 6. Mutations de SRY décrites chez les patientes présentant une
dysgénésie XY.
1 58 137 204
HMG box
.G..S..DRVKRPMNAFIVWSRDQRRKMALENPRMRNSEISKQLGYQWKMLTEAEKWPFFQEAQKLQAMHREKYPNYKYRPRRKAKM...L..
XN LGI TX
2
21 29 27 17 10 14 11 X
17 T17 M
12X
16
X
15R
11 I
12 S28
FS
12 FS
13 W
17 X20
X14C19
10
18 60 70 80 90 100 110 120 130 163
T
18

En fait, l’analyse génétique des patients présentant un état inter-
sexué montre que seules 15 à 20 % des femmes XY avec dysgé-
nésie gonadique pure présentent une mutation de SRY et que
SRY est présent dans seulement 10 % des cas de mâle XX avec
ambiguïté sexuelle, dans 10 % des hermaphrodismes vrais et
chez 90 % des mâles XX sans ambiguïté. Même si les variations
phénotypiques observées chez les mâles XX peuvent s’expliquer
par des phénomènes d’inactivation de l’X, ces résultats sont en
faveur de l’implication d’autres gènes dans la détermination
sexuelle, qui agiraient en amont ou en aval de SRY.
AUTRES GÈNES IMPLIQUÉS DANS LA DÉTERMINATION
SEXUELLE
Des recherches ont été entreprises afin d’identifier les autres
gènes possiblement impliqués. Certains ont été découverts
grâce à l’étude génétique de patients présentant une pathologie
héréditaire associée à une forte prévalence de troubles de la
différenciation sexuelle. On retrouve des gènes liés au chromo-
some X et des gènes liés aux autosomes.
Gènes liés à l’X
Gène DSS (Dosage Sensitive Sex-reversal). Le gène DSS a été
annoncé comme le gène de la féminité par la presse généra-
liste. L’hypothèse de l’existence d’un gène lié à l’X impliqué
dans la détermination sexuelle vient de l’observation de cas
héréditaires de dysgénésie gonadique XY avec un mode de
transmission lié à l’X. C’est Bardoni et coll. qui, en 1994, ont
identifié un locus DSS de 160 kb localisé sur le bras court du
chromosome X (en position 21). Ce gène était dupliqué chez
des patientes XY n’ayant pas de mutation au niveau du gène
SRY. Une double “dose” de DSS aurait donc un effet inhibiteur
sur l’action de SRY, expliquant le phénotype féminin chez ces
patientes. Ce gène muté chez des femmes XX n’entraîne pas
de trouble de la différenciation sexuelle ; il n’aurait donc pas
de rôle dans la détermination sexuelle dans le sens féminin.
DAX 1
est un gène localisé à l’intérieur du locus de DSS
(Xp21-3). Il code pour un membre de la famille des récepteurs
nucléaires orphelins. Une mutation de ce gène est responsable
de l’hypoplasie congénitale des surrénales (AHC), qui touche
les hommes dans les premières semaines de vie. Cette affec-
tion est fréquemment associée à un hypogonadisme hypogona-
dotrope.
Il s’agit d’un gène candidat à un rôle dans la détermination
sexuelle puisque, entre autres, il est exprimé chez la souris au
niveau de la crête génitale à la période de détermination
sexuelle. Par ailleurs, son expression au moment de l’embryo-
genèse a lieu tout le long de l’axe gonadotrope (hypothalamus,
hypophyse, surrénale), ce qui explique sans doute la préva-
lence de l’hypogonadisme hypogonadotrope chez les sujets
présentant une mutation de DAX 1.
Cependant, son ou ses rôles sont mal connus. Il aurait un rôle
au niveau de la fonction des cellules de Sertoli. En effet, l’ana-
lyse des testicules chez les sujets présentant une AHC révèle
une absence de cellules germinales, avec immaturité des cel-
lules de Sertoli. Il aurait aussi un rôle dans le développement
ovarien puisque, chez la souris, son expression est maintenue
uniquement en cas de différenciation sexuelle dans le sens
féminin.
Pour certains, ces deux gènes, DSS et DAX 1, n’en représente-
raient qu’un seul : la surexpression de DAX 1 par transgène
chez la souris est en faveur de cette hypothèse puisque l’on
observe une inversion de sexe chez la souris XY (Swain et
coll., Nature 1998).
Gènes autosomiques
SOX 9 est un gène localisé sur le bras long du chromosome 17.
Il appartient à la famille des protéines SOX (SRY box contai-
ning). Cette famille comporte une homologie de séquence de
plus de 60 % au niveau de la boîte HMG avec le domaine
HMG de SRY. Une mutation de SOX 9 a été retrouvée chez des
patients atteints de dysplasie campomélique (anomalie de la
formation du cartilage), celle-ci étant fréquemment associée à
une dysgénésie gonadique XY. Cette mutation s’exprime sur le
mode hétérozygote dominant. Il semble que SOX 9, comme
SRY, joue un rôle dans la détermination sexuelle dans le sens
masculin puisque seuls les hommes atteints de dysplasie cam-
pomélique ont un trouble de la détermination sexuelle.
WT 1 est un gène localisé sur le bras court du chromosome 11.
Il a été initialement identifié comme oncogène responsable
d’une tumeur rénale (tumeur de Wilms) chez l’enfant.
Plusieurs arguments plaident en faveur de son implication dans
le développement gonadique :
– il est exprimé à J9 chez la souris au niveau de la crête géni-
tale ;
– on observe, chez la souris “knock-out” pour ce gène, une
agénésie rénale et gonadique, avec un possible rôle dans le
maintien des gonades au cours de l’embryogenèse ;
– par ailleurs, des mutations de WT1 ont été retrouvées chez
des patients présentant un syndrome de Denys-Drash et un
syndrome de Frasier associant ambiguïté sexuelle et anomalie
rénale.
SF 1 est un gène localisé sur le bras long du chromosome 9
(Chr.9q33). Il code pour un récepteur nucléaire orphelin qui a
un rôle clé dans la biosynthèse des stéroïdes.
Il semble qu’il ait aussi un rôle majeur dans le développement
gonadique et dans la différenciation sexuelle puisque, chez la
souris, l’absence de SF 1 entraîne une agénésie des surrénales
et des gonades. SF 1 aurait aussi un rôle dans la régulation de
l’AMH puisque, chez les souris XX et XY, l’absence de SF 1
entraîne le développement d’organes génitaux internes de type
féminin et qu’il existe une expression continue de SF 1 au
cours de l’embryogenèse dans le sens masculin.
Ces différents gènes ont été identifiés chez des patients présen-
tant une dysgénésie gonadique associée à une pathologie le
plus souvent sévère prédominante sur l’existence d’une ano-
malie de la détermination sexuelle. Ils n’ont pas été étudiés
chez les patients ou patientes présentant une dysgénésie gona-
dique isolée sans anomalie de SRY.
CAS CLINIQUE
38
La Lettre du Gynécologue - n° 244 - septembre 1999
 6
6
 7
7
1
/
7
100%