Synthèse de l`acide hippurique

Olympiades de la chimie Besançon 2013 : Synthèse de l’acide hippurique.
1
Synthèse de l’acide hippurique
I. Quelques informations sur cette molécule :
Document 1 : Extrait du compte rendu de l’académie des sciences de juillet à décembre 1853.
Document 2 :
L’acide hippurique est le produit métabolique résultant de la conjugaison hépatique d’un acide aminé, le glycocolle (ou
glycine), avec l’acide benzoïque. Ce dernier est un produit exogène provenant de l’alimentation (certains végétaux en
sont très riches) ou de certains traitements médicamenteux (antitussifs à base de benzoate de sodium ou
psychostimulants à base de para-aminobenzoate de magnésium). L’acide benzoïque peut être également produit par
l’organisme au cours de l’oxydation du toluène inhalé, en particulier chez des sujets professionnellement exposés, ou
accidentellement ingéré.
http://www.lab-cerba.com/pdf/0061F.pdf

Olympiades de la chimie Besançon 2013 : Synthèse de l’acide hippurique.
2
Document 3 : Extraits adaptés de la fiche wikipedia.
Généralités :
L'acide hippurique est un dérivé d’acide aminé: l'acide paraamino-hippurique. Cette dernière est une molécule qu'on
trouve dans l'urine des chevaux (d'où son nom), ainsi que dans celle d'autres herbivores. C'est une molécule surtout
connue pour les tests urinaires. En effet, l'acide paraamino-hippurique (PAH) est utilisé pour détecter des insuffisances
rénales.
C'est un composant qui est trouvé en grande quantité dans les urines des herbivores. Chez l'homme il se forme après
inhalation de toluène, qui sera métabolisé dans le foie et transformé en partie en acide benzoïque.
Historique :
Justus von Liebig a montré en 1829 que l'acide hippurique différait de l'acide benzoïque et en 1839 détermina sa
constitution, alors qu'en 1853, Victor Dessaignes le synthétisa pour la première fois en faisant réagir du chlorure de
benzoyle sur un sel de zinc de glycine. Il a aussi été synthétisé plus tard en chauffant de l'anhydride benzoïque avec de la
glycine, ou en chauffant du benzamide avec de l'acide chloroacétique.
http://fr.wikipedia.org/wiki/Acide_hippurique
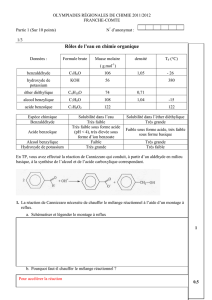
Document 4 : informations sur les substances utilisées lors de la séance.
Nom / formule :
Masse
molaire en
g.mol-1
Densité à
20°C
Tfusion
en °C
Tébullition
en °C
Solubilité
toxicologie
Glycine
NH2
O
OH
75,1
232 - 236
Peu soluble dans l’eau.
Soluble en solution
aqueuse basique.
Acide
benzoïque
pKa = 4,2
O
OH
122,1
122 – 123
249
Soluble à froid dans l’éther
diéthylique.
Très peu soluble à froid
dans l’eau
H302 H319
Chlorure de
benzoyle
O
Cl
140,6
1,212
-1,0
198
H302+H312+H332 H314
H317
Solution d’acide
chlorhydrique à
environ 1
mol.L-1
1,09
H314 H335
Acide
hippurique
O
NH
O
OH
179,2
187 - 188
Peu soluble à froid dans
l’eau, soluble à chaud.
Très peu soluble dans
l’éther diéthylique.
Ethoxyéthane
(éther
diéthylique)
74,1
0,714
-116
35
Ethanoate
d’éthyle
(acétate
d’éthyle)
88,1
0,924
-83
77

Olympiades de la chimie Besançon 2013 : Synthèse de l’acide hippurique.
3
Document 5 : spectre IR de l’acide hippurique et de la glycine (phase solide, pastille de KBr)
Spectre A :
Spectre B :

Olympiades de la chimie Besançon 2013 : Synthèse de l’acide hippurique.
4
Document 6 : spectre RMN de l’acide hippurique
Document 7 : Déplacements chimiques en spectroscopie RMN

Olympiades de la chimie Besançon 2013 : Synthèse de l’acide hippurique.
5
Document 8 :Bandes caractéristiques en spectroscopie IR
II. Mode opératoire :
1. Synthèse :
- Préparer un montage à reflux avec un ballon bicol, un réfrigérant et un agitateur magnétique.
- Introduire environ 20 mL de solution saturée d’hydrogénocarbonate de sodium dans le ballon.
- Peser une masse m = 1,00 g de glycine et l’introduire également dans le ballon.
- Mettre sous agitation vigoureuse.
- Ajouter, dans le ballon, goutte à goutte environ 1 mL de chlorure de benzoyle (mesuré grossièrement à la
pipette pasteur). On observe alors une effervescence.
- Laisser agiter à température ambiante pensant environ 45 minutes.
Pendant ce temps, commencer à répondre aux questions posées à la suite de cet énoncé. Ne pas hésiter à demander de
l’aide aux professeurs !
Au bout d’environ 45 minutes :
- Acidifier le mélange réactionnel avec 25 mL de solution d’acide chlorhydrique et vérifier si on a pH = 1. Il se
forme alors des cristaux (d’acide hippurique et d’acide benzoïque) dans le ballon.
- Filtrer l’ensemble sur Büchner (attention, la solution est acide !)
- Arrêter l’aspiration et prélever une pointe de spatule de ces cristaux et les mettre dans un tube à hémolyse
(tube n°1) contenant un fond d’acétate d’éthyle.
- Ajouter environ 5 mL d’éther diéthylique dans le büchner et mélanger bien avec les cristaux. Remettre en
marche l’aspiration, puis renouveler l’opération une fois. (récupérer l’éther diéthylique dans un bidon.)
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%