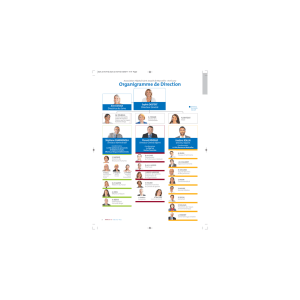
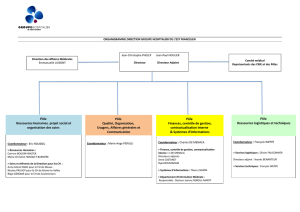
RappoRt d`activité 2008
publicité

RappoRt d'activité 2008 Impulser la recherche clinique Sommaire La lettre du Président 4 L’interview de la Directrice Scientifique 6 Bilan des inclusions en 2008 9 Groupe tumeurs 13 Groupe tumeurs ACCORD(Digestif) 14 Groupe tumeurs FEDEGYN 28 Groupe tumeurs GERICO(Oncogériatrie) 30 Groupe tumeurs GETUG(Urologie) 34 Groupe tumeurs poumon 44 Groupe tumeurs sarcome 48 Groupe tumeurs sein 58 Groupe des Essais Précoces 74 Pharmacovigilance 80 Publications 84 Collaborations 86 Activité Recherche Clinique des Centres de Lutte Contre le Cancer (CLCC) 90 Observatoire du médicament 96 Recherche translationnelle 102 Fédération des Comité de patients en Recherche clinique en Cancérologie (FCPRCC) 106 Organigramme et contacts 108 Le BECT • ACCORD : Actions concertées dans les cancers Colorectaux et Digestifs • AFSSAPS : Agence Française de Sécurité Sanitaire des Produits de Santé • AMM : Autorisation de Mise sur le Marché • ARC : Assistant de recherche clinique • ASCO : American Society of Clinical Oncology • BECT : Bureau d’Études Cliniques et Thérapeutiques • BPC : Bonnes Pratiques Cliniques • CADUSEIME : Cancer du sein métastatique • Carmina : Carcinome mammaire innovation en néo-adjuvant • CLCC : Centre de Lutte contre le Cancer • CNIL : Commission Nationale de • EIG : Evènement Indésirable Grave • EORTC : European Organisation for Research and Treatment of Cancer • EMEA : European Agency for the Evaluation of Medical Products • ESMO : European Society for Medical Oncology • [18F]-FLT : 3’-désoxy-3’- Fluoro[18F]-Fluoro-thymidine • FCPRCC : Fédération des Comités de Patients en Recherche Clinique en Cancérologie • FEC : Fluoro uracile, Epirubicine, Cyclophosphamide • FFCD : La Fédération Francophone de Cancérologie Digestive • FNCLCC : Fédération Nationale des Centres de Lutte contre le Cancer • GEP : Groupe Essais Précoces l’Informatique et des Libertés • GERICO : Gériatrie Oncologie • COS : Comité d’orientation • GETUG : Groupe d’Études des • COPIL : Comité de pilotage • GIST : Gastro Intestinal Stromal stratégique • CPP : Comité de Protection des Personnes • DHOS : Direction de l’Hospitalisation et de l’Organisation des Soins Tumeurs UroGénitales Tumors • IDMC : Independant Data and Monitoring Comittee • INCa: Institut National du Cancer • DRC : Direction de la Recherche • IMRT : Intensity-Modulated Clinique • ITT : Intention de Traitement Bureau d’Études Cliniques et Thérapeutiques • LNCC : Ligue Nationale contre le Cancer • MERRI : Missions de Recherche, de Référence et d’Innovation • PAC : Programme d’Actions concertées • PACS : Programme adjuvant cancer du sein • PEGASE : Programme d’évaluation des greffes autologues dans le cancer du sein • PHRC : Programme Hospitalier de Recherche Clinique • PRODIGE : Partenariat de Recherche en Oncologie Digestive • SUSAR : Suspected Unexpected Serious Adverse Reaction • RE : Récepteur de l’Estradiol • RP : Récepteur de la Progestérone • TEP : Tomodensitométrie par émission de Positons • TMA : Tissue Micro Array • TGNS : Tumeurs germinales non séminomateuses • URC : Unité de recherche Clinique • VEGF : Vascular Endothelial Créé en 1994, le Bureau d’Etudes Cliniques et Thérapeutiques (BECT) est avant tout un opérateur de recherches cliniques en cancérologie. Il fédère les unités de recherche clinique des 20 Centres de lutte contre le cancer (CLCC). Il est soutenu financièrement par un partenaire caritatif unique : la Ligue nationale contre le cancer. L’objectif du BECT est de développer une recherche clinique et translationnelle, à la fois pertinente et rigoureuse, dans le but d’améliorer les traitements contre le cancer et la prise en charge des patients. Sa stratégie de recherche privilégie les domaines moins exploités par l’industrie pharmaceutique tels que les pathologies orphelines (sarcome, canal anal…) ou ceux concernant certaines catégories de la population telles que les personnes âgées atteintes d’un cancer. En dehors de la recherche clinique proprement dite, le BECT assure différentes missions auprès des centres. Ainsi il a créé en 1998, en partenariat avec la Ligue nationale contre le cancer, les Comités de Patients pour la Recherche clinique en cancérologie (CPRCC) afin de favoriser l’implication des malades dans la recherche clinique sur les cancers. Le BECT a également mis en place en 2004 l’Observatoire du médicament pour apprécier la pertinence des prescriptions dans les CLCC. Growth Factor Radiation therapy Principaux sigles 4 RappoRt d'activité 2008 Fédération Nationale des Centres de Lutte Contre le Cancer RappoRt d'activité 2008 5 Bureau d’Études Cliniques et Thérapeutiques La lettre Professeur Thomas Tursz, D.R. Président de la FNCLCC et du BECT Le BECT, l’innovation “ au service des patients ” Plus qu’un regroupement d’établissements, la Fédération Nationale des Centres de Lutte Contre le Cancer regroupe avant tout des professionnels de la cancérologie partageant une même vision de leur discipline. Cette communauté de pensée et d’action au service des malades repose sur des valeurs telles que la multidisciplinarité, la prise en charge globale et la recherche permanente de l’innovation. Ces mêmes valeurs président à la mise en œuvre de la recherche clinique que nous menons au travers du Bureau d’Etudes Thérapeutiques et Cliniques. Le BECT est aujourd’hui un véritable opérateur de recherches, à même de répondre aux nombreux défis scientifiques et médicaux auxquels notre discipline doit répondre. Avec l’arrivée des thérapeutiques ciblées et des nouveaux outils que sont la génétique moléculaire, la génomique et la protéomique, les méthodologies de la recherche ont évolué. L’objectif d’un essai n’est plus simplement de démontrer que tel médicament est supérieur ou équivalent à tel autre. Il est aussi de mieux comprendre la biologie des cancers afin de déterminer les mécanismes qui conduisent à ce qu’un médicament soit efficace chez un patient et pas chez un autre. L’essai thérapeutique est ainsi devenu en soi, un outil de recherche et de décryptage de l’hétérogénéité des réponses thérapeutiques observées chez nos patients. Cette démarche nous permet de faire évoluer l’approche de la prise en charge : de traitements standards, qui conduisent dans un certain nombre de cas à sur ou à sous- 6 RappoRt d'activité 2008 Bureau d’Études Cliniques et Thérapeutiques traiter les patients, il nous faut tendre vers une prise en charge thérapeutique véritablement individualisée qui tienne compte à la fois des mécanismes d’action des médicaments et des caractéristiques des patients vis-àvis des critères identifiés de réponse et de non-réponse. La recherche translationnelle est la voie vers cette approche. C’est pourquoi nous nous sommes résolument engagés à mettre en place et à soutenir ce type de recherche dans le maximum de nos essais. Pour autant, les questions posées sont complexes ; elles nécessitent des moyens importants et des engagements sur le long terme. Chercher et si possible trouver des réponses ne peut être le fait de cliniciens ni même de centres isolés. De telles recherches reposent inévitablement sur des équipes structurées disposant de ressources suffisantes en terme de recueil, de validation et d’analyse des données. Le BECT est reconnu comme étant pleinement opérationnel pour coordonner des équipes de recherche sur le terrain, tout en assurant le data management et le contrôle qualité. La recherche translationnelle suppose également une utilisation rationnelle des banques de tumeurs et des centres de ressources biologiques, lesquels doivent disposer des outils nécessaires pour réaliser les études adéquates. Ainsi, l’infrastructure de la recherche translationnelle ne peut être disséminée sur tout le territoire. Un nouveau maillage non seulement des patients mais aussi de la circulation des prélèvements tumoraux et des outils de diagnostic est indispensable. Le BECT est clairement le nœud qui doit permettre ce maillage entre les patients, les ressources biologiques, les plates-formes technologiques et les équipes cliniques. La qualité des études cliniques ne repose plus aujourd’hui uniquement sur celle du recueil des données. Elle intègre également la qualité des prélèvements, de leur cheminement, des plateaux techniques, des outils d’analyse. Les ressources dont dispose le BECT et le professionnalisme de ses équipes sont en mesure de répondre à ces nouvelles complexités dans la réalisation des essais. Enfin, à l’évidence, la coopération est plus que jamais nécessaire. Plutôt que la compétition et la concurrence entre équipes et groupes, ce sont de synergies dont nous avons besoin. Ces dernières années, nous avons mis en place différents partenariats, avec notamment la Fédération de Cancérologie des CHU et la Fédération Française de Cancérologie Digestive. En 2008, les coopérations ont été renforcées non seulement avec ces deux fédérations, mais aussi avec d’autres groupes académiques tels que : l’Association Française d’Urologie, l’Intergroupe Francophone de Cancérologie Thoracique et le Groupe Français des Sarcomes. De même, le BECT va devenir le bureau de liaison de l’European Organisation for Research and Treatment of Cancer (EORTC) pour l’ensemble des centres investigateurs français, qu’ils soient ou pas des CLCC. Cela nous permet d’assurer une meilleure coordination et représentation des centres qui participent aux essais stratégiques de l’EORTC. La mise en place de ces différentes coopérations a contribué au saut quantitatif de l’activité du BECT en 2008. Les 52 études en cours de réalisation représentent une population théorique de 21 000 patients à inclure. Surtout, le nombre de patients réellement inclus a fait un bond de 86%, passant de 1188 en 2007 à 2212 en 2008. Cela témoigne de la place acquise par le BECT et la FNCLCC en tant qu’opérateur majeur de la recherche clinique en France. Ces chiffres indiquent aussi que nous avons dépassé les 10% de patients de la file active inclus dans des essais, objectif affiché par le Plan Cancer. Les CLCC sont actuellement les seules structures qui, globalement, présentent un tel taux d’inclusion. Notre but est d’aller encore plus loin, pour atteindre 15%. Ces avancées sont également le fruit du travail de toutes celles et de tous ceux qui se sont impliqués, à un titre ou un autre, dans les activités du BECT. Pour les aider dans leur engagement, nous avons entrepris un certain nombre d’évolutions structurelles. Ainsi, le Comité d’Orientation Stratégique, qui impulse la politique scientifique de la Fédération, a été élargi et, dans une certaine mesure, rajeuni, afin d’être encore plus représentatif des acteurs de la recherche en cancérologie. De même, les groupes coopérateurs seront rénovés dans leur organisation afin de leur permettre d’être plus efficients. Enfin, le BECT a été doté d’une directrice scientifique, en la personne du Dr Jocelyne Bérille. Sa double culture académique et industrielle, son parcours marqué par le souci constant du professionnalisme et de l’innovation sont autant de qualités dont le BECT bénéficie désormais. Toute notre démarche refonde la vision transversale de la cancérologie. Celle-ci repose sur la multidisciplinarité mais aussi sur un continuum qui va du soin à la recherche, et qui renforce le concept dont les CLCC ont voulu être les préfigurateurs en France, les Comprehensive Cancer Centers. A ce titre, le BECT et tous les Centres jouent un rôle essentiel pour faire que l’innovation soit menée en France et en Europe de façon utile, rationnelle et évaluée, et soit ainsi accessible le plus rapidement possible et de manière égalitaire aux patients. En guise de conclusion, je tiens à dire que je considère le BECT comme l’un des plus beaux enfants de la Fédération. C’est le lieu où s’épanouissent toutes les valeurs de celle-ci. Il m’apparaît être l’incarnation de la Fédération en action. C’est au sein du BECT que se déclinent l’ensemble des programmes de la Fédération auprès des malades, autour des bonnes pratiques, de la qualité, de l’évaluation, de l’innovation, de la prise en charge globale et de la participation des patients à leur propre prise en charge. Professeur Thomas Tursz RappoRt d'activité 2008 7 Bureau d’Études Cliniques et Thérapeutiques Docteur Jocelyne Bérille directrice scientifique de la FNCLCC et du BECT L'interview Docteur Jocelyne Bérille, Il s’agit d’essais dans des Directrice Scientifique de la FNCLCC et du BECT D.R. l’une dans le traitement des GIST (Gastro-Intestinal Stromal Tumors) avec l’EORTC, qui a inclus 908 patients, l’autre dans celui du sarcome d’Ewing incluant des enfants (EUROEWING), qui compte fin 2008, 2570 inclusions. tumeurs rares ou des pathologies orphelines. C’est une des priorités du BECT ? Des priorités de recherche axées autour des patients. Opérateur de recherches de la FNCLCC, le BECT a pour mission de mener des études cliniques et translationnelles à la fois rigoureuses et pertinentes afin d’améliorer le traitement des cancers et la prise en charge des patients. L’année 2008 a été notamment marquée par une forte augmentation des inclusions dans les essais, explique le Dr Jocelyne Bérille, directrice scientifique. Quel est le bilan chiffré de Comment s’explique cette ont l’année 2008 ? augmentation du nombre rapport • Nous avons promu cinq nou- de patients inclus ? cette pathologie. De même, veaux essais, tout en poursuivant la réalisation de 52 essais en cours d’activité, dont 30 sont en phase de recrutement. Il faut noter que le nombre de patients inclus dans nos études a augmenté de 86 %, passant de 1188 en 2007, à 2212 en 2008. • Le recrutement dans certaines études est très important. un an au d’avance par calendrier initial, ce qui est remarquable pour dans l’essai ACCORD 12/ la Fédération Française de • Nous nous attachons à évaluer des traitements demandant une expertise particulière. Cela a conduit à la mise en place en 2008 de l’étude ACCORD 15/ PRODIGE 5 qui étudie l’apport de la chimio-hyperthermie peropératoire, une technique • C’est l’un des grands axes de notre développement et nous sommes fiers d’être le deuxième recruteur de l’essai international MINDACT qui compare, chez des patientes avec un cancer du sein opéré, deux modes de prise en charge ; celui-ci est radio- 598 patients ont été inclus, dans date prévue. Autres exemples, du groupe PRODIGE. Ainsi, les inclusions nous de environ 30 % des inclusions dans l’étude ACCORD 11/ avons PRODIGE 4 dans le cancer deux du auxquelles 8 RappoRt d'activité 2008 Bureau d’Études Cliniques et Thérapeutiques pancréas métastatique Le BECT est également actif translationnelle ? par néo-adjuvante avec six mois d’avance sur la cadre un traitement préventif de ce cancer par hormonothérapie chez des femmes ménopausées présentant une mutation BRCA 1 ou 2. Nous participons également à une large étude, Oncogenesis, chez les femmes dont une proche parente a présenté un cancer du sein. orientations du BECT ? traitement Cancérologie Digestive (FFCD) le ” d’un dans le cancer du rectum, avec supplémentaires et 30 études en cours de recrutement en matière de recherche deux réalisés • Tout à fait et nous suivons en cela les orientations stratégiques définies dans le cadre de notre partenariat avec la Ligue nationale contre le cancer, qui est notre partenaire caritatif unique. Ces orientations prévoient également de développer les recherches sur les populations dites orphelines. Le groupe GERICO, consacré aux patients âgés, a ainsi inclus 300 patients dans 6 études ces dernières années. Quelles sont les autres chimiothérapie contribué études pour internationales nous participons, déterminé soit en fonction de la signature génomique de la tumeur, soit selon les facteurs pronostiques déjà connus et décrits. Cette étude prévoit le recrutement de 6000 patientes dont 600 en France. Elle permettra à terme de mieux sélectionner les patientes qui bénéficieront d’une chimiothérapie post-opératoire. Parallèlement, la mise en place du Groupe d’Essais Précoces (GEP) a permis d’établir des partenariats rapprochés avec différentes firmes pharmaceutiques, ce qui nous permet d’avoir accès à des molécules innovantes et à de la recherche de transfert. “2008 : 86% d’inclusions PRODIGE 2, qui étudie l’apport C’est notamment le cas dans essais très pointue, dans le traitement des carcinoses péritonéales d’origine colorectale. De même, le BECT participe à une étude internationale de radiothérapie adjuvante post-chirurgicale chez des patientes de moins de 50 ans présentant des facteurs pronostiques défavorables ; et nous nous intéressons aux traitements de prévention, notamment dans le cancer du sein. Ainsi, une étude a été ouverte en 2008 pour proposer L'interview La comparaison de stratégies thérapeutiques n’est-elle pas aussi l’une de vos priorités ? • C’est effectivement le cas. Quatre études sont particulièrement représentatives de la réactivité du BECT dans ce domaine avec un taux d’inclusion nettement en avance sur le calendrier initial : ACCORD 11 et ACCORD 12 dont j’ai déjà parlé ; GETUG 16, une grande étude comparant l’ajout d’une hormonothérapie à la radiothérapie exclusive dans les traitements de rattrapage de rechute du cancer de la prostate ; enfin, ACCORD 13 qui compare deux traitements de chimiothérapie chez des patients atteints d’un cancer colorectal métastatique. RappoRt d'activité 2008 9 Bureau d’Études Cliniques et Thérapeutiques L'interview Docteur Jocelyne Bérille directrice scientifique de la FNCLCC et du BECT La mise en place de partenariats se poursuit-elle ? • Nombre d’études récentes lancées par le BECT sont le fruit de coopérations étroites avec d’autres groupes académiques, ce qui explique l’accroissement remarquable des inclusions dans nos essais en 2008. En particulier, nous pouvons citer l’Association Française d’Urologie, le Groupe des Sarcomes Français et la FFCD (partenariat PRODIGE). Par ailleurs, nous avons poursuivi une ouverture vers d’autres structures de soins. A l’heure actuelle, 30 % des patients inclus dans nos essais l’ont été en dehors des CLCC. Enfin, nous poursuivons le développement de partenariats à l’international, notamment avec l’EORTC dans le cadre des essais MINDACT pour le cancer du sein et LUNGART pour le cancer du poumon. De même, des centres belges et américains ont rejoint en 2008 l’essai PACS 08 qui évalue un traitement adjuvant séquentiel du cancer du sein chez des patientes dites « triples négatives ». du BECT, notamment le pôle pharmacovigilance qui compte désormais 5 personnes, et la création du poste de directeur scientifique. Notre Comité d’Orientation Stratégique a aussi été élargi pour être plus représentatif de toutes les spécialités, ce qui permet d’avoir une vision plus globale sur nos essais en cours ou à venir. Ces évolutions témoignent de notre volonté de toujours mieux répondre à nos missions, mais aussi d’une reconnaissance accrue de la pertinence et de l’efficacité du BECT en matière de recherche clinique par la DHOS comme centre d’investigation clinique éligible à la production et au financement des MERRI Comment définiriez-vous la place du BECT, aujourd’hui, dans le champ de la cancérologie ? • Tout d’abord, il faut souligner le renforcement des équipes ” 10 RappoRt d'activité 2008 Bureau d’Études Cliniques et Thérapeutiques 2008 Cinq nouveaux protocoles d’essais cliniques ont été mis en place en 2008 “ Le BECT a été reconnu en oncologie. Rappelons, par exemple, que le BECT a été reconnu par la Direction de l’Hospitalisation et de l’Organisation des Soins comme un centre d’investigation clinique éligible à la production et au financement des Missions de l’Enseignement, de Recherche, de Référence et d’Innovation (MERRI). Nos engagements de plus en plus forts dans des essais internationaux et l’implication de centres européens ou américains dans nos études en sont une autre illustration. Le bilan des inclusions du BECT D’ailleurs, la FNCLCC a donné son accord pour héberger le bureau de liaison de l’EORTC (European Organisation for Research and Treatment of Cancer) dès 2009. Ce bureau aura la charge de mettre en place en France toutes les études promues par l’EORTC. A mon sens, le BECT est devenu un acteur majeur de la recherche en cancérologie, en sachant que notre préoccupation première reste les patients. N° PROTOCOLE Titre abrégée ACCORD 15/0608 CHIP ONCO 03/0701 (LIBER) LIBER ACCORD 17/0707 PRODIGE 5 GEP 04/0606 RADHER PACS 09/0802 BEVERLY 1 N° EudraCT/ Réf AFSSAPS 2006006175-20 Titre essai Produits Essai de phase III évaluant la place de la chimiohyperthermie intrapéritonéale peropératoire (CHIP) après résection maximale d’une carcinose péritonéale d’origine colorectale associée à une chimiothérapie systémique. Eloxatine® (oxaliplatine) Calcium lévofolinate (acide folinique) Fluorouracile 2007-000687- Prévention du cancer du sein par le Fémara® (létrozole) 24 Létrozole chez la femme ménopausée porteuse d’une mutation BRCA 1/2 040756 Etude de phase II-III comparant la FOLFOX radiochimiothérapie avec le Folfox 4 Fluorouracile à la radiochimiothérapie à base de CISPLATINE 5FU-Cisplatine (schéma Herskovic) en traitement de première ligne du cancer de l’oesophage inopérable. Date d'ouverture de l'essai (ou 1ère MEP) 4/02/08 8/02/08 12/03/08 2007-004098- A phase II, randomized, multi-center Herceptin® (trastuzumab) 24 study, assessing value of adding RAD 001 RAD 001 (everolimus) to trastuzumab as peroperative therapy of HER-2 positive primary breast cancer amenable to surgery. 14/04/08 2008-001807- Essai de phase II d’évaluation de l’efficacité 53 et de la tolérance du bevacizumab (AVASTIN®) dans les cancers du sein inflammatoire HER2-. 17/12/08 Avastin® (bevacizumab) Farmorubicine® (epirubicine) Endoxan® (cyclophosphamide) Taxotère® (docétaxel) Fluorouracile Le nombre total de patients inclus sur l’ensemble des programmes de recherche du BECT, ouverts aux inclusions, a été de 2213 patients pour l’année 2008. RappoRt d'activité 2008 11 Bureau d’Études Cliniques et Thérapeutiques NOMBRE DE PATIENTS INCLUS par les clcc évolutions des inclusions dans les essais promus par le bect de 2006 à 2008 2500 • L’évolution des inclusions sur les trois dernières années est décrite dans l’histogramme ci-contre. SITES INVESTIGATEURS (CLCC) 2213 ANGERS 1500 Institut Bergonié 1489 BORDEAUX 1363 1188 Centre François Baclesse 1000 CAEN 926 Centre Jean Perrin 725 CLERMONT-FERRAND 500 Nbre total patients inclus essais clinique Centre Georges-François Leclerc Nbre total patients inclus par CLCC DIJON 0 2006 2007 Centre Oscar Lambret 2008 LILLE Centre Léon Bérard LYON • Félicitations à l’ensemble des centres ! Le nombre total des inclusions dans les recherches biomédicales du BECT est en augmentation de plus de 100 % (725 patients inclus en 2007 contre 1489 patients inclus en 2008) par rapport à l’année 2007 qui avait été une année en demi-teinte du fait de l’absence d’ouverture d’essais dans les cancers du sein. Institut Paoli-Calmettes MARSEILLE Centre Val d'Aurelle MONTPELLIER Centre Alexis Vautrin NANCY Centre René Gauducheau Forte participation des CLCC Comme pour les années précédentes, la répartition des inclusions par CLCC et par type de structure illustre toujours la forte participation des CLCC, avec 67% d’inclusions dans les essais du BECT. NANTES Centre Antoine Lacassagne NICE Institut Curie PARIS NOMBRE DE PATIENTS INCLUS DANS UN ESSAI EN 2008 PAR TYPE DE STRUCTURES % Institut Jean Godinot REIMS Totaux Groupes tumeurs + GEP Patients Groupes tumeurs ACCORD GERICO GETUG POUMON Centre Eugène Marquis SARCOME SEIN Dont essai GENESIS GEP RENNES Centre Henri Becquerel ROUEN Centres de lutte contre le cancer (CLCC) 1489 67,28 177 15 328 10 149 777 240 33 Centres hospitaliers (CH, CHG, CHR, CHU, CHRU) 328 14,82 106 0 75 6 65 72 38 4 Etablissements privés (cliniques, polycliniques, centres hors CLCC) 264 11,93 63 0 129 5 6 61 8 0 Assistance publique 89 4,02 25 0 28 4 14 13 12 5 Institut Gustave Roussy Internationnal 43 1,94 0 0 6 0 0 37 0 0 VILLEJUIF 2213 100 371 15 566 25 234 42 Total Total Groupes tumeurs ACCORD GERICO GETUG POUMON SARCOME SEIN 2000 Centre Paul Papin SITES INVESTIGATEURS Totaux Groupes tumeurs + GEP Centre René Huguenin SAINT-CLOUD Centre Paul Strauss STRASBOURG 12 RappoRt d'activité 2008 Bureau d’Études Cliniques et Thérapeutiques 960 Institut Claudius Regaud TOULOUSE Dont essai GEP GENESIS 30 0 0 10 0 0 20 0 0 86 13 0 25 0 10 38 16 0 82 12 0 12 0 4 52 9 2 22 0 0 0 0 1 21 3 0 61 6 0 7 0 1 44 1 3 65 11 0 2 2 15 33 33 2 106 23 0 26 0 31 25 14 1 32 3 0 10 0 2 15 0 2 86 35 0 43 0 4 4 4 0 51 19 0 18 0 1 13 0 0 82 9 0 17 0 8 44 21 4 69 9 7 14 2 3 33 11 1 195 0 0 39 0 31 122 43 3 31 0 0 8 0 0 23 0 0 82 10 0 30 1 5 35 8 1 33 0 0 17 0 2 14 7 0 67 1 0 3 0 0 60 33 3 17 6 0 0 4 0 7 3 0 71 6 0 12 0 10 39 12 4 221 14 8 35 1 21 135 22 7 1489 177 15 328 10 149 777 RappoRt d'activité 2008 13 Bureau d’Études Cliniques et Thérapeutiques 33 Les groupes tumeurs D ans son rôle de promoteur académique, le BECT en collaboration avec la Ligue Nationale Contre le Cancer, met en place et suit des études cliniques dans le cadre de Groupes Tumeurs (anciens Programmes d’Actions Concertées / PAC). Ces groupes tumeurs correspondent à un portefeuille d’essais définissant des approches stratégiques différentes dans une pathologie d’organe. Ils sont en 2008 au nombre de sept : • Groupe tumeurs ACCORD (Actions dans les Cancers ColoRectaux et Digestifs) dans les cancers digestifs • Groupe tumeurs GERICO (Programme Gériatrie en Oncologie) pour les cancers du patient âgé • Groupe tumeurs GETUG (Groupe d’Etudes des Tumeurs Uro-Génitales) dans les cancers uro-génitaux • Groupe tumeurs FEDEGYN pour les cancers gynécologiques (ovaire, utérus) • Groupe POUMON dans les cancers broncho-pulmonaires • Groupe SARCOME dans les sarcomes • Groupe SEIN dans les cancers du sein, subdivisé en groupes d’études : PEGASE (Programme de Greffes Autologues dans le cancer du SEin) – CARMINA (CARcinome Mammaire Innovation NéoAdjuvant) – PACS (Programme Adjuvant dans le Cancer du Sein), CADUSEIME (CAncer DU SEIn MEtastatique). s upe gro Les eurs tum AN CIEN PAC ACCO RD Coordonnateur du Groupe Pr Thierry CONROY, Centre Alexis Vautrin, Nancy Groupe tumeurs ACCORD(Digestif) Groupe tumeurs ACCORD Etudes ouvertes aux inclusions en 2008 PRODIGE 7 : ACCORD 15/0608 : CHIP (Digestif) Investigateur coordonnateur : Dr François Quenet, Centre Val D’Aurelle, Montpellier. L e groupe « tumeurs digestives » de la FNCLCC, à travers les études promues par le BECT, priorise les essais pluridisciplinaires, qui associent les oncologues médicaux, les gastro-entérologues, les radiothérapeutes, les chirurgiens, les anatomopathologistes, etc. Il souhaite mener des études de phases II innovantes susceptibles de servir secondairement de base de discussion pour préparer des études de phase III au sein de PRODIGE (partenariat FNCLCC-FFCD pour les études randomisées). Le PRODIGE permet ainsi d’élaborer et de mettre en œuvre de grandes études nationales et internationales. Grâce à un rythme soutenu en matière d’inclusions (exemples : Accord 11 et Accord 12), les réponses à des questions stratégiques de cancérologie digestive peuvent être publiées rapidement. Par ailleurs, le lancement récent d’études de phase II ou III dans des pathologies plus rares telles que le canal anal, les cholangiocarcinomes, ou les carcinoses péritonéales, ou encore d’études associées à de la recherche translationnelle, permettent d’accroître la légitimité du groupe. Coordonnateur du Groupe Pr Thierry CONROY, CONTACTS au 1er JUIN 2009 Groupe tumeurs ACCORD Chef de Projets 16 RappoRt d'activité 2008 Bureau d’Études Cliniques et Thérapeutiques Assistante de Projets Anne-Chantal LE GALL tél. 01 44 23 04 13 [email protected] La carcinose péritonéale (CP) complique l’histoire naturelle du cancer colorectal dans environ 10 % des cas de façon synchrone et 25 % de manière métachrone. Bien que parfois associée à d’autres localisations métastatiques, elle en est la seule émanation métastatique dans 25 à 35 % des cas. Jusqu’à une période récente, seuls les symptômes liés à la carcinose pouvaient être traités. Le traitement de référence était jusqu’alors la chimiothérapie systémique et parfois la chirurgie, souvent simplement employée à des fins symptomatiques. Jusqu’au début des années 90, les traitements étaient donc uniquement palliatifs. Un nouveau concept thérapeutique, développé en 1989 par Paul H. Sugarbaker, a permis de parvenir à un traitement à visée curative de la carcinose péritonéale. Il repose sur les progrès réalisés dans la connaissance des mécanismes d’implantation des cellules tumorales sur le péritoine ou sur les zones dépéritonisées. La fixation des cellules cancéreuses sur la matrice extracellulaire se fait en quelques minutes par le biais des intégrines pour lesquelles elles ont une forte affinité. Cette liaison très forte ne peut être rompue par un lavage de la cavité péritonéale, quelle que soit la solution utilisée. Ce concept thérapeutique implique donc que le chirurgien retire complètement la maladie tumorale macroscopique, puis, qu’une chimiothérapie particulière soit mise en route pour traiter la maladie microscopique résiduelle qui est à l’origine des récidives quasi inéluctables de la carcinose péritonéale. Plusieurs protocoles de phases I et II ont permis d’établir un mode opératoire parfaitement reproductible, utilisant l’oxaliplatine à la dose maximale de 460 mg/m2., en y associant, juste avant une perfusion IV de Fufol (Ac Fol : 20 mg/m² et 5-FU 400 mg/m²), afin de potentialiser l’action de l’oxaliplatine. Centre Alexis Vautrin, Nancy Christine MONTOTO-GRILLOT port. 06 11 44 59 47 tél. 01 44 23 55 67 [email protected] • Essai de phase III évaluant la place de la chimiohyperthermie intrapéritonéale peropératoire (CHIP) après résection maximale d’une carcinose péritonéale d’origine colorectale associée à une chimiothérapie systémique. ARC Michèle TORRES-MACQUE port. 06 30 55 38 05 tél. 01 44 23 55 68 [email protected] La faisabilité de ce mode thérapeutique est donc aujourd’hui établie. La morbidité en est cependant encore importante puisqu’elle se situe entre 30 % et 65 % de grade III, IV avec une morbidité chirurgicale spécifique de l’ordre de 30 %. RappoRt d'activité 2008 17 Bureau d’Études Cliniques et Thérapeutiques s eur tum D upe o R r G ACCO Gro up e tu ACCO me urs RD Groupe tumeurs ACCORD(Digestif) Coordonnateur du Groupe Pr Thierry CONROY, Centre Alexis Vautrin, Nancy Groupe tumeurs ACCORD(Digestif) Coordonnateur du Groupe Pr Thierry CONROY, Centre Alexis Vautrin, Nancy Au cours de la dernière décennie, plusieurs études de phase II ont montré des résultats encourageants, permettant de penser que les effets secondaires importants du traitement pourraient être considérés comme acceptables en regard d’une amélioration significative de la survie. Plusieurs études utilisant diverses combinaisons entre le 5-FU, le CDDP, la bleomycine, la vindesine et l’etoposide ont été réalisées et ont montré un taux de réponse de 35 %. D’autre part, l’association de ces 4 produits en pré-opératoire a montré d’encourageants résultats. Notre étude multicentrique de phase III a donc pour objet de définir véritablement la place de la chimiohyperthermie intra-péritonéale en la randomisant chez ces patients ayant pu bénéficier d’une réduction tumorale chirurgicale maximale de leur carcinose, telle qu’elle est réalisée et codifiée dans les procédures thérapeutiques de CHIP (ventre ouvert et ventre fermé). A ce stade du développement de la chimiohyperthermie, il est très important de connaître son impact face à une chirurgie de réduction maximale seule des métastases péritonéales pour confirmer les résultats obtenus en phase II. Des études utilisant la radiothérapie seule ont également été réalisées et ont montrées d’encourageants résultats notamment après un pré-traitement par chimiothérapie et grâce à de meilleures techniques d’irradiation. La première mise en place et le premier patient randomisé ont eu lieu en février 2008. Cet essai prévoit d’inclure 264 patients en 53 mois. Dans les cancers avancés de l’œsophage, des traitements par radiochimiothérapie ont été testés dans des phases II utilisant 5-FU et le CDDP ou la mitomycine, associés à 40-60 Gy. Malgré l’absence de chirurgie, le taux de réponse endoscopique complète varie entre 50 et 80 % avec un taux de survie à 2 ans de 40 % et une médiane de survie de 11-12 mois, mais ceci aux dépens de toxicités de grade 3-4 plus élevées. 250 Au 31 décembre 2008 - 14 centres ont été déclarés au CPP - 10 centres sont ouverts aux inclusions - 3 centres sont actifs (Montpellier, Lyon sud et Dijon) - 31 patients ont été enregistrés - 15 patients ont été randomisés sur les 264 attendus re mb Le cancer de l’œsophage est plus fréquent en France que dans les autres pays européens. L’incidence est de 16 pour 100 000 et 4500 nouveaux cas sont diagnostiqués chaque année, avec un taux de mortalité de 94 % et une médiane de survie de 9 mois. Seules 26 % des tumeurs sont opérables, et même pour ces patients, le taux de mortalité per-opératoire est de 8 % et le taux de survie à 5 ans de 25 %. De nombreux traitements de chimiothérapies ont été testés, seuls ou combinés. Sept traitements ont montré une certaine efficacité dans le cancer de l’œsophage, sur un petit groupe de patients : la mitomycine C (26 % de réponses objectives), cisplatine (CDDP) (19 %), vindesine (20 %), bleomycine (15 %), 5-fluorouracil (5-FU) (82 %), vinorelbine (20 %) et le paclitaxel (34 %). 18 RappoRt d'activité 2008 Bureau d’Études Cliniques et Thérapeutiques de ie at n tte a p No 131 123 Cette étude de phase II/III comparant la combinaison 97 97 97 97 97 97 97 97 97 5 F U - o x a l i p l a t i n e a c i d e 79 folinique à l’association 57 5FU-cisplatine en association 33 avec la radiothérapie a 2 démarré en octobre 2004 avec 9 2004 2005 une promotion du laboratoire 2006 2007 2008 oct janv oct janv oct janv oct janv dec Sanofi-Aventis. Les résultats Phase II Phase III Arrêt inclusions Promotion Sanofi-aventis Promotion FNCLCC PRODIGE encourageants de cette phase II ont été présentés à cumul inclusions/semestre l’ASCO 2008 en poster-discussion, et ont permis de poursuivre en phase III. La promotion de cette phase III a donc été reprise par la FNCLCC fin 2007, après 2 ans d’arrêt. La réouverture des centres pour la phase III ainsi que les inclusions ont débuté en mars 2008 100 50 Centre Alexis Vautrin, Vandœuvre les Nancy. • Etude de phase II-III comparant la radiochimiothérapie avec le schéma FOLFOX à la radiochimiothérapie par 5FU-cisplatine (schéma HERSKOVIC) en traitement de première ligne du cancer de l’œsophage inopérable. nts 150 PRODIGE 5 : ACCORD 17/0707 Pr.Thierry Conroy, s du 100 Investigateur coordonnateur : 205 200 0 De nouvelles associations de produits sont donc nécessaires afin de diminuer la récidive et le taux de métastases, et de permettre de plus fortes intensités de doses, ceci en vue d’améliorer la survie de cette maladie de mauvais pronostic. 108 Au 31 décembre 2008 - 19 centres ont donné leur accord de participation et ont signé les conventions pour la phase III. - 19 centres ont été ré-ouverts aux inclusions - 11 centres sont actifs - 34 patients ont été inclus pour la phase III, soit un total de 131 patients sur les 266 attendus pour la phase II/III. RappoRt d'activité 2008 19 Bureau d’Études Cliniques et Thérapeutiques s eur tum D upe o R r G ACCO Gro up e tu ACCO me urs RD Groupe tumeurs ACCORD(Digestif) Coordonnateur du Groupe Pr Thierry CONROY, Centre Alexis Vautrin, Nancy Etudes en cours en 2008 Groupe tumeurs ACCORD(Digestif) Coordonnateur du Groupe Pr Thierry CONROY, Centre Alexis Vautrin, Nancy 250 246 237 ACCORD 09/0201(Close aux inclusions) Investigateur coordonnateur : 216 200 Pr. Michel Ducreux, 194 192 Institut Gustave Roussy, Villejuif. • Etude randomisée de phase II, évaluant l’association (radiothérapie – docétaxel – 5 fluorouracile) et l’association radiothérapie – docétaxel – cisplatine) dans les adénocarcinomes du pancréas non résécables. L’objectif de cette étude randomisée de phase II, était d’évaluer l’efficacité de 2 associations de radio-chimiothérapie, [radiothérapie – docetaxel – 5 fluorouracile] et [radiothérapie – docetaxel – cisplatine] dans les adénocarcinomes du pancréas non resécables, en termes de survie sans progression à 6 mois. L’objectif de cet essai était d’inclure 80 patients, sur une période initiale de 3 ans. L’analyse intermédiaire sur les 40 premiers patients inclus a conclu à l’inefficacité du bras 1 [Radiothérapie + Docetaxel + 5FU]. La randomisation dans ce bras 1 a donc été interrompue en août 2005. La phase II a été poursuivie en juin 2006 en incluant les patients uniquement dans le bras 2 [Radiothérapie + Docetaxel + Cisplatine]. Après l’inclusion de 20 patients supplémentaires, permettant d’obtenir une meilleure estimation du taux de survie sans progression à 6 mois et de la fréquence des principaux effets secondaires, une nouvelle analyse intermédiaire a eu lieu. Compte-tenu des critères d’arrêt du protocole (interruption de l’essai si 19 non-progressions ou moins étaient observées pour les 40 premiers patients du bras 2) et du faible rythme d’inclusion, il a été décidé de clore cette étude aux inclusions. Au total, 71 patients sur 80 prévus ont été inclus en 4 ans (décembre 2003 à avril 2005). Les plus gros centres inclueurs ont été les centres de Marseille (Institut Paoli-Calmettes), Villejuif (Institut Gustave Roussy), Montpellier (Centre Val D’Aurelle) et Nantes (Centre René Gauducheau). PRODIGE 4 ACCORD 11/0402 : OXIPAN Investigateur coordonnateur : Pr.Thierry Conroy, Centre Alexis Vautrin, Vandœuvre les Nancy. 165 150 us nd ts en 100 e d bre m No 50 ti pa 80 88 e att 140 105 88 91 66 51 42 0 0 2004 nov 7 20 27 2005 fev mai aout nov cumul inclusions/semestre Les mises en place de la phase II ont débuté en novembre 2004 et les premières inclusions en janvier 2005. La phase II a inclus 88 patients de janvier 2005 à octobre 2006. D’encourageants résultats ont été présentés à l’ASCO 2008 et ont permis de reprendre les inclusions de la phase III en mai 2007. Les centres les plus gros recruteurs sont : le Centre Léon Bérard de Lyon, le Centre Val d’Aurelle de Montpellier, l’Institut Gustave Roussy de Villejuif, l’Institut Claudius Regaud de Toulouse et l’Hôpital Robert Debré de Reims. 2006 fev mai aout nov Phase II Promotion Groupe tumeurs ACCORD FNCLCC ligne chez des patients atteints d’un cancer du pancréas métastatique, en comparant les taux de réponses objectives. 2007 fev mai aout nov 2008 fev mai aout nov dec Phase III Promotion FNCLCC PRODIGE En décembre 2008, s’est tenu un Independant Data Monitoring Commitee (IDMC) qui a recommandé d’augmenter le nombre de patients de 260 à 360, ceci aux vues du fort taux d’inclusion, le rythme d’inclusions ayant 1 an d’avance sur le calendrier prévisionnel, et afin de répondre avec une meilleure puissance statistique à l’hypothèse de départ, qui était de passer le taux de survie globale à 6 mois de 50 % pour le bras B (Gemcitabine) à 65 % pour le bras A (Folfirinox). Au 31 décembre 2008 - 54 centres ont donné leur accord de participation et ont été déclarés au CPP - 54 centres ont été ouverts aux inclusions. - 44 centres ont inclus au moins 1 patient - 158 patients ont été inclus dans la phase III, soit un total de 246 sur les 360 attendus pour la phase II/III. PRODIGE 2 : ACCORD 12/0405 : STEREO(ClosE aux inclusions) Investigateur coordonnateur : Pr. Jean Pierre Gérard, • Etude randomisée de phase II/III comparant l’association folfirinox (oxaliplatine/irinotécan/LV5FU) à la gemcitabine en première ligne de chimiothérapie de patients atteints d’un cancer du pancréas métastatique. Cette étude randomisée de phase II/III, a pour objectif de comparer l’association d’une trithérapie, Folfirinox, à la gemcitabine en première 20 RappoRt d'activité 2008 Bureau d’Études Cliniques et Thérapeutiques Centre Antoine Lacassagne, Nice. • Essai randomisé de phase III comparant l’effet préopératoire de deux schémas de radio-chimiothérapie concomitante (45Gy vs 50 Gy + capécitabine + oxaliplatine) sur la stérilisation de la pièce opératoire dans les cancers résécables du rectum T3-T4-N0-M0. RappoRt d'activité 2008 21 Bureau d’Études Cliniques et Thérapeutiques s eur tum D upe o R r G ACCO Gro up e tu ACCO me urs RD Groupe tumeurs ACCORD(Digestif) Coordonnateur du Groupe Pr Thierry CONROY, Centre Alexis Vautrin, Nancy Coordonnateur du Groupe Pr Thierry CONROY, Centre Alexis Vautrin, Nancy Cette étude de phase III randomisée avait pour objectif de comparer une radiochimiothérapie (45 Gy/5 semaines + capecitabine concomitant) à une radiochimiothérapie (50 Gy/5 semaines + Xelox) avec comme critère principal le taux de pièces opératoires stérilisées. Si le critère de jugement principal est un critère de substitution (pièce opératoire stérilisée), le véritable bénéfice espéré pour le patient est une augmentation du taux de conservation sphinctérienne. 600 585 502 450 150 0 558 590 patients devaient être inclus sur une période de 3 ans. Les premières mises en place ont été effectuées dès septembre 2005 et les inclusions ont débuté en novembre 2005. 409 us Des résultats sur les 300 premiers patients ont été présentés à sa nt tie l’ASCO 2008 en poster. Celui-ci a p 282 de a permis de confirmer le profil e br m 226 de survie de l’étude FFCD 9203 No (fluorouracil-RT 45 Gy) avec 152 le bras A (capécitabine-RT 45 Gy), mais aussi de montrer 106 des toxicités acceptables du 52 bras B (Capox –RT 50Gy), qui 7 30 0 2005 2006 2007 2008 ne compromettaient donc pas sept dec mars juin sept dec mars juin sept dec mars juil la possibilité de tolérance à la chirurgie. La véracité de ces données cumul inclusions/semestre sera confirmée après analyse sur les 590 patients. Les inclusions se sont terminées le 22 juillet 2008 avec un total de 598 patients, avec 3 mois d’avance sur le calendrier prévisionnel. Les plus gros centres recruteurs ont été: le Centre Val d’Aurelle de Montpellier (53 patients), le Centre Léon Bérard de Lyon (36 patients), l’Hôpital Saint Louis de Paris (32 patients), la Clinique Armoricaine de St Brieuc (31 patients) et l’Hôpital St André de Bordeaux (30 patients). nd tte 300 598 Bureau d’Études Cliniques et Thérapeutiques ACCORD 13/0503 : mexico(Close aux inclusions) Investigateur coordonnateur : Pr. Michel ducreux, Institut Gustave Roussy, Villejuif. • Etude de phase II randomisée évaluant l’efficacité et la toxicité de l’association (Bevacizumab + Folfiri) et de l’association (Bevacizumab + Xeliri) en première ligne de chimiothérapie des patients atteints d’un cancer colorectal métastatique. 150 145 144 120 120 345 L’étude biologique associée à cette étude de phase III a pour objectif l’identification de biomarqueurs prédictifs de la réponse et de la toxicité de la radiochimiothérapie dans le cancer du rectum. L’impact des polymorphismes génétiques constitutionnels et des altérations génétiques/épigénétiques somatiques sur la toxicité et la réponse à la radiochimiothérapie dans le cancer du rectum seront également recherchés. Nous disposons pour cela : - des prélèvements sanguins de 52 % des patients - des prélèvements biopsiques de 8,7 % des patients 22 RappoRt d'activité 2008 Groupe tumeurs ACCORD(Digestif) 100 90 s t 60 e br de m No 30 pa tte sa t ien u nd 76 59 44 31 9 0 janv 2006 avril juil cumul inclusions/semestre oct janv avril 2007 juil oct 2008 janv Cette étude de Phase II avait pour but d’évaluer la toxicité et l’efficacité de deux combinaisons modernes d e f l u o r o p y r i m i d i n e s e t d’irinotecan, la combinaison Folfiri et la combinaison Xeliri associées toutes deux au bevacizumab. Le bevacizumab est un anticorps monoclonal humanisé dont la cible est le vascular endothelial growth factor (VEGF ou VEGF-A) qui est un ligand dont le rôle est essentiel dans le contrôle du développement et de la survie des vaisseaux tumoraux chez des patients ayant un cancer colorectal métastatique traité en première ligne. Les premières mises en place ont débuté en janvier 2006 et les inclusions en mars 2006. Les inclusions se sont terminées en janvier 2008 avec un total de 145 patients. Cet essai comprend également une partie de recherche biologique sur prélèvements sanguins. Un des objectifs de cette étude biologique est de faire progresser les connaissances sur le cancer colorectal avancé en effectuant un rapprochement entre les résultats des analyses sur les prélèvements sanguins (réalisés chez 91 % des patients) et l’évolution sous traitement de la maladie. RappoRt d'activité 2008 23 Bureau d’Études Cliniques et Thérapeutiques s eur tum D upe o R r G ACCO Gro up e tu ACCO me urs RD Groupe tumeurs ACCORD(Digestif) Coordonnateur du Groupe Pr Thierry CONROY, Centre Alexis Vautrin, Nancy ACCORD 14/0604 : raccer Investigateur coordonnateur : Dr David Azria , Centre Val d’Aurelle-Paul Lamarque, Montpellier. • Essai de phase II multicentrique étudiant l’impact de la séquence thérapeutique radiochimiothérapie pré opératoire (50 Gy + capecitabine + oxaliplatine + cetuximab) suivie d’une chirurgie TME puis d’une chimiothérapie post opératoire (Folfox 4 + cetuximab) dans les cancers du rectum localement avancés métastatiques synchrones avec métastases résécables d’emblée (T3-4 Nx ou T2 N+ M1). L’objectif de ce protocole de phase II non randomisé est donc d’évaluer la faisabilité et l’efficacité d’un nouveau traitement de radiochimiothérapie « optimale » à base de 5-FU oral et d’oxaliplatine associée à un anticorps monoclonal chimérique antiHER1 (le cetuximab) ayant montré son efficacité en pathologie colorectal métastatique et ayant prouvé un effet radiosensibilisant en situation préclinique sur le contrôle local des patients atteints d’une tumeur localement avancée. La population concernée sera donc les patients à très haut risque d’évolution dont ceux porteurs de tumeurs de type T3-T4 Nx ou T2N+ mais associée à des métastases hépatiques synchrones résécables d’emblée. La première mise en place a eu lieu en juillet 2007 et le premier patient inclus en octobre 2007. Cet essai prévoyait initialement d’inclure 103 patients en 18 mois. Cependant, compte tenu des résultats de plusieurs études qui ont montré que l’utilisation du cetuximab était sous tendu par le statut KRAS, et qu’il existait une corrélation entre le statut KRAS, la réponse et le taux de survie sans progression, un amendement a été apporté à cette étude en juillet 2008. Coordonnateur du Groupe Pr Thierry CONROY, Centre Alexis Vautrin, Nancy Groupe tumeurs ACCORD(Digestif) Résultats obtenus en 2008 ACCORD 03 Cet essai a fait l’objet d'une présentation ORALE à la SFRO en 2008 ainsi qu’à l’ESTRO en septembre 2008. (pour en savoir plus, se référer à la page 85 de l’onglet publications). PRODIGE 2 : ACCORD 12 Cet essai a fait l’objet d'un POSTER sur la tolérance présenté à l’ASCO en 2008, ainsi qu'une présentation ORALE à l’ESTRO en 2008. (pour en savoir plus, se référer à la page 85 de l’onglet publications). en conclusion Le Groupe tumeurs ACCORD a permis en 2008, l’ouverture de 2 études : PRODIGE 7/ACCORD 15 et PRODIGE 5/ACCORD 17 (530 patients prévus), de compléter les inclusions de 3 études : ACCORD 9, PRODIGE 2/ ACCORD 12 ; ACCORD 13 (soit 814 patients au total) et de poursuivre les inclusions d’ACCORD 11 et ACCORD 14 (419 patients prévus). Ainsi dorénavant, seuls les patients non mutés KRAS peuvent être inclus dans l’essai. Le nombre de patients à inclure a donc été recalculé et diminué de 103 à 59 patients. Au 31 décembre 2008 - 7 centres ont donné leur accord de participation et ont été déclarés au CPP - 7 centres sont ouverts aux inclusions - 5 centres sont actifs - 12 patients ont été inclus Cette étude comporte également une étude biologique annexe qui a pour objectif de développer une nouvelle génération de marqueurs tumoraux pour une meilleure sélection des patients. En particulier, l’objectif de cette étude est de mettre en évidence des facteurs biologiques, en rapport avec la voie de signalisation de l’EGFR, prédictifs de la réponse au traitement par radio-chimiothérapie (Capecitabine + Oxaliplatine + Cetuximab) néoadjuvante dans les cancers du rectum. 24 RappoRt d'activité 2008 Bureau d’Études Cliniques et Thérapeutiques RappoRt d'activité 2008 25 Bureau d’Études Cliniques et Thérapeutiques s eur tum D upe o R r G ACCO Gro up e tu ACCO me urs RD Groupe tumeurs ACCORD(Digestif) Coordonnateur du Groupe Pr Thierry CONROY, Centre Alexis Vautrin, Nancy Coordonnateur du Groupe Pr Thierry CONROY, Centre Alexis Vautrin, Nancy Inclusions 2008 par type d’établissement Inclusions 2008 par type d’établissement CLCC Nom établissement Groupe tumeurs ACCORD(Digestif) Hôpitaux Publics (suite) TOTAL Inclusions 2008 CH Louis Pasteur - Dole 0 CH M. Joffre - Perpignan 3 Centre Alexis Vautrin 19 CH Mont de Marsan 2 Centre Antoine Lacassagne 9 CH Oudot Bourgoin-Jallieu 3 Centre Eugène Marquis 10 CH Robert Boulin - Libourne 0 Centre François Baclesse 12 CH Valence 0 Centre Georges-François Leclerc 6 CHD Les Oudaries - La Roche sur Yon 0 Centre Léon Bérard 23 11 CHI Elbeuf-Louviers-Val de Reuil (St Aubin les Elbeuf) 0 Centre Oscar Lambret Centre Paul Papin 0 CHR Metz Thionville - Hôpital Bon Secours 0 Centre Paul Strauss 6 CHR Orléans - Hôpital la Source 3 Centre René Gauducheau 9 CHR R Morlevat - Semur en Auxois 0 Centre René Huguenin 1 CHR Reims 15 Centre Val d'Aurelle - Paul Lamarque 3 CHRU Brest 0 Institut Bergonié 13 CHRU Tours 0 Institut Claudius Regaud 6 CHU Amiens - Hôpital Nord 0 Institut Curie 0 CHU Besançon 1 Institut Gustave Roussy 14 CHU Clermont Ferrand 0 Institut Jean Godinot 0 CHU Côte de Nacre - Caen 2 Institut Paoli-Calmettes 3 CHU Dijon 11 CHU Hôpitaux de Bordeaux 14 CHU Limoges 0 CHU Nice 5 CHU Nimes 2 CHU Poitiers 0 CHU Rouen - Hôpital Charles Nicolle 7 CHU Toulouse 1 Hôpital Ambroise Paré - Marseille 0 Hôpital St Vincent de Paul à Lille 0 Hôpitaux Civils de Colmar 5 Hôpitaux Universitaires de Strasbourg 2 Total 177 Hôpitaux Publics Nom établissement TOTAL Inclusions 2008 CH Avignon - Hôpital Henri Duffaut 2 CH Belfort Montbéliard - Hôpital André Boulloche 1 CH Boulogne sur Mer 4 CH d'Abbeville 0 CH d'Altkirch 0 CH de Beauvais 1 CH de Blois 0 CH de la Région d'Annecy 1 CH de Pau 0 CH de Rodez 0 CH de Tarbes 0 CH du Hasenrain - Mulhouse 3 CH La Roche Sur yon 0 26 RappoRt d'activité 2008 Bureau d’Études Cliniques et Thérapeutiques Hospices Civils de Lyon Total 23 106 RappoRt d'activité 2008 27 Bureau d’Études Cliniques et Thérapeutiques s eur tum D upe o R r G ACCO Gro up e tu ACCO me urs RD Groupe tumeurs ACCORD(Digestif) Coordonnateur du Groupe Pr Thierry CONROY, Centre Alexis Vautrin, Nancy Coordonnateur du Groupe Pr Thierry CONROY, Centre Alexis Vautrin, Nancy Inclusions 2008 par type d’établissement Inclusions 2008 par type d’établissement ASSISTANCE PUBLIQUE Nom établissement Groupe tumeurs ACCORD(Digestif) etABLISSEMENTS PRIVES TOTAL Inclusions 2008 Nom établissement TOTAL Inclusions 2008 AP-HM Hôpital la Timone 3 Centre d'Oncologie Saint Yves - Vannes 3 AP-HM Hôpital Nord Marseille 6 15 AP-HP GIH Bichat Claude Bernard 0 Clinique Armoricaine de Radiologie - Saint Brieuc AP-HP Hôpital Ambroise Paré 3 Clinique Bourgogne - Lille 3 AP-HP Hôpital Avicenne 0 Clinique Charcot - Ste Foy Les Lyon 0 AP-HP Hôpital Bichat 1 Clinique Clementville 0 AP-HP Hôpital Européen Georges Pompidou 0 Clinique Générale - Valence 1 AP-HP Hôpital Henri Mondor 1 Clinique JB Denis - Macon 0 AP-HP Hôpital La Pitié Salpétrière 1 Clinique Saint Jean - Lyon 2 AP-HP Hôpital Saint Louis 10 Clinique Saint Pierre - Perpignan 1 AP-HP Hôpital Tenon 0 Clinique Saint Vincent - Epernay 0 25 Clinique Sainte Marguerite - Hyères 5 Clinique Sainte Marie - Chalons sur Saone 0 Clinique Tivoli - Bordeaux 4 Clinique Victor Hugo - Le Mans 8 CMC Les Ormeaux Vauban Le Havre 2 Groupe Hospitalier Paris St-Joseph 0 Institut de Cancérologie de la Loire - St Priest en Jarrez 7 Institut Privé de Cancérologie de Grenoble 0 Institut Sainte Catherine - Avignon 0 PolyClinique Bordeaux Nord Aquitaine 4 Polyclinique des 4 pavillons - Bordeaux Rive Droite 4 Polyclinique des Minguettes - Venissieux 0 Polyclinique du Parc - Caen 3 Polyclinique du Parc - Toulouse 0 Total Polyclinique Francheville - Perigueux Total 28 RappoRt d'activité 2008 Bureau d’Études Cliniques et Thérapeutiques 1 63 RappoRt d'activité 2008 29 Bureau d’Études Cliniques et Thérapeutiques s eur tum D upe o R r G ACCO AN CIEN PAC gyneco Groupe tumeurs FEDEGYN Coordonnateur du Groupe Dr Paul Cottu. Institut Curie, Paris. s eur tum N upe o r Y G EG FED Groupe tumeurs FEDEGYN L e groupe FEDEGYN est un groupe en pleine restructuration suite à une baisse d’activité notable durant ces 10 dernières années. Cependant, des points forts potentiellement très prometteurs peuvent être identifiés. Les axes stratégiques de développement en 2009 découlent de ces points forts : 1- La pluridisciplinarité : un rapprochement étroit avec le groupe des chirurgiens des centres est notamment prévu très prochainement. 2- La capacité à organiser la recherche de transfert. Cette recherche existe déjà dans plusieurs centres (Caen, Paris, Toulouse…). FEDEGYN est en position idéale pour développer cette recherche et bâtir des essais stratégiques basés sur la biologie, et participer au développement rationnel de thérapies ciblées en collaboration avec le GEP. 3- La capacité à réaliser des essais de radiothérapie, idéalement en association aux thérapies innovantes (ex : essai Cetuxicol). 4- La possibilité d’exploiter les bases de données clinicobiologiques des centres. Coordonnateurs du Groupe • Depuis janvier 2007, le groupe gynécologie de la FNCLCC a été refondé, et rebaptisé FEDEGYN. Le Pr Florence Joly (Centre Baclesse, Caen) en a assuré la présidence jusqu’en janvier 2009, aidée par un bureau. Un nouveau bureau a été élu en 2009, le Dr Paul Cottu (Institut Curie, Paris) est devenu le nouveau président. ORGANISATION GÉNÉRALE Le bureau a pour mission d’organiser les réunions plénières, et d’assurer les relations avec les autres groupes coopérateurs français (GEP, PAC Sarcome, GINECO) et internationaux (EORTC, GCIG), ainsi qu’avec l’industrie pharmaceutique. Les réunions plénières ont lieu 3 fois par an et comportent systématiquement : un exposé scientifique ; le suivi des projets en cours ; une présentation de compagnie pharmaceutique (« pipe-line »). Actuellement, le groupe est composé d’oncologues médicaux (70 %), de radiothérapeutes (20 %), et de représentants des autres spécialités, et reste ouvert aux hôpitaux non FNCLCC (ex : Tenon, Diaconesses). En dehors de ses activités de recherche clinique, le Groupe a participé à plusieurs travaux académiques : • rédaction et validation des SOR ovaire : chirurgie en 2007 ; traitements médicaux en 2008. • Construction du site web tumeurs rares de l’ovaire, en collaboration avec le groupe GINECO. Elargissement progressif du site à d’autres tumeurs gynécologiques. Conclusions Pr Florence Joly, Centre François Baclesse, Caen a laissé la présidence du groupe depuis janvier 2009 au Le groupe FEDEGYN avec sa nouvelle organisation a pour but de relancer une dynamique de recherche clinique en privilégiant les essais cliniques incluant des études de transfert, en développant des études de radiothérapie et des études médico-chirurgicales. Son succès dépend de l’investissement de l’ensemble des investigateurs des CLCC dans la proposition d’essais au groupe, dans leur participation active pour inclure des patientes dans les essais. Dr Paul Cottu, Institut Curie, Paris Le soutien fédéral et l’engagement institutionnel des centres seront à cet égard déterminants. La preuve en est de cette dynamique : la soumission au Comité d’Orientation Stratégique de la FNCLCC de deux projets d’études FEDEGYN fin d’année 2008. CONTACTS au 1er JUIN 2009 Groupe tumeurs FEDEGYN Chef de Projets Assistante de Projets Christine REGNAULT Laurent DELLUC tél. 01 44 23 55 77 [email protected] tél. 01 44 23 04 68 [email protected] tél. 01 44 23 55 72 [email protected] Fabienne Gouttenoire 30 RappoRt d'activité 2008 Bureau d’Études Cliniques et Thérapeutiques ARC La validation de ces essais par le COS laisse envisager l’activation de ces études par le BECT, courant 2009. RappoRt d'activité 2008 31 Bureau d’Études Cliniques et Thérapeutiques AN CIEN PAC gerico Coordonnateur du Groupe Dr Etienne Brain, Centre René Huguenin, Saint-Cloud Groupe tumeurs GERICO(Oncogériatrie) Groupe tumeurs GERICO ETUDES en cours en 2008 GERICO 03(ClosE aux inclusions) (Oncogériatrie) Investigateur coordonnateur : E n 2008, le groupe GERICO n’a pas ouvert de nouvel essai. Il a achevé avec succès les programmes encore ouverts. Il a travaillé sur la communication et la publication de plusieurs travaux : poster à ESMO et présentation orale au SIOG pour GERICO 06, poster à ESMO et au SIOG pour GERICO 4/5, finalisation de l’article de GERICO 01 et préparation de celui de GERICO 02. L’effort du groupe est désormais orienté sur la construction de deux programmes explorant les thérapies innovantes ciblées dans le cancer du sein ou du colon : association lapatinib + capecitabine (GERICO 09), schéma XELOX (défini dans GERICO 02) + bévacizumab (GERICO 08, perspectives de phase II randomisée). Il participe à un intergroupe avec le groupe GINECO sur l’essai DOGMES dans le cancer du sein. Ses défis pour 2009 sont : 1- Faire évoluer les critères principaux de jugement pertinents en recherche clinique oncogériatrique (autonomie, qualité de vie, critères composites vs survie sans progression et taux de réponse par exemple), 2- Affronter la question de l’espérance de vie (pronostic hors cancer) et de son intégration dans les questions posées (score de mortalité), 3- Développer la recherche en intervention gériatrique spécifique, 4- Mieux interagir avec les autres groupes d’organes de la Fédération. Coordonnateur du Groupe Dr Etienne Brain, Centre René Huguenin, Saint-Cloud CONTACTS au 1er JUIN 2009 Groupe tumeurs GERICO Chef de Projets Assistante de Projets Christine Regnault Laurent Delluc tél. 01 44 23 55 77 [email protected] tél. 01 44 23 04 68 [email protected] tél. 01 44 23 55 72 [email protected] Fabienne Gouttenoire 32 RappoRt d'activité 2008 Bureau d’Études Cliniques et Thérapeutiques Dr Jean-Michel Hannoun-Levi, Centre Antoine-Lacassagne, Nice. • Traitement radio-chirurgical du cancer du sein sans envahissement ganglionnaire de la femme âgée de plus 70 ans : étude de phase II multicentrique de la faisabilité et de la reproductibilité d’une radiothérapie concentrée et focalisée. Cet essai de phase II a pour objectif d’étudier la faisabilité et la reproductibilité d’une irradiation partielle du sein par curiethérapie interstitielle comme seul traitement post tumorectomie par les agents physiques, dans le traitement radiochirurgical du cancer du sein de la femme âgée de plus de 70 ans. La curiethérapie réalisée en haut débit de dose, basée sur une reconstruction scanner volumétrique, permet d’analyser avec précision les volumes traités et irradiés ainsi que le volume cible (Histogrammes dose-volumes). Le critère principal d’évaluation permettant de juger la qualité technique de l’implant repose sur des critères dosimétriques représentés par l’Index Qualité (IQ) de l’application exprimé en %. Cette qualité est jugée acceptable pour un IQ < 10 %, moyennement acceptable entre 10 et 20 % et non acceptable si l’IQ ≥ 20 %. L’essai avait été mis en place en juillet 2004 dans 9 centres (dont 7 CLCC). Après une analyse intermédiaire en 2006, évaluant le nombre d’Index Qualité jugé « non acceptable », l’étude avait pu reprendre progressivement pour atteindre l’objectif d’inclusion de 42 patientes. Depuis mai 2008 : l’étude a été fermée aux inclusions avec un total de 46 patientes incluses pour 80 patientes enregistrées dans l’essai par 7 centres actifs. Les principaux centres recruteurs restent le Centre Antoine Lacassagne de Nice et l’Institut Gustave Roussy de Villejuif avec respectivement 23 et 16 patientes incluses. Un abstract sur les résultats de l’étude a été soumis pour le congrès de l’ASTRO 2009. Une étude médico-économique associée sera également analysée à partir des questionnaires collectés. ARC RappoRt d'activité 2008 33 Bureau d’Études Cliniques et Thérapeutiques s eur tum upe o r G R ICO GE Groupe tumeurs GERICO(Oncogériatrie) Gro up G E e tumeu rs R ICO Coordonnateur du Groupe Dr Etienne Brain, Centre René Huguenin, Saint-Cloud Résultats obtenus en 2008 GERICO 06 Investigateur coordonnateur : Dr Etienne Brain, Centre René Huguenin, Saint Cloud. • E ssai clinique multicentrique pilote de chimiothérapie adjuvante chez les patientes de plus de 70 ans : impact sur l’indépendance et la qualité de vie de l’administration d’une chimiothérapie à base d’anthracyclines en situation adjuvante chez des patientes présentant un cancer du sein opérable d’emblée, récepteurs hormonaux négatifs (RH-), avec envahissement ganglionnaire (pN+) ou pN0 mais de grade SBR III et ≥ 2 cm. Cet essai de phase II multicentrique et prospectif chez la femme âgée de plus de 70 ans, opérée d’un cancer du sein non hormonosensible, avait pour objectif principal d’évaluer l’impact sur l’indépendance et la qualité de vie d’une chimiothérapie adjuvante standard de type « Anthracyclines », doxorubicine + cyclophosphamide, la doxorubicine lyposomale, Myocet® remplaçant dans cette association la doxorubicine conventionnelle pour réduire le risque de cardiotoxicité. Coordonnateur du Groupe Dr Etienne Brain, Centre René Huguenin, Saint-Cloud Groupe tumeurs GERICO(Oncogériatrie) administrée toutes les 2 semaines dans le traitement du cancer du sein métastatique chez la femme âgée de plus de 70 ans. Cette étude débutée en France en février 2005 avait été également ouverte en Suisse et Italie et devait impliquer le Royaume-Uni. Suite à la survenue de deux décès toxiques consécutifs à deux pneumopathies (l’une infectieuse - pneumocystose - et l’autre interstitielle), un Comité de surveillance a statué sur la suspension des inclusions fin août 2006. Avec le recul et les données recueillies, l’essai avait été définitivement clos aux inclusions en 2007. 27 patientes avaient été incluses par 4 centres français (Institut PaoliCalmettes, Institut Curie, Centre Henri Becquerel, Institut Gustave Roussy). - Un poster a été présenté lors du Congrès de l’ESMO –Stockholm 2008 ainsi que lors du Congrès International d’Oncogériatrie de la SIOG Montréal 2008. - Les résultats seront également présentés lors d’une session Poster au prochain Congrès International de Gériatrie-Gérontologie IAGG - Paris 2009. Inclusions 2008 par type d’établissement Le caractère innovant de cet essai est la mise en place d’une évaluation gériatrique approfondie afin de corréler la faisabilité du traitement avec l’état gériatrique des patientes. Cette étude a démarré en janvier 2006 et a impliqué 17 centres parmi lesquels 12 ont recruté des patientes. La méthode d’analyse en 2 étapes selon Fleming a interrompu les inclusions au seuil des 20 patientes, entre les 15 septembre et 17 novembre 2006, pour atteindre ensuite l’objectif final des 40 patientes incluses et donc arrêt des inclusions le 2 novembre 2007. - Un poster a été présenté lors du Congrès de l’ESMO - Stockholm 2008 (prix du meilleur poster) - Les résultats de l’essai ont également donné lieu à une présentation orale lors du Congrès International d’Oncogériatrie de la SIOG - Montréal 2008. - Les résultats, avec mise à jour des suivis à un an, seront également présentés lors d’une session orale au prochain Congrès International de Gériatrie-Gérontologie IAGG - Paris 2009. GERICO 04 CLCC Nom établissement TOTAL Inclusions 2008 Centre Alexis Vautrin 0 Centre Antoine Lacassagne 7 Centre Léon Bérard 0 Centre Oscar Lambret 0 Centre Paul Strauss 0 Institut Bergonié 0 Institut Gustave Roussy 8 Total 15 Hôpitaux Publics Nom établissement TOTAL Inclusions 2008 Hospices Civils de Lyon 0 Total 0 Investigateur coordonnateur : Dr Suzette Delaloge, Institut Gustave Roussy, Villejuif. Cet essai international de phase II se proposait d’évaluer l’impact sur l’autonomie des activités de la vie instrumentale et quotidienne (définie selon l’indice IADL et ADL) d’une chimiothérapie par docétaxel 34 RappoRt d'activité 2008 Bureau d’Études Cliniques et Thérapeutiques ASSISTANCE PUBLIQUE Nom établissement TOTAL Inclusions 2008 AP-HP Hôpital La Pitié Salpétrière 0 AP-HP Hôpital Saint Louis 0 Total 0 RappoRt d'activité 2008 35 Bureau d’Études Cliniques et Thérapeutiques s eur tum upe o r G R ICO GE AN CIEN PAC getug Coordonnateur du Groupe Pr Stéphane Culine, Hôpital Henri Mondor, Créteil Groupe tumeurs GETUG(Urologie) Groupe tumeurs GETUG ETUDES en cours d’inclusion en 2008 GETUG 13 (Urologie) Investigateur coordonnateur : Dr Karim Fizazi, Institut Gustave Roussy, Villejuif. L e Groupe d’Etudes des Tumeurs Urogénitales maintient son dynamisme sur les essais en cours d’inclusion. En effet, pour l’année 2008, 565 patients ont été inclus dans le Groupe GETUG, soit 69 % de patients de plus qu’en 2007. • Cette étude de stratégie adaptée au pronostic chez des patients atteints de tumeurs germinales non séminomateuses disséminées (appelées TGNS) de mauvais pronostic s’est poursuivie en 2008. • De nouveaux centres se sont joints aux centres déjà actifs prouvant l’intérêt scientifique de la question posée. Cette étude est internationale puisque le MD Anderson à Houston (Etats-Unis) et le NCI de Bratislava (Slovaquie) collaborent également. La survie sans progression de patients atteints de TGNS de mauvais pronostic est l’objectif de l’essai. Ces patients qui présentent une décroissance lente du taux sérique des marqueurs tumoraux après 1 cycle du protocole Bléomycine Etoposide Cisplatine (BEP) vont recevoir de manière aléatoire soit 3 cycles supplémentaires de Bléomycine Etoposide Cisplatine (groupe BEP) soit un protocole Taxol-BEP-Oxaliplatine/Cisplatine-IfosfamideBléomycine appelé dose-dense. Suite au 3ème IDMC ayant eu lieu fin 2006, le schéma de traitement dosedense validé (sans oxaliplatine) et l’introduction systématique de facteurs de croissance ont permis de poursuivre les inclusions et d’observer l’absence de toxicité grave. Au cours de cette année 2008, 328 patients ont été inclus dans les CLCC et 232 dans les centres hospitaliers, les cliniques et les hôpitaux de l’assistance publique. Ceci témoigne d’une véritable collaboration inter-institutionnelle en terme de recherche clinique dans la prise en charge des cancers uro-génitaux. Il est prévu d’inclure 240 patients au total sur une période de 6 ans (l’incidence de ce cancer étant faible). L’étude a été ouverte en novembre 2003 et au au 31 décembre 2008, 150 patients ont été enregistrés dont 25 aux Etats-Unis et 13 en Slovaquie. Coordonnateur du Groupe Centre H. Becquerel, Rouen. • Cette étude compare l’efficacité d’une hormonothérapie courte préalable et concomitante à une radiothérapie conformationnelle exclusive à visée curative, chez des patients atteints d’un cancer localisé à la prostate de pronostic intermédiaire. Hôpital Henri Mondor, Ap-Hp Créteil CONTACTS au 1er JUIN 2009 Groupe tumeurs GETUG Chef de Projets Assistante de Projets Cécile LOUVET Rachida ZANFONGNON tél. 01 76 64 78 07 [email protected] tél. 01 44 23 55 73 [email protected] tél. 01 44 23 55 50 [email protected] 36 RappoRt d'activité 2008 Bureau d’Études Cliniques et Thérapeutiques Investigateur coordonnateur : Pr Bernard Dubray, Pr Stéphane Culine, Muriel HABIBIAN GETUG 14 ARC FNCLCC L’objectif principal est de tester l'intérêt d'une hormonothérapie courte par blocage androgénique complet de 4 mois chez des patients bénéficiant de l'escalade de dose en radiothérapie externe. 450 patients doivent être inclus sur une période de 7 ans. Ouverte en 2003, 321 patients ont été inclus en 2008. RappoRt d'activité 2008 37 Bureau d’Études Cliniques et Thérapeutiques Pac g u Get s eur tum upe U G o r G T GE Groupe tumeurs GETUG(Urologie) Coordonnateur du Groupe Pr Stéphane Culine, Hôpital Henri Mondor, Créteil Coordonnateur du Groupe Pr Stéphane Culine, Hôpital Henri Mondor, Créteil Les patients inclus dans cet essai présentent un adénocarcinome de type pT2, ou pT3 ou pT4 (par atteinte de col vésical) et traité préalablement par chirurgie. Après randomisation, le patient reçoit : - soit le bras A : radiothérapie exclusive - soit le bras B : radiothérapie + Zoladex® GETUG-AFU 15 Investigateur coordonnateur : Dr Gwenaëlle GRAVIS, Institut Paoli-Calmettes, Marseille. Gro up G E e tumeu rs T • Cet essai compare l’association d’un traitement hormonal + docétaxel à un traitement hormonal seul, en première ligne de traitement des patients atteints d’un cancer de la prostate métastatique hormonosensible. UG 400 385 368 343 317 300 295 s du n 100 66 50 0 3 2004 oct 19 jan 29 2005 oct 257 Un des objectifs secondaires de cet essai est de réaliser e 195 ed deux études parallèles : r b m 165 - Etude des profils d’expression No 147 génique tumoraux à l’aide 120 de bio-puces à ADN et de 94 « tissue micro-arrays », ceci dans le but de rechercher des liens statistiques entre ces profils d’expression génique 2006 2007 2008 2008 jan oct jan oct jan oct dec tumoraux et les paramètres pronostiques (survie globale, survie sans progression clinique ou biologique) dans chacun des bras du protocole et sur l’ensemble des 2 bras. - Etude exploratoire protéomique sérique en SELDI-TOF MS visant à rechercher des corrélations avec les paramètres histocliniques et/ou moléculaires déjà établis, identifier une ou des signature(s) protéique(s) à valeur pronostique et ou prédictive de la réponse thérapeutique. ts ien t pa 200 te at 270 350 L’objectif principal de cette étude est de comparer le bénéfice sur la survie globale à 36 mois du docétaxel + hormonothérapie au traitement hormonal seul. 429 400 382 327 300 311 us nd ts ien 200 e br m 224 En décembre 2008, les 378 patients attendus étaient inclus. Cette étude ouverte en 2004 est donc maintenant fermée aux inclusions et ce avant la fin de la période d’inclusion qui était prévue en avril 2009. Groupe tumeurs GETUG(Urologie) No 100 de t pa te at 257 202 152 108 77 0 4 2006 oct 28 jan 2007 oct jan 2008 oct 2008 dec Des objectifs secondaires d’évaluation de la survie globale, de la survie spécifique sans métastases, des toxicités aiguës et tardives et du taux d’obtention du nadir du taux de PSA sont prévus. Enfin, un questionnaire de qualité de vie est rempli par le patient un an et cinq ans après la radiothérapie ; une évaluation de la dépendance fonctionnelle des patients de plus de 75 ans est aussi recueillie un an et cinq ans après la radiothérapie. Cette étude a été ouverte aux inclusions en octobre 2006 avec 47 centres et le rythme d’inclusion a d’emblée été soutenu. En effet, 429 patients étaient déjà inclus sur les 466 attendus initialement. Fin 2008, un amendement a été déposé afin d’augmenter le nombre de patients à inclure qui est maintenant de 738. GETUG-AFU 17 Investigateur coordonnateur : Dr Pierre RICHAUD, Radiothérapeute, Institut Bergonié, Bordeaux. Investigateur co-coordonateur : GETUG-AFU 16 Investigateur coordonnateur : Dr Christian CARRIE, Centre Léon Bérard, Lyon. • L’étude a pour objectif de comparer l'efficacité d'une hormonothérapie courte par Zoladex® concomitante à une radiothérapie versus une radiothérapie exclusive, dans le traitement de rattrapage des rechutes biologiques de cancer de la prostate après chirurgie. 38 RappoRt d'activité 2008 Bureau d’Études Cliniques et Thérapeutiques Pr. Vincent RAVERY, Urologue, Hôpital Bichat, ApHp, Paris. • Etude randomisée multicentrique comparant une radiothérapie adjuvante immédiate associée à une hormonothérapie courte par un analogue LH-RH (Décapeptyl® LP) versus une radiothérapie différée à la rechute biochimique associée à une hormonothérapie courte par un analogue LH-RH (Décapeptyl® LP) chez des patients opérés d’un cancer de la prostate pT3 R1 pN0 ou pNx, de risque intermédiaire. RappoRt d'activité 2008 39 Bureau d’Études Cliniques et Thérapeutiques Pac g u Get s eur tum upe U G o r G T GE Groupe tumeurs GETUG(Urologie) Coordonnateur du Groupe Pr Stéphane Culine, Hôpital Henri Mondor, Créteil L’étude s’adresse aux patients opérés par prostatectomie radicale pour un cancer de prostate pT3 R1 pN0 ou pNx et avec un PSA post-opératoire indosable. Elle vise à comparer l’efficacité d’un traitement adjuvant postopératoire systématique par hormonothérapie courte et radiothérapie de la loge de prostatectomie au même traitement délivré au moment de la récidive biochimique (0,2 ng/ml < PSA < 2 ng/ml). Gro up G E e tumeu T U rs G La définition de la recidive biochimique est la suivante : le PSA > 0.2 ng/ml est confirmé par un dosage en élévation à au moins 1 mois d’intervalle et impérativement avant que le PSA soit > 2 ng/ml. Coordonnateur du Groupe Pr Stéphane Culine, Hôpital Henri Mondor, Créteil • Le but de cet essai de phase III est de comparer un bras radiothérapie 80 Gy versus un bras radiothérapie 70 Gy en association avec une hormonothérapie longue (agonistes de la LH-RH pendant 3 ans maximum) dans les cancers de la prostate du groupe défavorable. La radiothérapie sera réalisée par technique conformationnelle incluant ou non l’IMRT. Cet essai multicentrique, sera mené en ouvert avec une randomisation en 2 groupes parallèles. L’objectif principal de cet essai est l’évaluation de l’impact d’une augmentation de dose de 10 Gy sur la survie sans progression clinique ou biochimique à 5 ans. Après sélection et randomisation des patients, deux stratégies sont donc comparées : - Un bras A de traitement avec Décapeptyl® LP et radiothérapie conformationnelle de la loge prostatectomie à 66 Gy (7 semaines de traitement) mis en route uniquement au moment de la rechute biochimique. - Un bras B de traitement avec Décapeptyl® LP et radiothérapie conformationnelle de la loge prostatectomie à 66 Gy mis en route dans les 6 mois suivant la chirurgie. Le critère de jugement principal est la survie sans évènement, calculée de la date de randomisation jusqu’à la date de première mise en évidence d’une progression documentée, ou de décès (quel qu’en soit la cause), ou de dernières nouvelles. Les autres critères évalués sont la survie globale, les toxicités aiguës ou tardives ainsi que la qualité de vie et la dépendance fonctionnelle des patients de plus de 75 ans. Cette étude a été ouverte aux inclusions en décembre 2007 et doit permettre d’inclure 718 patients en 5 ans. Au 31 décembre 2008, 30 patients étaient inclus. Afin de favoriser les inclusions, il a été décidé de créer et de diffuser des documents d’aide aux inclusions dans tous les centres participants. Etude autorisée en 2008 GETUG-AFU 18 Groupe tumeurs GETUG(Urologie) L’étude s’adresse aux patients qui présentent un adénocarcinome de la prostate « groupe défavorable » défini par un des facteurs suivants : stade clinique T3 ou T4 ou score de Gleason ≥ 8 ou un taux de PSA sérique ≥ 20 ng/ml et ≤ 100 ng/ml. Dans cet essai, 500 patients sont attendus dans une période d’inclusion de 5 ans. Collaborations internationales GETUG 13 Cette étude de phase III sur la stratégie adaptée au pronostic pour l’usage d’une chimiothérapie dose-dense chez des patients atteints de tumeurs germinales non séminomateuses disséminées de mauvais pronostic, concerne des pathologies rares qui nécessitent une extension internationale pour permettre un recrutement suffisant dans un délai raisonnable. Le centre du MD Anderson Cancer à Houston aux Etats-Unis participe depuis 2004 à l’étude et a enregistré, fin 2008, 25 patients sur 150. Le National Cancer Institute de Klenova à Bratislava en Slovaquie a rejoint l’étude au cours de l’été 2005 et a enregistré 13 patients sur 150 patients enregistrés au total. En résumé, le groupe GETUG a été très actif en 2008 avec la poursuite des inclusions dans 4 larges études prévoyant plus de 2000 patients attendus, la finalisation des inclusions de l’étude Getug 15 et l’approbation de l’étude Getug 18 par le comité d’éthique. L’autorisation de la DGS et l’avis favorable du CPP pour ce projet ont été obtenus en 2008 et les mises en place auront lieu début 2009. Investigateur coordonnateur : Dr Christophe HENNEQUIN, Hôpital St Louis, Paris. 40 RappoRt d'activité 2008 Bureau d’Études Cliniques et Thérapeutiques RappoRt d'activité 2008 41 Bureau d’Études Cliniques et Thérapeutiques Pac g u Get s eur tum upe U G o r G T GE Groupe tumeurs GETUG(Urologie) Coordonnateur du Groupe Pr Stéphane Culine, Hôpital Henri Mondor, Créteil Coordonnateur du Groupe Pr Stéphane Culine, Hôpital Henri Mondor, Créteil Inclusions 2008 par type d’établissement Inclusions 2008 par type d’établissement Hôpitaux Publics CLCC Nom établissement UG TOTAL Inclusions 2008 Centre Alexis Vautrin 18 Centre Antoine Lacassagne 14 Centre Eugène Marquis 30 Centre François Baclesse 12 Centre Georges-François Leclerc 7 Centre Henri Becquerel 17 Centre Jean Perrin 0 Centre Léon Bérard 26 Centre Oscar Lambret 2 Centre Paul Papin 10 Centre Paul Strauss 0 Centre René Gauducheau 17 Centre René Huguenin 3 Centre Val D'aurelle - Paul Lamarque 43 Institut Bergonié 25 Institut Claudius Regaud 12 Institut Curie 39 Institut Gustave Roussy 35 Institut Jean Godinot 8 Institut Paoli-Calmettes 10 Total Pac g u Get Gro up G E e tumeu rs T Groupe tumeurs GETUG(Urologie) 328 Nom établissement TOTAL Inclusions 2008 CH de Chambery 4 CH de Gap 0 CH de la Région d'Annecy 0 CH de Roanne 2 CH de Rodez 0 CH de Vichy 0 CH du Hasenrain - Mulhouse 2 CH La Roche Sur yon 6 CH Louis Pasteur - Chartres 0 CH Mont de Marsan 1 CHI de Créteil 0 CHP Saint Grégoire 0 CHR Metz Thionville - Hôpital Bon Secours 2 CHR Orléans - Hôpital la Source 0 CHRU Brest 0 CHRU Tours 5 CHU Besançon 16 CHU de Tours 0 CHU Hôpitaux de Bordeaux 5 CHU Limoges 2 CHU Nîmes 1 CHU Poitiers 17 HIA Val de Grâce - Paris 4 Hôpital Foch - Suresnes 6 Hôpitaux Civils de Colmar 0 Hospices Civils de Lyon 2 Total 75 ASSISTANCE PUBLIQUE Nom établissement TOTAL Inclusions 2008 AP-HM Hôpital la Timone 1 AP-HP Hôpital Avicenne 0 AP-HP Hôpital Européen Georges Pompidou 6 AP-HP Hôpital Henri Mondor 17 AP-HP Hôpital La Pitié Salpétrière 1 AP-HP Hôpital Saint Louis 3 AP-HP Hôpital Tenon 0 Total 42 RappoRt d'activité 2008 Bureau d’Études Cliniques et Thérapeutiques 28 RappoRt d'activité 2008 43 Bureau d’Études Cliniques et Thérapeutiques s eur tum upe U G o r G T GE Groupe tumeurs GETUG(Urologie) Coordonnateur du Groupe Pr Stéphane Culine, Hôpital Henri Mondor, Créteil Inclusions 2008 par type d’établissement Etablissements Privés Nom établissement Gro up G E e tumeu rs T UG TOTAL Inclusions 2008 Centre Catalan d'Oncologie - Perpignan 6 Centre Catherine de Sienne - Nantes 2 Centre de Radiothérapie de la Robertsau Strasbourg 9 Centre d'Oncologie de la Theuillerie Ris Orangis 1 Centre d'Oncologie Saint Yves - Vannes 0 Centre Etienne Dolet 0 Clinique Armoricaine de Radiologie Saint Brieuc 25 Clinique de Valdegour - Nimes 0 Clinique d'Occitanie - Muret 0 Clinique du Parc - Toulouse 29 Clinique du Pont de Chaumes - Mautauban 4 Clinique Hartmann - Neuilly-sur-Seine 1 Clinique Saint Jean Languedoc - Toulouse 1 Clinique Sainte Marguerite - Hyères 1 Clinique Valdegour - Nimes 8 Groupe de Radiothérapie et d'Oncologie des Pyrénées - Pau 2 Groupe Hospitalier Paris St-Joseph 6 Institut de Cancérologie de la Loire St Priest en Jarrez 23 Institut Privé de Cancérologie de Grenoble 6 Institut Sainte Catherine - Avignon 2 Oncodoc Centre Radiothérapie Oncologie 1 PolyClinique Bordeaux Nord Aquitaine 0 Polyclinique de la Louvière - Lille 0 Polyclinique de l'Ormeau 0 Polyclinique des 4 pavillons Bordeaux Rive Droite 0 Polyclinique du Parc - Caen 1 Polyclinique du Parc - Cholet 0 Polyclinique Marzet Total Pac g u Get s eur tum upe U G o r G T GE 1 129 etranger Nom établissement TOTAL Inclusions 2008 Belgique - Clinique Saint Luc 0 Slovaquie - NCT Bratilava 3 USA - MDACC - Houston 3 Total 44 RappoRt d'activité 2008 Bureau d’Études Cliniques et Thérapeutiques 6 RappoRt d'activité 2008 45 Bureau d’Études Cliniques et Thérapeutiques AN CIEN PAC poumon Coordonnateur du Groupe Dr Cécile Le-péchoux, Institut Gustave Roussy, Villejuif. Groupe tumeurs POUMON Groupe tumeurs POUMON etude en cours d’inclusions en 2008 PROTEGE 01/0601 - IFCT05/03 « Lung ART » D epuis 1999, année de création de l’Intergroupe Francophone de Cancérologie Thoracique (IFCT), le groupe POUMON, qui a largement contribué à fonder les bases de cet intergroupe, a eu des difficultés à maintenir son activité. En effet, l’activité a été portée par le groupe IFCT. Malgré une réunion annuelle d’une vingtaine de participants, peu d’essais ont été mis en place : 4 essais sur le cancer bronchique à petites cellules, un essai de phase II randomisée sur le cancer bronchique non à petites cellules, coordonné par Thierry Le Chevalier et enfin l’essai LungART, soutenu par l’Institut National du Cancer (INCa) et à ouverture internationale. Un groupe de personnes dédiées a mis beaucoup d’énergie dans le lancement de la seule étude active au sein du groupe poumon : Lung ART PROTEGE 01/0601, un essai de phase III (monitoré par l’IFCT), ouvert en juillet 2007. Cet essai pose une question majeure pour la prise en charge des patients ayant bénéficié d’une exérèse complète de leur Cancer bronchique non à petites cellules. Cependant, le recrutement est lent notamment en raison du retard à l’ouverture des centres. Ces ouvertures étaient conditionnées par la validation d’un contrôle de la qualité de la prise en charge de radiothérapie. Pour l’année 2008, il n’y a pas eu de réunion du groupe Poumon. Aucun autre essai n’est à ce jour en discussion dans le groupe dont la pérennité est donc remise en question en 2009. Coordonnateur du Groupe Dr Cécile Le-péchoux, Investigateur coordonnateur : Dr Cécile Le-pÉchoux, Institut Gustave Roussy, Villejuif. • Essai de phase III comparant une radiothérapie médiastinale conformationnelle post-opératoire à l’absence de radiothérapie après chirurgie complète chez des patients présentant un Carcinome Bronchique Non à Petites Cellules (CBNPC) avec envahissement médiastinal N2. Dans une pathologie aussi fréquente que le Carcinome Bronchique Non à Petites Cellules (CBNPC), alors que le nombre de survivants augmente grâce à l’amélioration de la prise en charge chirurgicale et à la chimiothérapie (CT) adjuvante, il semble important, d’évaluer par une nouvelle étude randomisée, une radiothérapie post-opératoire (RPO) plus moderne. Cet essai randomisé, multicentrique international a pour objectif principal de comparer une radiothérapie médiastinale conformationnelle post-opératoire (54 Gy en 27 à 30 séances) à l’absence de radiothérapie après chirurgie complète chez des patients présentant un Carcinome Bronchique Non à Petites Cellules (CBNPC) avec envahissement médiastinal N2. D’après la littérature, le taux de survie sans récidive à 3 ans étant de 30 %, et le risque de rechute locale atteignant également 30 % à 3 ans, après exérèse complète d’un CBNPC avec envahissement médiastinal (pN2 chirurgical en l’absence de traitement d’induction ou N2 prouvé histologiquement avant chimiothérapie pré-opératoire), nous faisons l’hypothèse que ces résultats pourraient être améliorés avec une radiothérapie plus moderne et conformationnelle. Aussi, pour mettre en évidence une différence de 10 % en terme de survie sans récidive à 3 ans avec une radiothérapie conformationnelle post-opératoire, il faut inclure un total de 700 patients (test bilatéral, puissance de 80 %, α=5 % ; analyse avec une médiane de suivi de 3 ans). Vue la toxicité rapportée dans les études précédentes, une étude de recherche translationnelle est également associée à ce projet, afin d’explorer de possibles facteurs prédictifs de toxicité, ainsi que des facteurs prédictifs d’efficacité du traitement (analyse sur les blocs tumoraux et prélèvements sanguins). Institut Gustave Roussy, Villejuif CONTACTS au 1er JUIN 2009 Groupe tumeurs POUMON Un contrôle de qualité indépendant concernant la radiothérapie conformationnelle est intégré à l’étude. Chef de Projets Assistante de Projets Christine REGNAULT Laurent DELLUC ARC De plus, une étude médico-économique spécifique est menée en parallèle, pour les centres français uniquement. tél. 01 44 23 55 77 [email protected] tél. 01 44 23 04 68 [email protected] tél. 01 44 23 55 72 [email protected] Ce projet international est en collaboration avec plusieurs intergroupes dont l’IFCT, l’EORTC (avec les groupes Radiotherapy Oncology Group et Fabienne Gouttenoire 46 RappoRt d'activité 2008 Bureau d’Études Cliniques et Thérapeutiques RappoRt d'activité 2008 47 Bureau d’Études Cliniques et Thérapeutiques s eur tum N upe o r G MO PO U Groupe tumeurs POUMON Coordonnateur du Groupe Dr Cécile Le-péchoux, Institut Gustave Roussy, Villejuif. Coordonnateur du Groupe Dr Cécile Le-péchoux, Institut Gustave Roussy, Villejuif. Lung Group) et autres groupes dont l’Espagne (LARS-G : Lung cancer Adjuvant Radiotherapy Spanish Group). Cette étude, portant sur 700 patients (dont environ 300 pour la France) a reçu l’avis favorable du CCPPRB le 22 juin 2006 et retour de la DGS en août 2006. Une version amendée au protocole a été validée par le CPP et la DGS en octobre et novembre 2006. Gro up PO e tumeur U MO s N Groupe tumeurs POUMON Inclusions 2008 par type d’établissement CLCC (suite) Centre René Gauducheau 0 Centre Val d'Aurelle - Paul Lamarque 0 La 1ère mise en place de l’essai a été réalisée le 8 février 2007. Institut Claudius Regaud 0 Des amendements au protocole ont été proposés dernièrement afin, entre autre, d’améliorer le recrutement. Institut Curie 0 Institut Gustave Roussy 1 Total 10 Etat d’avancement à Fin décembre 2008 Hôpitaux Publics EN FRANCE - 45 centres ont été déclarés aux Autorités Ethiques et règlementaires - 38 ont eu une visite de mise en place - 28 centres ouverts aux inclusions, c’est-à-dire, qui ont validé l’étape indispensable de contrôle qualité de la radiothérapie qui consiste à réaliser un plan de radiothérapie pour un patient virtuel (Dummy-run). - 28 patients inclus par 13 centres (dont le 1er le 7 août 2007). EN ESPAGNE - 6 centres déclarés et ouverts aux inclusions sur les 8 centres participants. Nom établissement TOTAL Inclusions 2008 CHI de Créteil 0 CHRU Tours 0 CHU Clermont Ferrand 0 CHU Côte de Nacre - Caen 3 CHU Toulouse 2 Hôpitaux Civils de Colmar 1 Hospices Civils de Lyon 0 Total 6 EORTC - 19 centres répartis sur 6 pays (Belgique, Pays Bas, Royaume-Uni, Italie, Pologne, Slovénie) ont donné leur accord de participation. Les démarches règlementaires sont en voie de finalisation. En fin d’année 2008, il a été envisagé, de procéder à un transfert de promotion de cet essai, de la FNCLCC vers l’IGR : des réunions en ce sens ont eu lieu afin d’aboutir à ce changement de façon optimale pour tous. Inclusions 2008 par type d’établissement ASSISTANCE PUBLIQUE Nom établissement TOTAL Inclusions 2008 AP-HP Hôpital Avicenne 0 AP-HP Hôpital Européen Georges Pompidou 1 AP-HP Hôpital Saint Antoine 0 AP-HP Hôpital Saint Louis 0 AP-HP Hôpital Tenon 3 Total 4 CLCC Nom établissement TOTAL Inclusions 2008 etABLISSEMENTS PRIVES Nom établissement TOTAL Inclusions 2008 Centre Antoine Lacassagne 2 Centre Eugène Marquis 1 Centre Catherine de Sienne - Nantes 0 Centre François Baclesse 0 0 Centre d'Oncologie et de Radiothérapie du Parc - Dijon 0 Centre Georges-François Leclerc Centre Henri Becquerel 0 0 Clinique Armoricaine de Radiologie - Saint Brieuc 2 Centre Jean Perrin Centre Oscar Lambret 2 Clinique Victor Hugo - Centre Jean Bernard 2 Centre Paul Papin 0 Institut Sainte Catherine - Avignon 1 Centre Paul Strauss 4 48 RappoRt d'activité 2008 Bureau d’Études Cliniques et Thérapeutiques Total 5 RappoRt d'activité 2008 49 Bureau d’Études Cliniques et Thérapeutiques s eur tum N upe o r G MO PO U Coordonnateurs du Groupe Dr Odile Oberlin, coordonnateur pédiatrie, Institut Gustave Roussy, Villejuif Pr Jean-Yves Blay, coordonnateur adultes Centre Léon Bérard, Lyon Groupe tumeurs SARCOME AN CIEN PAC sarcome Groupe tumeurs SARCOME Etudes en cours en 2008 SARCOME 01 EURO – EWING 99 L e Groupe tumeurs Sarcome de la FNCLCC a débuté ses activités en 1999 avec une grande étude internationale dans une tumeur rare, le sarcome d’EWING. Grâce aux collaborations étroites entre le Groupe Sarcomes Français (GSF) et la Société Française d’Oncologie Pédiatrique (SFCE), la France a contribué à l’inclusion de près de 30% des 2570 patients inclus à ce jour dans cette étude. Depuis 1999, 9 études ont été initialisées avec l’inclusion de plus de 1300 patients. Elles ont déjà fait l’objet de 2 présentations orales à l’ASCO, et deux publications dans le Journal of Clinical Oncology. Cette forte activité du groupe est le fruit d’une collaboration étroite avec les groupes académiques français mais également internationaux tels que l’EORTC. De plus, tous nos essais cliniques sont adossés à des études de transfert, nos études ciblant des sous-groupes de tumeurs de plus en plus homogènes sur le plan moléculaire. Les sarcomes sont maintenant considérés comme un groupe de maladies différentes en fonction de leurs biologies qui nécessitent des prises en charge thérapeutiques différenciées, les GIST (Gastro-Intestinal Stromal Tumours) en étant l’exemple type. Notre groupe est dédié à l’amélioration du pronostic et de la qualité de vie de nos patients grâce à son implication dans la recherche clinique et translationnelle. Coordonnateurs du Groupe Dr Odile Oberlin, Coordonnateur pédiatrie, Institut Gustave Roussy, Villejuif Pr Jean-Yves Blay, Coordonnateur adultes, Centre Léon Bérard, Lyon CONTACTS au 1er JUIN 2009 Groupe tumeurs SARCOME Chef de Projets Assistante de Projets tél. 01 44 23 55 58 [email protected] tél. 01 44 23 04 15 [email protected] Marta JIMENEZ 50 RappoRt d'activité 2008 Bureau d’Études Cliniques et Thérapeutiques Patricia NEZAN ARC Coordonnateur Céline MAHIER-AIT OUKHATAR tél. 01 44 23 55 84 [email protected] ARC Etude Sarcome 09 Bochra HACHANI tél. 01 44 23 04 14 [email protected] Investigateur coordonnateur : Dr Odile Oberlin, Institut Gustave Roussy, Villejuif. • Protocole de traitement des tumeurs d’Ewing : essais randomisés avec évaluation médico-économique. Comparaison de chimiothérapies de consolidation : - VAI versus VAC pour les tumeurs de risque standard - Chimiothérapie à haute dose versus chimiothérapie conventionnelle pour les tumeurs de haut risque. L’année 2008 a vu la poursuite du recrutement dans les localisations R1 (tumeurs localisées de risque standard), R2 loc (tumeurs localisées de mauvais pronostic) et R2 pulm (tumeurs métastatiques aux poumons et à la plèvre) avec respectivement 255, 60 et 58 patients inclus en France pour un total, tous groupes confondus, de 2596 patients en base. Le fait majeur a porté sur la mise au jour en France de cas de toxicités post-radiques graves, létales dans certains cas, principalement sur la moelle épinière et sur l’appareil digestif pour les patients de mauvais pronostic recevant une radiothérapie après l’association busulfan-melphalan (BUMEL). Certains de ces cas étaient connus et déclarés aux autorités depuis 2003 et avaient d’ailleurs conduit à une adaptation du protocole de radiothérapie en limitant la dose d’irradiation reçue par la moelle épinière après une exposition au BUMEL. A la suite de ces premiers cas, une étude a été menée directement sur les dossiers hospitaliers par le groupe des radiothérapeutes de la SFCE. Cette étude a permis de reclasser comme toxiques certains événements qui n’avaient pas été considérés comme reliés au traitement auparavant. Au total, 4 décès toxiques suite à une radiothérapie sur le tube digestif et 3 toxicités médullaires majeures sont à déplorer en France en rapport direct avec une potentialisation de la toxicité radique par le BUMEL. Immédiatement, les autorités de santé et le CPP ont été informés de ces cas, en même temps que les investigateurs de l’essai et les groupes coopérateurs internationaux participants. La toxicité de la chimiothérapie haute dose à base de BUMEL, dans cette population de patients de mauvais pronostics, est connue depuis longtemps et des règles d’arrêt avaient clairement été définies d’emblée à la rédaction du protocole, le taux de décès toxiques ne devant pas dépasser 5 %. Ce taux n’a pas été atteint dans la population générale de l’étude, mais a été atteint dans la sous-population de patients de mauvais pronostic avec des tumeurs axiales. La conséquence immédiate a été la suspension de l’étude pour les patients R2 à risque, c’est-à-dire ceux présentant une localisation tumorale pelvienne impliquant une irradiation de tout ou partie du tube digestif. L’analyse a également identifié que le risque d’apparition de ces toxicités était associé à une dose élevée d’irradiation. Ces doses d’irradiations plus élevées ne sont pas administrées dans les autres pays participants RappoRt d'activité 2008 51 Bureau d’Études Cliniques et Thérapeutiques s eur tum E upe o r G COM SA R Groupe tumeurs SARCOME Coordonnateurs du Groupe Dr Odile Oberlin, coordonnateur pédiatrie, Institut Gustave Roussy, Villejuif Pr Jean-Yves Blay, coordonnateur adultes Centre Léon Bérard, Lyon Coordonnateurs du Groupe Dr Odile Oberlin, coordonnateur pédiatrie, Institut Gustave Roussy, Villejuif Pr Jean-Yves Blay, coordonnateur adultes Centre Léon Bérard, Lyon ce qui explique probablement pourquoi seule la France a déclaré ce type d’événement. Les investigateurs oncologues et radiothérapeutes ont été très largement sensibilisés à ces risques et aux actions à mettre en œuvre pour les éviter. Il leur a été également rappelé l’importance de respecter les procédures et les délais de déclaration des événements indésirables graves (EIG) auprès de la pharmacovigilance du promoteur qui joue le rôle primordial de sentinelle de la sécurité des essais cliniques. Les premiers résultats obtenus sur les localisations non utérines ont été présentés oralement à la conférence de l’ASCO en juin 2008 (Duffaud et al, J Clin Oncol 26: 2008 , abstr 10511). On ne retrouve pas de différence en terme de réponse objective (5 % dans les 2 bras), de survie sans progression à 6 mois (46 % dans les 2 bras) et de survie globale (65 % à 9 mois dans les 2 bras) alors qu’il existe une activité intéressante des 2 traitements, notamment sur la survie sans progression. Aucun argument ne permet donc de privilégier la combinaison à la gemcitabine seule dans les léiomyosarcomes non utérins. Les résultats sur les léiomyosarcomes utérins sont attendus pour 2009. SARCOME 07 : LMS TAXOGEM Investigateurs coordonnateurs : Sarcomes de tissus mous : Pr Florence Duffaud, Hôpital de la Timone, Marseille. Gro up SA R e tumeu COMrs Groupe tumeurs SARCOME Localisations utérines : E SARCOME 09 : OS 2006 Dr Patricia Pautier, Institut Gustave Roussy, Villejuif. Investigateurs coordonnateurs : Enfants : • Etude de phase II randomisée étudiant l'efficacité de la gemcitabine et de l'association gemcitabine/docétaxel en deuxième ligne dans les léiomyosarcomes utérins ou des tissus mous métastatiques et/ou en rechute inopérables. Dr Laurence Brugières, Institut Gustave Roussy, Villejuif. Adultes : Dr Sophie Piperno-Neumann Le traitement systémique des patients atteints de sarcomes des tissus mous en phase avancée ou métastatique reste insatisfaisant avec peu d’anticancéreux efficaces. Pour les sarcomes des tissus mous évolués, il n’existe pas de chimiothérapie de deuxième ligne de référence après échappement à une première ligne de chimiothérapie à base d’anthracycline seule ou associée à l’ifosfamide. Même si la stratégie thérapeutique a été la même pour tous les sous-types histologiques de sarcomes, il devient maintenant évident que chaque sous-type histologique distinct a un comportement clinique différent et présente une chimiosensibilité différente. En 2004, la pratique clinique passe d’une chimiothérapie indifférenciée pour tous les soustypes histologiques de sarcomes des tissus mous à une chimiothérapie spécifique pour chaque sous-type histologique distinct de sarcome. D’où le souhait d’étudier l’activité clinique de la gemcitabine et de l’association gemcitabine et docétaxel dans le sous-type histologique des léiomyosarcomes en phase métastatique ou inopérables. Gemcitabine D1 D8 D15 D1=D29 D8 D15 G G G G G G Randomization Gemcitabine + Docetaxel CYCLE N CYCLE N+1 G G+D G D1 D8 D1=D22 52 RappoRt d'activité 2008 Bureau d’Études Cliniques et Thérapeutiques Lenogastrim D9-D15 G+D D8 Lenogastrim D9-D15 Institut Curie, Paris. • Etude Intergroupe (SFCE/GSF-GETO) OS2006 ZoledronateOstéosarcome. Protocole de traitement des ostéosarcomes de l’enfant, de l’adolescent et de l’adulte comportant un essai randomisé et des études biologiques. Les biphosphonates sont des analogues synthétiques des pyrophosphates endogènes dont la fonction principale est d’inhiber la résorption osseuse. Leur utilisation s’est imposée depuis une dizaine d’années pour le traitement de l’ostéoporose, des pathologies ostéolytiques dans le traitement de l’hypercalcémie et, plus récemment, dans la prévention des complications des métastases osseuses. In vitro, plusieurs publications montrent un effet bénéfique des biphosphonates sur des lignées d’ostéosarcome par l’inhibition de la prolifération cellulaire, l’induction d’apoptose, la réduction de l’invasion cellulaire. Deux modèles animaux ont été étudiés et semblent indiquer que le zolédronate peut avoir une efficacité sur la prolifération des cellules d’ostéosarcome non seulement au niveau osseux mais également au niveau des localisations pulmonaires. L’ensemble de ces résultats pré-cliniques constitue une base solide pour l’élaboration d’un protocole de recherche clinique afin de déterminer si les N-Biphosphonates potentialisent l’effet anti-tumoral des agents alkylants. L’objectif principal de cet essai de phase III est d’évaluer l’efficacité de l’adjonction d’un traitement par zolédronate au traitement classique, associant chimiothérapie et chirurgie, sur la survie sans événement des malades adultes et enfants porteurs d’un ostéosarcome. Il est prévu de randomiser 470 patients (235 dans le bras zolédronate + 235 dans le bras sans zolédronate). RappoRt d'activité 2008 53 Bureau d’Études Cliniques et Thérapeutiques s eur tum E upe o r G COM SA R 150 127 126 100 Etudes closes SARCOME 08 : EORTC 62024 Investigateur coordonnateur : Dr Axel Le Cesne, Institut Gustave Roussy, Villejuif. • Intermediate and high risk localized, completely resected, gastrointestinal stromal tumors (GIST) expressing KIT receptor : a controlled randomized trial on adjuvant Imatinib mesylate (Glivec®) versus no further therapy after complete surgery. Les GIST (Gastro-Intestinal Stromal Tumors) sont des tumeurs rares avec une incidence qui reste assez imprécise à ce jour. Alors qu’il y a quelques années l’incidence était estimée à moins de 0,5/100.000/an, aujourd’hui elle est autour de 1,5/100.000/an. L’introduction de l’imatinib (Glivec®) dans l’arsenal thérapeutique de l’oncologue est sans aucun doute à l’origine de cette augmentation des cas diagnostiqués. L’imatinib a effectivement démontré son efficacité dans le traitement des GIST de stade avancé. Après en être devenu le traitement standard, il était logique d’explorer son efficacité dans le traitement adjuvant des GIST localisés, objet de cette étude. Il s’agit d’un essai intergroupe coordonné par l’EORTC Soft Tissue and Bone Sarcoma Group (EORTC STBSG) en collaboration avec plusieurs groupes sarcomes européens incluant les groupes Italien (ISG), Espagnol (GEIS) et Français (GSF-GETO) - avec le concours de la Fédération Francophone de Cancérologie Digestive (FFCD) - et au total la participation de 12 pays dans le monde. 54 RappoRt d'activité 2008 Bureau d’Études Cliniques et Thérapeutiques 80 50 Espagne GdeBretagne Allemagne 0 Italie E 84 France La sécurité des patients reste un sujet d’actualité dans cette étude avec la tenue de 2 sessions du Comité de Surveillance des Données (IDMC), en juillet puis en décembre 2008, pour évaluer la balance bénéficerisque au regard des données de toxicités rapportées et tenues à jour. Ce rapport reste favorable à la poursuite de l’étude en 2009, mais la surveillance des hypocalcémies reliées au zolédronate est toujours de rigueur, de même que toutes les autres toxicités non moins importantes occasionnées par les chimiothérapies standards (rénales, hépatiques ou neurologiques par exemple). Gro up SA R e tumeu COMrs Singapour 200 Danemark 266 Nle-Zélande 250 Groupe tumeurs SARCOME La FNCLCC a joué le rôle de promoteur délégué en France, ce qui a permis au BECT de mettre en place les centres français et de monitorer les données selon ses procédures de contrôle qualité. L’objectif initial de 400 patients a très rapidement été revu à la hausse pour aboutir à 900 patients, recrutés sans difficulté fin 2008. La France, représentée par le Groupe Sarcome Français et la FFCD 67 63 60 a tenu la tête du recrutement international avec l’inclusion 7 7 7 d’1/3 des patients, mais 14 également la pôle position de la qualité des données avec le taux le plus faible de demande de corrections par observation saisie. Cette étude est devenue l’ultime opportunité d’évaluer l’impact sur la survie de l’imatinib en situation adjuvante chez les patients ayant bénéficié d’une résection complète du GIST. L’essai ACOSOG ne répondra probablement pas à cette question pour cause de fermeture prématurée et de proposition d’imatinib aux patients du groupe « contrôle ». Une analyse intermédiaire sera déclenchée lorsque 98 décès seront constatés. Cette échéance a été repoussée au fil du temps en raison d’une amélioration spectaculaire du pronostic des GIST, notamment liée à la réintroduction de l’imatinib et à l’avènement des thérapies de seconde ligne. Il faudra donc s’armer de patience pour attendre les résultats finaux de cette très belle étude. Belgique 300 Pologne Depuis septembre 2007, l’étude est en phase active de recrutement avec 67 patients inclus en 2008 soit un total de 97 patients, dont 48 participent à l’essai randomisé. Depuis la suspension temporaire de l’étude en 2006 liée à l’apparition d’une hypocalcémie sévère chez un jeune patient, le recrutement accuse un retard qui n’a pas été comblé sur l’année 2008. Seuls 26 centres sur les 49 centres ouverts dans toute la France sont réellement actifs sur 2008 et un nombre plus important que prévu de patients présente des contre-indications au traitement. Il reste que cette étude est difficile à proposer, et que le taux de refus est élevé, aussi bien chez les adultes qu’en pédiatrie. Coordonnateurs du Groupe Dr Odile Oberlin, coordonnateur pédiatrie, Institut Gustave Roussy, Villejuif Pr Jean-Yves Blay, coordonnateur adultes Centre Léon Bérard, Lyon Hollande Coordonnateurs du Groupe Dr Odile Oberlin, coordonnateur pédiatrie, Institut Gustave Roussy, Villejuif Pr Jean-Yves Blay, coordonnateur adultes Centre Léon Bérard, Lyon Australie Groupe tumeurs SARCOME SARCOME 02 : palsar ii Investigateur coordonnateur : Dr Binh N’Guyen Bui, Institut Bergonié, Bordeaux. • Protocole clinique multicentrique randomisé de phase III comparant une consolidation par chimiothérapie à haute dose à la poursuite de la chimiothérapie conventionnelle dans les sarcomes des tissus mous de l’adulte avancés en réponse partielle ou complète après 4 cures de MAID. Pour cet essai démarré en 2000, et ayant randomisé en novembre 2008, laborieusement, 87 patients sur 100 attendus, un Comité Indépendant de revue des Données a été sollicité pour statuer sur la poursuite de l’étude. Aussi bien sur la base des données de sécurité que sur celles d’efficacité, l’IDMC a opté pour un arrêt de l’étude. RappoRt d'activité 2008 55 Bureau d’Études Cliniques et Thérapeutiques s eur tum E upe o r G COM SA R Coordonnateurs du Groupe Dr Odile Oberlin, coordonnateur pédiatrie, Institut Gustave Roussy, Villejuif Pr Jean-Yves Blay, coordonnateur adultes Centre Léon Bérard, Lyon Stabilité/RP 4 MAID J1 = J22 Chir d’exérèse possible, dans les 5 semaines suivant le 4ème cycle de MAID Si stabilité : exérèse complète obligatoire pour randomisation RC Progression BRAS A = TÉMOIN RANDOMISATION Groupe tumeurs SARCOME 2 MAID (J1 = J22) BRAS B = INTENSIFIÉ MAID puis collecte CSP (collecte possible au décours de la 4ème cure de MAID) Sortie MICE suivi d’autogreffe En effet, l’analyse des données n’a montré aucun avantage à l’intensification + greffe, aussi bien sur la tolérance que sur la survie sans récidive ou survie globale. De plus, cette analyse a permis de déceler que les hypothèses initiales n’étaient plus valables et n’auraient pas permis de conclure avec l’effectif envisagé, d’où l’arrêt pour futilité. Ces résultats seront présentés en session orale lors de la conférence de l’ASCO 2009 avec comme message la confirmation de la fin des polychimiothérapies prescrites indistinctement à tous les types histologiques et l’ouverture à de nouveaux concepts. Gro up SA R e tumeu COMrs E Sarcome 04 Investigateur coordonnateur : Dr Odile Oberlin, Institut Gustave Roussy, Villejuif. • Etude de Phase II de l'association Cis-platinum + VP16 chez les patients atteints de tumeurs d'Ewing (ou apparentées) réfractaire ou en rechute. Cet essai de phase II s’adressait aux patients atteints d’une tumeur d’Ewing réfractaire ou en rechute après un premier traitement. La stratégie thérapeutique proposée à ces patients de très mauvais pronostic consistait en l’administration d’une chimiothérapie à base de cisplatine en perfusion et de VP16 par voie orale, de façon intensive sur une courte durée, avec pour objectif principal d’évaluer l’activité antitumorale de cette association. Au total, après 45 patients inclus, cet essai a été clos aux inclusions. Le travail de relecture de l’imagerie tumorale s’est avéré compliqué avec 18 % des cas qui n’ont pas permis d’évaluer la réponse au traitement. Avec un taux de réponses inférieur à 20 % sur une population évaluable insuffisante, il ne sera donc pas possible de conclure convenablement par rapport aux hypothèses fixées. Néanmoins, pour cette étude menée dans une situation médicale où les alternatives thérapeutiques sont extrêmement limitées, ces résultats à publier en 2009 seront utiles à la communauté scientifique pour orienter de nouvelles recherches. Coordonnateurs du Groupe Dr Odile Oberlin, coordonnateur pédiatrie, Institut Gustave Roussy, Villejuif Pr Jean-Yves Blay, coordonnateur adultes Centre Léon Bérard, Lyon Résultats obtenus en 2008 SARCOME 06 : ANGIOTAX Investigateur coordonnateur : Dr Nicolas PENEL, Centre Oscar Lambret, Lille. L’essai Angiotax a fait l’objet d’une publication dans le Journal of Clinical Oncology (J. Clin. Oncol. 26 : 5269-5274, 2008). SARCOME 07 : taxogem Investigateur coordonnateur : Dr Nicolas PENEL, Bureau d’Études Cliniques et Thérapeutiques s eur tum E upe o r G COM Centre Oscar Lambret, Lille. L’essai Taxogem a fait l’objet d’une présentation orale à la conférence de l’ASCO 2008 (Abstract 10511). Inclusions 2008 par type d’établissement CLCC Nom établissement TOTAL Inclusions 2008 Centre Alexis Vautrin 1 Centre Antoine Lacassagne 3 Centre Eugène Marquis 5 Centre François Baclesse 4 Centre Georges-François Leclerc 1 Centre Henri Becquerel 2 Centre Jean Perrin 1 Centre Léon Bérard 31 Centre Oscar Lambret 15 Centre Paul Papin 0 Centre Paul Strauss 0 Centre René Gauducheau 8 Centre René Huguenin 0 Centre Val d'Aurelle - Paul Lamarque 4 Institut Bergonié 10 Institut Claudius Regaud 10 Institut Curie 31 Institut Gustave Roussy 21 Institut Jean Godinot 0 Institut Paoli-Calmettes 2 Total 56 RappoRt d'activité 2008 Groupe tumeurs SARCOME 149 RappoRt d'activité 2008 57 Bureau d’Études Cliniques et Thérapeutiques SA R Groupe tumeurs SARCOME Coordonnateurs du Groupe Dr Odile Oberlin, coordonnateur pédiatrie, Institut Gustave Roussy, Villejuif Pr Jean-Yves Blay, coordonnateur adultes Centre Léon Bérard, Lyon Coordonnateurs du Groupe Dr Odile Oberlin, coordonnateur pédiatrie, Institut Gustave Roussy, Villejuif Pr Jean-Yves Blay, coordonnateur adultes Centre Léon Bérard, Lyon Inclusions 2008 par type d’établissement Inclusions 2008 par type d’établissement Hôpitaux Publics Nom établissement Gro up SA R e tumeu COMrs E Groupe tumeurs SARCOME ASSISTANCE PUBLIQUE TOTAL Inclusions 2008 Nom établissement TOTAL Inclusions 2008 CH de Beauvais 0 AP-HM Hôpital la Timone 8 CH de Pau 1 AP-HP GIH Bichat Claude Bernard 0 CH du Mans 0 AP-HP Hôpital Ambroise Paré 1 CH Mont de Marsan 0 AP-HP Hôpital Avicenne 0 CH Robert Boulin - Libourne 2 AP-HP Hôpital Cochin 0 CH Versailles- Hôpital André MIGNOT(Le Chesnay) 0 AP-HP Hôpital Européen Georges Pompidou 0 AP-HP Hôpital Hôtel Dieu 0 CHR Orléans - Hôpital la Source 0 AP-HP Hôpital Saint Antoine 0 CHR Reims 0 AP-HP Hôpital Saint Louis 1 CHR Rennes 0 AP-HP Hôpital Tenon 1 CHRU Brest 1 CHRU Lille 0 CHRU Tours 0 CHU Amiens - Hôpital Nord 3 CHU Angers 1 CHU Besançon 10 CHU Clermont Ferrand 0 CHU Côte de Nacre - Caen 2 CHU de Tours 2 CHU Dijon 0 CHU Grenoble 1 Croix Rouge Française - Margency 0 CHU Hôpitaux de Bordeaux 1 0 Institut de Cancérologie de la Loire - St Priest en Jarrez 6 CHU Limoges CHU Montpellier 5 CHU Nancy 2 CHU Nantes 10 CHU Nice 0 CHU Poitiers 0 CHU Rennes 7 CHU Rouen - Hôpital Charles Nicolle 3 CHU Toulouse 3 Hôpitaux Universitaires de Strasbourg 4 Hospices Civils de Lyon 3 Total 58 RappoRt d'activité 2008 Bureau d’Études Cliniques et Thérapeutiques AP-HP Hôpital Trousseau 3 Total 14 etABLISSEMENTS PRIVES Nom établissement TOTAL Inclusions 2008 Total 6 65 RappoRt d'activité 2008 59 Bureau d’Études Cliniques et Thérapeutiques s eur tum E upe o r G COM SA R Groupe tumeurs SEIN AN CIEN PAC sei n Coordonnateur du Groupe Dr Thierry DELOZIER, Oncologue, Centre François Baclesse, Caen. Groupe tumeurs SEIN Etudes ouvertes aux inclusions en 2008 ONCO 03/0701 - LIBER L e Groupe Sein a su démontrer depuis sa naissance, sa capacité à initier et conduire de grands essais adjuvants de qualité (programmes PACS), mais aussi sa capacité à être un groupe leader en terme de recrutement dans les essais internationaux (essai MINDACT-PACS 07). Depuis les premiers essais PACS, le champ de recherche du Groupe s’est élargi et couvre maintenant un éventail très large de problématiques liées au cancer du sein. Tous les stades de la maladie sont dans son domaine d’investigation : des cancers inflammatoires (essai PACS 09) aux carcinomes intracanalaires (essai IBIS II). De même, les études portant sur des populations spécifiques (femmes jeunes avec l’essai RTS 01, femmes âgées avec les essais GÉRICO SEIN) se développent. La recherche de transfert est de plus en plus présente et chaque nouveau projet porté par le Groupe est doté dorénavant d’un volet spécifiquement dédié aux études biologiques. Par ailleurs, de nouveaux projets portant sur des populations définies par un critère biologique commencent à voir le jour (essai PACS 08). Il est à souligner enfin que le domaine de la prévention est à l’honneur avec un portefeuille de 3 essais couvrant l’ensemble des populations présentant un facteur de risque : mutation BRCA1/2, risque intrafamilial et femmes porteuses d’un cancer in situ. Coordonnateur du Groupe « Prévention du cancer du sein chez les femmes porteuses de la mutation BRCA1/BRCA2 par le Létrozole ». Investigateur coordonnateur : Pr Pascal PUJOL, CHU Arnaud de VILLENEUVE, Montpellier. • L’objectif principal de l’essai est d’évaluer la réduction d’incidence des cancers du sein invasifs chez des femmes ménopausées porteuses d’une mutation BRCA1/BRCA2 traitées par Létrozole. - Autorisation initiale de l’AFSSAPS : 20/03/2007. - Avis favorable initial émis par le CPP : 02/07/2007. - Date d’ouverture : 08 Février 2008. La 1ère femme a été incluse en Mai 2008. - La durée globale de l’essai est de 13 ans : • 3 ans d’inclusion, • 5 ans de traitement, • 5 ans de suivi. - 724 patientes sont attendues. - Au 31 décembre 2008 : • 30 sites sont déclarés participants, • 25 sites sont ouverts, • 12 sites sont actifs, - 22 femmes ont été incluses. Cet essai est conduit conjointement par le Groupe Génétique et Cancer et le Groupe SEIN. À noter que cet essai a été retardé de presqu’un an dans son ouverture en raison des difficultés de mise à disposition des traitements par le partenaire industriel. Dr Thierry DELOZIER PACS 09/0802 - Beverly 1 Oncologue, Centre François Baclesse, Caen. « Essai de phase II d’évaluation de l’efficacité et de la tolérance du bevacizumab (Avastin®) dans les cancers du sein infllammatoire HER2- ». Investigateur coordonnateur : CONTACTS au 1er JUIN 2009 Groupe tumeurs SEIN Assistantes de Projets Chef de Projets Christine PHILIPPE tél. 01 44 23 04 72 [email protected] tél. 01 44 23 55 56 [email protected] Sara GARCIA tél. 01 44 23 04 65 [email protected] Anne-Laure MARTIN 60 RappoRt d'activité 2008 Bureau d’Études Cliniques et Thérapeutiques ARC Coordonnateurs Christel MESLEARD tél. 01 44 23 55 51 [email protected] Sylvie MIJONNET tél. 01 44 23 04 75 [email protected] Pr Patrice VIENS, Institut Paoli-Calmettes, Marseille. • L’objectif principal de l’essai est d’évaluer le taux de réponses complètes histologiques sur pièce opératoire après traitement par bevacizumab dans les cancers inflammatoires du sein. RappoRt d'activité 2008 61 Bureau d’Études Cliniques et Thérapeutiques s eur tum pe u o Gr I N S E Groupe tumeurs SEIN Coordonnateur du Groupe Dr Thierry DELOZIER, Oncologue, Centre François Baclesse, Caen. Coordonnateur du Groupe Dr Thierry DELOZIER, Oncologue, Centre François Baclesse, Caen. - Autorisation initiale de l’AFSSAPS : 11/07/2008. - Avis favorable initial émis par le CPP : 09/07/2008. - Les produits à l’étude n’ont pu être mis à disposition qu’en Décembre 2008. - Date d’ouverture : 17 Décembre 2008. - La durée globale de l’essai est de 9,5 ans : • 18 mois d’inclusion, • 24 semaines de traitement jusqu’à chirurgie/54 semaines de traitement en tout, - 5 ans de suivi après 1ère administration de traitement + 3 ans de suivi long terme. - 100 patientes sont attendues. - Au 31 décembre 2008 : • 18 sites sont déclarés participants, • 1 site est ouvert, • Aucun site actif, • Aucune patiente incluse. PACS 07/0605 - MINDACT I N Investigateur coordonnateur : Dr Suzette delaloge, Institut Gustave Roussy, Villejuif. • « Essai prospectif randomisé comparant la signature génomique d’Amsterdam aux critères cliniques et anatomopathologiques usuels, pour la sélection des patientes présentant un cancer du sein sans envahissement ganglionnaire ou avec 1 à 3 ganglions envahis, susceptibles de bénéficier de l’administration d’une chimiothérapie adjuvante ». Ce vaste essai international est promu en Europe par l’EORTC qui en a confié la gestion à la FNCLCC sur le territoire Français en tant que Promoteur délégué. L’objectif principal de l’essai est d’évaluer les taux de réponse clinique complète et partielle à 6 mois dans les 2 bras. Cet essai ambitieux pose une question originale en testant non pas un traitement, mais un nouvel outil d’évaluation du pronostic : la signature « 70 gènes » d’Amsterdam. L’objectif de cet essai est de démontrer que cette signature génomique est plus discriminante pour déterminer 305 les patientes à risque élevé de rechute que les critères clinicopathologiques classiques, et par là-même, mieux cibler les patientes chez lesquelles l’emploi d’une chimiothérapie adjuvante est 88 indiqué. Deux autres questions sont également posées dans cet essai : 2008 une question de chimiothérapie Nbre inclusions Nbre R1 (Schéma à base d’anthracyclines versus l’association docetaxel/capecitabine), et une question d’hormonothérapie (tamoxifène 2 ans + létrozole 5 ans, versus létrozole 7 ans). - Autorisation initiale de l’AFSSAPS : 12/02/2007. - Avis favorable initial émis par le CPP : 03/04/2007. - Date d’ouverture : Août 2007. La 1ère patiente a été incluse en octobre 2007. - La durée globale de l’essai est de 5,5 ans : • 2 ans d’inclusion, • 6 mois de traitement, • 3 ans de suivi. - 116 patientes sont attendues. - Au 31 décembre 2008 : • 6 sites sont déclarés participants, • 5 sites sont ouverts, • 5 sites sont actifs, • 36 patientes ont été incluses. - Autorisation initiale de l’AFSSAPS : 04/08/2006. - Avis favorable initial émis par le CPP : 07/07/2006. - Date d’ouverture : • Juillet 2007 pour les questions portant sur l’outil diagnostic (question principale) et l’hormonothérapie, • Mars 2008 pour la question de chimiothérapie. - La 1ère patiente a été incluse le 04/09/2007. - La durée globale de l’essai est de 10,5 ans : • 3 ans d’inclusion, • 6 mois environ de traitement par chimiothérapie, • 7 ans de traitement par hormonothérapie. - 6000 patientes sont attendues à l’échelle mondiale. La France s’est, en premier lieu, engagée à réaliser 600 inclusions. À noter qu’un protocole jumeau mais sous promotion Roche doit inclure une cohorte de patientes présentant un cancer du sein inflammatoire HER2+. Ces 2 projets ont été conçus avec un large objectif de recherche de transfert (génomique, protéomique, cellules circulantes, imagerie) impliquant 4 plateformes des CLCC. Gro upe S E tumeurs Groupe tumeurs SEIN Etudes en cours d’inclusion en 2008 CARMINA 02/0609 - NIMFEA 626 600 500 400 300 Investigateur coordonnateur : Dr Florence LEREBOURS, Centre René HUGUENIN, Saint-Cloud. 40 36 30 20 10 9 0 2007 2008 • « Étude multicentrique de phase II randomisée, évaluant l’efficacité de l’anastrozole et du fulvestrant dans le traitement néo-adjuvant du cancer du sein opérable chez les femmes ménopausées et ayant pour objectif l’identification de profils d’hormonosensibilité ». 62 RappoRt d'activité 2008 Bureau d’Études Cliniques et Thérapeutiques 200 100 41 0 17 2007 Nbre d’enregistrements 3 RappoRt d'activité 2008 63 Bureau d’Études Cliniques et Thérapeutiques s eur tum pe u o Gr I N S E Groupe tumeurs SEIN Coordonnateur du Groupe Dr Thierry DELOZIER, Oncologue, Centre François Baclesse, Caen. - Au 31 décembre 2008, en France/à l’échelle internationale : • 23 sites français sont déclarés participants, • 19 sites français sont ouverts dont 7 ouverts en 2008, • 16 sites français sont actifs, • 626 patientes ont été enregistrées/2174, • 3 05 patientes ont été incluses/978, dont 81 à hauts risques, 88 à risques discordants et 136 de bas risques cliniques et génomiques. - 88 patientes ont été randomisées dans R1_ Outil diagnostic/271, - 59 patientes ont été randomisées dans R2_Chimiothérapie/180, - 76 patientes ont été randomisées dans R3_Hormonothérapie/257 - 9 pays recruteurs dont la Slovénie, dernièrement ouvert. Bien que la France n’ait pu ouvrir l’essai qu’un an après la Hollande en raison de l’indisponibilité des produits de l’essai sur le territoire français, celle-ci confirme son rôle prépondérant en s’imposant comme 2ème groupe recruteur derrière la Hollande et en totalisant 31 % des inclusions. Gro upe S E tumeurs PACS 08/0610 – TavIx Investigateur coordonnateur : I N Dr Mario campone, Centre René GAUDUCHEAU, Nantes Saint-Herblain. • « Essai ouvert, multicentrique, de phase III, randomisé, évaluant l’efficacité d’un traitement séquentiel associant FEC 100 et Ixabepilone en situation adjuvante chez des patientes présentant un cancer du sein non métastatique, avec ou sans envahissement ganglionnaire, de mauvais pronostic (tumeurs triples négatives [HER2-/RE-/RP-] ou tumeurs [HER2- et RP-]) ». L’objectif principal de l’essai PACS 08-TavIx est d’évaluer le bénéfice sur la DFS à 5 ans de l’administration séquentielle 3 FEC100 + 3 Ixabépilone versus le traitement standard 3 FEC100 + 3 Docétaxel, l’ixabepilone ayant fait la preuve de son efficacité en situation métastatique chez des patientes multirésistantes, et en situation néo-adjuvante. Un réseau de centres référents anatomo-pathologistes s’est structuré afin de permettre une relecture régionalisée des paramètres RH et HER2 en vue de confirmer l’éligibilité des patientes avant randomisation. En France, les Centres Régionaux Référents identifiés sont membres du GEFPICS (Groupe d’Évaluation des Facteurs Pronostiques Immunohistochimique dans le Cancer du Sein). - La durée globale de l’essai est de 8 ans (critère principal) : - 3 ans d’inclusion, - 5 mois de traitement, - 5 ans de suivi + 5 ans de suivi à long terme. - 2500 patientes sont attendues à l’échelle internationale. 64 RappoRt d'activité 2008 Bureau d’Études Cliniques et Thérapeutiques Groupe tumeurs SEIN Coordonnateur du Groupe Dr Thierry DELOZIER, Oncologue, Centre François Baclesse, Caen. EN FRANCE - Avis favorable initial émis par le CPP : 07/06/2007. - Autorisation de l’AFSSAPS : 02/05/2007. - Date d’ouverture : 24/09/2007. La 1ère patiente a été incluse le 17/10/2007. EN BELGIQUE - Autorisation de l’Autorité Compétente Belge : 23/08/2007. - Avis favorable initial définitif émis par le Comité d’Éthique : en Avril 2008. - Date d’ouverture : 17 Avril 2008. La 1ère patiente a été incluse en Juin 2008. AUX ÉTATS-UNIS - Autorisation initiale définitive de la FDA : Août 2008. - 1er avis favorable émis par un IRB pour 3 centres investigateurs : 30 septembre 2008. - Date d’ouverture : 21 Novembre 2008. - Au 31 décembre 2008, à l’international - 90 sites sont déclarés participants (dont 66 en France, 23 en Belgique et 1 aux USA), - 71 sites sont ouverts (dont 16 en Belgique et 1 aux USA), - 52 sites sont actifs (38 en France et 14 en Belgique), - 235 patientes ont été incluses. La part respective de recrutement par pays actif est de 85 % (soit 199 patientes) pour la France et 15 % (soit 36 patientes) pour la Belgique. D’autres contacts sont actuellement développés en Europe et OutreAtlantique afin d’étendre le territoire de cet essai. Des études de recherche de transfert seront mises en œuvre dans le cadre d’un partenariat avec les groupes étrangers. Un travail collégial s’organisera pour discuter de ces études, à l’identique de ce qui s’est déjà fait dans le cadre de l’essai PACS 05. Les inventaires des prélèvements sanguins et des tumeurs congelées vont être initiés au Printemps 2009. La collecte s’effectuera en prospectif par un transporteur d’ores et déjà sélectionné. La 1ère collecte des échantillons et le transfert sur Toulouse pour les tumeurs congelées et sur Nantes pour les prélèvements sanguins sont planifiés pour l’automne 2009. Par la suite, ils s’effectueront sur la base de 2 collectes par an. RappoRt d'activité 2008 65 Bureau d’Études Cliniques et Thérapeutiques s eur tum pe u o Gr I N S E Groupe tumeurs SEIN Groupe tumeurs SEIN Coordonnateur du Groupe Dr Thierry DELOZIER, Oncologue, Centre François Baclesse, Caen. Coordonnateur du Groupe Dr Thierry DELOZIER, Oncologue, Centre François Baclesse, Caen. Les sociétés IASON et AAA, initialement autorisées à produire les lots de FLT utilisés dans l’essai, rencontrant des problèmes de production réguliers, de nouveaux travaux pour modification du process de fabrication ont récemment été entrepris, notamment chez AAA. La modification du dossier de médicament expérimental devrait en découler en 2009. FLT 01/0505 Investigateur coordonnateur : Pr Olivier COUTURIER , CHU Angers. • « Intérêt de la Tomographie par Émission de Positons avec la 3’-désoxy-3’-[18F]fluoro-thymidine ([18F]-FLT) pour l’évaluation de la réponse à la chimiothérapie néoadjuvante des cancers du sein ». IBIS II (DCIS)/0302 Investigateur coordonnateur : Dr Thierry DELOZIER , Centre François BACLESSE, Caen. L’objectif principal de l’essai est d’évaluer la capacité de la TEP à la [18F]-FLT à identifier correctement la réponse à la chimiothérapie néoadjuvante des cancers du sein localement avancés, par corrélation avec la réponse complète histologique sur pièce opératoire selon les critères anatomopathologiques de SATALOFF. - Avis favorable émis par le CPP : 31/08/2006. - Autorisation de l’AFSSAPS : 03/08/2006. - Date d'ouverture : 28/11/2006. - La durée globale de l’essai qui était initialement de 34 mois a été portée à 58 mois : • 2 ans d’inclusion, allongée en 2008 de 2 années supplémentaires, • 9 mois maximum de période de traitement, • 1 mois de période de suivi. - 100 patientes sont attendues. La 1ère patiente a été incluse le 15/02/2007. - Au 31 décembre 2008, sur les 23 sites déclarés participants, regroupés en 17 plateformes opérationnelles : • 12 sont ouverts, soit 9 plateformes ; • 6 plateformes (regroupant CHU et CRLCC) sont actives ; 29 • 29 patientes ont signé leur consentement de participation, 17 ont pu avoir le 1er examen TEP (avant traitement). Gro upe S E tumeurs I N 30 25 20 15 17 15 10 11 5 0 2007 Nbre patientes enregistrées 2008 Nbre patientes ayant reçu 1ère dose FLT 66 RappoRt d'activité 2008 Bureau d’Études Cliniques et Thérapeutiques Tous les centres investigateurs n’ont pas encore été ouverts, en raison de contraintes logistiques (livraison FLT) non encore résolues ; Ce qui explique la prolongation de la durée des inclusions. Et pour ce qui est de la production de la FLT, il est à noter que 3 sociétés sont maintenant habilitées à produire et à livrer de la FLT avec l’arrivée de CISBIO qui a livré avec succès la 1ère dose FLT en Juillet 2008. • « Essai international randomisé, en double aveugle, contrôlé, comparant le tamoxifène à l'anastrozole chez les femmes ménopausées opérées d'un carcinome canalaire in situ du sein ». Cet essai d’hormonothérapie chez les femmes présentant un carcinome canalaire in situ du sein vise à évaluer si l’efficacité de l’Anastrozole, inhibiteur de l’aromatase, s’avère supérieure à celle du Tamoxifène habituellement employé en situation adjuvante après chirurgie conservatrice du sein, en termes de réduction du risque de survenue d’un cancer du sein invasif chez les femmes porteuses d’un cancer canalaire in situ. 325 321 300 275 250 239 225 200 175 150 155 125 100 75 82 50 25 0 La FNCLCC collabore étroitement avec le Queen Mary Hospital dans la conduite de cet essai initié en 2003 en Angleterre et en 2004 en France. 21 2004 2005 2006 2007 2008 La France maintient son rôle prépondérant dans le recrutement de patientes depuis l’ouverture de l’essai (3ème groupe recruteur derrière l’Allemagne et l’Angleterre). La forte implication du BECT dans la gestion de cet essai a permis de négocier des modifications dans les procédures de l’essai, et notamment de pouvoir abandonner le CRF électronique. Cet allègement de la procédure de recueil des données a permis d’envisager la participation de nouveaux centres français. EN FRANCE -A vis favorable émis par le CCPPRB : 15/11/2003. -D ate d'ouverture en France : 11/05/2004. La 1ère patiente a été incluse le 06/09/2004. RappoRt d'activité 2008 67 Bureau d’Études Cliniques et Thérapeutiques s eur tum pe u o Gr I N S E Groupe tumeurs SEIN Coordonnateur du Groupe Dr Thierry DELOZIER, Oncologue, Centre François Baclesse, Caen. - La durée globale de l’essai qui était initialement de 14 ans, a été portée à 17 ans : • 4 ans d’inclusion, allongée en 2008 de 3 années supplémentaires, • 5 ans de traitement, • 5 ans de suivi. - Au 31 décembre 2008, EN FRANCE • 26 sites déclarés participants et ouverts (dont 5 ouverts en 2008), • 24 sont actifs, • 321 patientes sont incluses sur les 400 attendues. À l’échelle internationale • 1792 patientes sont incluses sur les 4000 attendues, • 15 pays sont recruteurs, • Les 4 premiers pays recruteurs représentent 81 % des inclusions. La France maintient sa place de 3ème pays recruteur, derrière l’Allemagne et l’Angleterre. Gro upe S E tumeurs Groupe tumeurs SEIN Coordonnateur du Groupe Dr Thierry DELOZIER, Oncologue, Centre François Baclesse, Caen. Une analyse du profil proétomique est également prévue sur les prélèvements sanguins avant et après chirurgie. EN FRANCE Date de début des inclusions : 11/12/2007 Au 31/12/2008 : 115 inclusions. Part de recrutement des centres investigateurs dans les essais en 2008 Notre Groupe est composé d’un nombre très important d’établissements appartenant à tous types de structure : les CLCC, bien évidemment, qui l’ont fait naître, mais aussi des Centres Hospitaliers (CHU/CH/CHR/ CHI), et de nombreuses Cliniques Privées qui ont toujours apporté une contribution de taille à tous les projets portés par le Groupe. s eur tum pe u o Gr I N I N S E RTS 01/0704 Investigateur coordonnateur : Dr Alain FOURQUET, Institut Curie, Paris. • Étude randomisée de phase III portant sur le complément de dose de radiothérapie à délivrer au lit tumoral chez les femmes jeunes (moins de 51 ans) traitées pour un cancer du sein. C’est un essai de radiothérapie randomisé, ouvert, multicentrique, Européen et qui est coordonné par le Professeur H. Bartelink, au Netherlands Kancer Institut, à Amsterdam. L’essai est déjà ouvert aux inclusions en Hollande et en Allemagne depuis 2006. Fin 2007, la France a rejoint ces pays (les autorisations initiales de la DGS et du CPP ont été obtenus en Août et Octobre 2007) et 17 centres dont 9 CLCC et 5 CHU ont été initialement ouverts avec pour objectif d’inclure 600 patientes sur 3 ans d’inclusions. Au total, 1200 patientes sont attendues dans cet essai. L’objectif principal est de comparer l’effet sur la récidive locale d’une dose de 26 Gy au lit tumoral à une dose de 16 Gy en boost, chez des patientes âgées de 51 ans ou moins, traitées pour un cancer du sein (adénocarcinome invasif unifocal stades pT1-2, pN0-2a, M0) par une chirurgie conservatrice et une radiothérapie classique de 50 Gy. Les objectifs secondaires sont l’évaluation des résultats esthétiques et des séquelles sur 10 ans. Des études annexes de recherche de facteurs pronostiques des cancers du sein sont faites avec détermination des profils biologiques de ces cancers. Des prélèvements tumoraux sont prévus avec ensuite une analyse par puces à ADN des profils transcriptomiques et génomiques. 68 RappoRt d'activité 2008 Bureau d’Études Cliniques et Thérapeutiques RappoRt d'activité 2008 69 Bureau d’Études Cliniques et Thérapeutiques Groupe tumeurs SEIN Groupe tumeurs SEIN Coordonnateur du Groupe Dr Thierry DELOZIER, Oncologue, Centre François Baclesse, Caen. Coordonnateur du Groupe Dr Thierry DELOZIER, Oncologue, Centre François Baclesse, Caen. Recrutement année 2008 par type de structure Part du groupe dans les essais internationaux pour l’année 2008 ESSAIS ADJUVANTS PROMUS PAR LE BECT ESSAI IBIS II CLCC CH/CHU PRIVÉ APHP ÉTRANGER Gro upe S E tumeurs 65 % 4% 15 % 0% 16 % Total Groupe tumeurs Sein Année 2008 18 % Total autres groupes Année 2008 82 % AUTRES ESSAIS PROMUS PAR LE BECT s eur tum pe u o Gr I N I N S E CLCC 94 % CH/CHU 5% PRIVÉ 1% APHP 0% ÉTRANGER 0% ESSAI PACS 07/0605 - MINDACT ESSAIS INTERNATIONAUX 70 RappoRt d'activité 2008 Bureau d’Études Cliniques et Thérapeutiques CLCC 80,1 % CH/CHU 10,2 % PRIVÉ 9,3 % APHP 0,4 % Total Groupe tumeurs Sein Année 2008 35 % Total autres groupes Année 2008 65 % RappoRt d'activité 2008 71 Bureau d’Études Cliniques et Thérapeutiques Groupe tumeurs SEIN Groupe tumeurs SEIN Coordonnateur du Groupe Dr Thierry DELOZIER, Oncologue, Centre François Baclesse, Caen. Coordonnateur du Groupe Dr Thierry DELOZIER, Oncologue, Centre François Baclesse, Caen. Inclusions 2008 par type d’établissement Inclusions 2008 par type d’établissement CLCC Nom établissement Gro upe S E tumeurs I N Hôpitaux Publics TOTAL Inclusions 2008 Nom établissement TOTAL Inclusions 2008 Centre Alexis Vautrin 13 CH Belfort Montbéliard - Hôpital André Boulloche Centre Antoine Lacassagne 22 CH Boulogne sur Mer 0 Centre Eugène Marquis 27 CH Bretagne Sud - Lorient 4 Centre François Baclesse 43 CH d'Angouleme 0 Centre Georges-François Leclerc 43 CH de Beauvais 0 Centre Henri Becquerel 7 CH de Dax 1 Centre Jean Perrin 18 CH de la Région d'Annecy 0 Centre Léon Bérard 11 CH de Lagny Marne la Vallée 0 Centre Oscar Lambret 0 CH de Niort 0 Centre Paul Papin 20 CH du Hasenrain - Mulhouse 1 Centre Paul Strauss 4 CH du Moenchsberg - EMILE MULLER (Mulhouse) 0 Centre René Gauducheau 23 CH Dubos - Pontoise 7 Centre René Huguenin 27 CH Fleyriat - Bourg en Bresse 1 Centre Val d'Aurelle - Paul Lamarque 0 CH Hôpital Réné Budos - Pontoise 0 Institut Bergonié 22 CH la Rochelle 0 Institut Claudius Regaud 27 CH Mont de Marsan 2 Institut Curie 79 CH Versailles - Hôpital André MIGNOT (Le Chesnay) 1 Institut Gustave Roussy 113 CHG Brive-La-Gaillarde 1 Institut Jean Godinot 23 CHI de Créteil 0 Institut Paoli-Calmettes 15 CHI Le Raincy-Montfermeil 0 CHR Metz Thionville - Hôpital Bon Secours 3 537 CHRU Brest 0 CHRU Tours 0 Total 2 CHU Angers 0 CHU Hôpital Nord - Saint Etienne 0 CHU Limoges 1 CHU Montpellier 6 CHU Nantes 0 CHU Nice 0 CHU Poitiers 0 Hôpitaux du Leman Thonon 1 Hôpitaux Universitaires de Strasbourg 0 Total 34 ASSISTANCE PUBLIQUE Nom établissement TOTAL Inclusions 2008 AP-HP Hôpital Hôtel Dieu 0 AP-HP Hôpital Saint Louis 1 AP-HP Hôpital Tenon 0 Total 72 RappoRt d'activité 2008 Bureau d’Études Cliniques et Thérapeutiques 1 RappoRt d'activité 2008 73 Bureau d’Études Cliniques et Thérapeutiques s eur tum pe u o Gr I N S E Groupe tumeurs SEIN Groupe tumeurs SEIN Coordonnateur du Groupe Dr Thierry DELOZIER, Oncologue, Centre François Baclesse, Caen. Coordonnateur du Groupe Dr Thierry DELOZIER, Oncologue, Centre François Baclesse, Caen. Inclusions 2008 par type d’établissement Inclusions 2008 par type d’établissement etRANGER etABLISSEMENTS PRIVES Nom établissement Gro upe S E tumeurs I N TOTAL Inclusions 2008 Nom établissement TOTAL Inclusions 2008 Centre Catherine de Sienne - Nantes 0 Belgique - AZ Klina Oncology 5 Centre de Radiothérapie et d'Oncologie Saint Faron - Mareuil Les Meaux 0 Belgique - CH Jolimont Lobbes 1 Belgique - CHA Libramont 2 Centre d'Oncologie Saint Yves - Vannes 1 Belgique - CHC ST JOSEPH 1 Centre Grenoble 1 Belgique - CHR de la Citadelle 1 Centre Mutualiste de Saint Nazaire 1 Belgique - Clinique Notre Dame de Grace 1 Centre Radiothérapie Oncologie Moyenne Garonne (CROMG) 1 Belgique - Clinique Sainte Elisabeth 1 Belgique - Imelda Ziekenhuis 2 Clinique Armoricaine de Radiologie - Saint Brieuc 3 Belgique - ND Reine Fabiola 2 Belgique - Peltzer La tourelle 1 Clinique Calabet 3 Belgique - RHMS Tournai 2 Clinique Claude Bernard - Ermont 0 Belgique - UCL Saint Luc 7 Clinique Claude Bernard - Metz 3 Belgique - UZ GENT 1 Clinique de l'Union - Saint Jean 0 Belgique - UZ Leuven 10 Clinique des Cèdres - Cornebarrieu 0 Clinique d'Occitanie - Muret 0 Clinique du Pont de Chaumes - Mautauban 0 Clinique Hartmann - Neuilly-sur-Seine 1 Clinique Pasteur - Toulouse 1 Clinique Saint Jean Languedoc - Toulouse 4 Clinique Tivoli - Bordeaux 10 CMC Les Ormeaux Vauban Le Havre 2 Groupe Hospitalier Paris St-Joseph 1 Institut de Cancérologie de la Loire - St Priest en Jarrez 4 Institut Privé de Cancérologie de Grenoble 0 Institut Sainte Catherine - Avignon 9 PolyClinique Bordeaux Nord Aquitaine 1 Polyclinique Courlancy - Reims 3 Polyclinique de l'Ormeau 0 Polyclinique des 4 pavillons - Bordeaux Rive Droite 2 Polyclinique du Parc - Toulouse 1 Polyclinique Francheville - Perigueux 1 Total 74 RappoRt d'activité 2008 Bureau d’Études Cliniques et Thérapeutiques Total 37 53 RappoRt d'activité 2008 75 Bureau d’Études Cliniques et Thérapeutiques s eur tum pe u o Gr I N S E GEP Coordonnateur du Groupe Dr Véronique Diéras, Institut Curie, Paris. GEP L e Groupe des Essais Précoces est né sous l’impulsion du Bureau d’Etudes Cliniques et Thérapeutiques et sous la coordination de Pierre Fumoleau, puis, plus récemment de Véronique Diéras et de Mario Campone. Il rend compte de la volonté fédérale de participer activement au tournant déjà amorcé que représente l’arrivée des thérapeutiques ciblées dans le paysage de la cancérologie. L’activité de ce groupe se concentre essentiellement sur l’évaluation de nouveaux médicaments innovants dans des essais précoces et dans des situations non explorées par les laboratoires pharmaceutiques en y associant un volet explicatif apporté par la recherche de transfert. La réussite de ce Groupe passe par la construction d’un partenariat de confiance et de proximité avec l’industrie, qui sera à la fois fournisseur de molécules en développement et fournisseur de soutien financier, et par la garantie d’un pacte d’indépendance et de réactivité du GEP qui doit rester maître de ses orientations. Coordonnateur du Groupe Dr Véronique Diéras, Institut Curie, Paris CONTACTS au 1er JUIN 2009 GEP Chef de Projets Assistante de Projets tél. 01 44 23 55 58 [email protected] tél. 01 44 23 04 15 [email protected] Marta JIMENEZ 76 RappoRt d'activité 2008 Bureau d’Études Cliniques et Thérapeutiques Patricia NEZAN ARC Coordonnateur Céline MAHIER-AIT OUKHATAR tél. 01 44 23 55 84 [email protected] ARC Etudes gep Bochra HACHANI tél. 01 44 23 04 14 [email protected] Groupe des Essais Précoces Le positionnement du GEP, dont l’activité se veut transversale, vis-à-vis des groupes d’organes de la Fédération est également une clé majeure de sa réussite. Le GEP se positionne avant tout comme un facilitateur dans la captation précoce de nouvelles molécules avec pour objectif final de transmettre la molécule pour des évaluations de phase II tardives ou de phase III dans les groupes d’organes de la Fédération. Il est néanmoins important de préciser que les développements précoces ne pourront se faire qu’en collaboration étroite avec les Groupes tumeurs dans le cadre de partenariats « gagnants-gagnants ». L’accès à la recherche précoce est un moyen de donner à la Fédération et à ses groupes d’organes une spécificité et une compétitivité qui peuvent contribuer à conserver une attractivité française face aux autres pays, notamment les Etats-Unis. C’est aussi pour les CLCC et les patients l’opportunité de l’accès à l’innovation thérapeutique. Etudes en cours en 2008 LAPNAV GEP 01 Investigateur coordonnateur : Pr Pierre Fumoleau, Centre Georges-François Leclerc, Dijon. • Phase I Study evaluating the combination of lapatinib + vinorelbine in patients with locally advanced or metastatic breast cancer overexpressing HER2. De nombreuses publications ont montré l’efficacité de la vinorelbine dans le cancer du sein. L’association de la vinorelbine au trastuzumab a également démontré son efficacité dans les tumeurs surexprimant Her 2 après échec du trastuzumab seul ou associé à un taxane. La vinorelbine dans sa forme IV est actuellement sur le marché en France et dans plus de 80 pays dans le monde avec les indications dans le Cancer bronchique non à petites cellules et le cancer du sein métastatique. La forme orale de la vinorelbine est apparue plus récemment en France en 2001 dans le traitement du cancer des bronches, puis étendue au traitement du cancer du sein en 2005. De nombreuses études de phases I et II ont démontré une équivalence d’efficacité et de tolérance entre les deux formes galéniques de la vinorelbine. L’association vinorelbine + trastuzumab est communément utilisée en France pour le traitement du cancer du sein en situation métastatique, parfois même en première ligne dans des situations où les taxanes et les anthracyclines ne peuvent être réintroduits. Cependant, des alternatives au trastuzumab sont indispensables dans les cas d’intolérance ou d’échappement à ce médicament. RappoRt d'activité 2008 77 Bureau d’Études Cliniques et Thérapeutiques P GE GEP GEP Groupe des Essais Précoces Coordonnateur du Groupe Dr Véronique Diéras, Institut Curie, Paris. Le lapatinib est une petite molécule qui inhibe les récepteurs ErbB1 et ErbB2 et qui montre des données prometteuses dans le cancer du sein de stade avancé, en monothérapie (ASCO 2005) et associé au trastuzumab. Depuis 2008, elle est commercialisée sous le nom de Tyverb® dans le traitement du cancer du sein HER2 positif, avancé ou métastatique, en progression après un traitement ayant comporté une anthracycline, un taxane et un traitement incluant trastuzumab, et ceci uniquement en association avec la capécitabine. L’objectif est de mener une étude d’escalade de dose pour déterminer la dose maximale tolérée (MTD) de vinorelbine IV, puis orale, associée à une dose biologiquement active de lapatinib. Les résultats de faisabilité et de tolérance de cette phase I pourraient permettre ensuite de conduire une étude de phase II/III de comparaison de l’association vinorelbine + trastuzumab versus vinorelbine + lapatinib chez les patientes réfractaires au trastuzumab en situation métastatique. Depuis son démarrage en 2007, 4 paliers ont été franchis sans aucune DLT observée sur les 3 premiers paliers ; puis 2 DLT ont été observées sur le 4ème palier qui associait 25 mg/m2 de vinorelbine à 1000 mg/jour de lapatinib. Le recrutement de 6 patientes au palier inférieur a donc permis de confirmer la Dose Maximale Tolérée de cette association à 22,5 mg/m2 de vinorelbine et 1000 mg de lapatinib. Néanmoins, l’origine hématologique des 2 DLT laisserait penser que la vinorelbine seule pourrait être limitante et qu’une dose supérieure de lapatinib pourrait être explorée. C’est pourquoi, afin d’affiner le schéma thérapeutique, un nouveau palier intermédiaire a été proposé (22,5 mg/m2 de vinorelbine et 1250 mg de lapatinib). Il est ouvert au recrutement début 2009. GE P Les études pharmacocinétiques qui sont en cours permettront de mieux appréhender les interactions des 2 molécules en fonction de leur dose. Les résultats préliminaires de cette étude vont être présentés à la conférence de l’ASCO 2009. 78 RappoRt d'activité 2008 Bureau d’Études Cliniques et Thérapeutiques Coordonnateur du Groupe Dr Véronique Diéras, Institut Curie, Paris. Groupe des Essais Précoces SUPAP GETUG – GEP 03 Investigateur coordonnateur : Pr Alain RAVAUD, Hôpital Saint-André CHU, Bordeaux. • Phase II of sunitinib in first line for patients with locally advanced or metastatic papillary renal cell carcinoma. Le cancer du rein de forme papillaire (PRCC) représente 10 à 15 % des cancers du rein. Le PRCC peut être séparé grâce à l’histologie en 2 entités d’évolutions différentes. Le type 1 contient de petites cellules avec un cytoplasme basophile, alors que le type 2 comporte des cellules volumineuses contenant un cytoplasme éosinophile. La survie des formes métastatiques de PRCC de types 1 et 2 serait moins favorable que celle des cancers du rein à cellules claires. Il n’y a pas de traitement de référence reconnu pour le PRCC localement avancé ou en phase métastatique. Si l’immunothérapie est toujours considérée comme le traitement de référence de première ligne, elle est significativement moins efficace dans le PRCC. Il existe de ce fait une nécessité d’évaluer de nouveaux médicaments dans le PRCC. L’angiogenèse est apparue comme une étape prépondérante dans le développement et la progression du cancer du rein, permettant l’approbation actuelle ou à venir de médicaments anti-angiogéniques (bevacizumab, sorafenib, sunitinib) du fait d’un taux de réponse important (sunitinib) ou d’un gain de maladie stabilisée (bevacizumab, sorafenib, sunitinib) et de prolongation de survie sans progression (sorafenib). Au cours des phases I et II du sunitinib dans le RCC, des réponses partielles ont été rapportées pour le PRCC. L’objectif principal de cette étude est donc de déterminer le taux de réponses objectives chez les patients présentant un cancer du rein papillaire de type 1 ou 2, localement avancé ou métastatique et traité par sunitinib. Depuis sa mise en place dans 23 centres du groupe GETUG, 28 patients ont été recrutés au total fin 2008, avec 23 types 2 et 5 types 1. Avec 23 patients, l’effectif pour l’analyse intermédiaire des types 2 a été atteint. Cependant, l’absence des 2 réponses au traitement, nécessaires pour la poursuite du recrutement, a conduit à l’interruption momentanée des inclusions en novembre 2008, dans l’attente de l’évaluation de tous les patients. L’interruption d’un essai n’est cependant jamais une très bonne mesure pour le maintien de la dynamique de recrutement. A cela s’ajoute que dans la situation de ces patients et pendant la durée de l’interruption, ils peuvent se voir proposer la même thérapeutique dans le cadre de l’AMM. C’est donc par le biais d’un IDMC qui doit être organisé en 2009, qu’une décision devra être prise sur la reprise anticipée du recrutement. Les résultats préliminaires de cette étude ont été retenus pour une présentation à la conférence de l’ASCO en 2009. RappoRt d'activité 2008 79 Bureau d’Études Cliniques et Thérapeutiques P GE GEP GEP Groupe des Essais Précoces Coordonnateur du Groupe Dr Véronique Diéras, Institut Curie, Paris. Investigateur coordonnateur : Dr Mario Campone, Centre René Gauducheau, Nantes. • A phase II, randomized, multi-center study, assessing value of adding RAD001 to Trastuzumab as preoperative therapy of HER-2 positive primary breast cancer amenable to surgery. Le but de ce projet est d’étudier les corrélations biologico-cliniques et d’identifier les marqueurs de diagnostic moléculaire permettant de prédire la réponse thérapeutique à l’association d’un inhibiteur de mTOR, l’everolimus ou RAD001, avec le trastuzumab. Ce projet est proposé sous la forme d’une recherche biologique intégrée à une étude clinique multicentrique nationale, prospective, randomisée, de phase II dont l’effectif prévu est de 120 patientes (60 patientes par bras) présentant toutes une tumeur du sein surexprimant HER2 et candidates à une chirurgie conservatrice d’emblée. L’étude présente la particularité d’être proposée en situation pré-opératoire. Ce type d’approche a récemment été validé (Downsett et al, JNCI, 2007) pour prédire la sensibilité à l’hormonothérapie par tamoxifène et anti-aromatases. Ce concept est transposé dans l’étude RADHER afin de déterminer les paramètres cliniques et biologiques permettant de prédire la réponse au trastuzumab seul ou associé à l’everolimus. Les résultats encourageants du RAD001 dans le sein métastatique réfractaire au trastuzumab associé à des cytotoxiques avec le trastuzumab ont été présentés à l’ASCO en 2008 dans 2 essais de phase I (Jerusalem et al., André et al.), incitant d’autant plus à l’exploration des mécanismes biologiques qui sous-tendent le rétablissement de la sensibilité au trastuzumab. R A N D O M I Z A T I O N Neuf équipes de recherche sont impliquées dans ce projet, sept d’entre elles se trouvant dans des CLCC. C’est à ce titre que l’essai RADHER reflète parfaitement les orientations du Groupe des Essais Précoces en permettant de valoriser les nombreux plateaux techniques présents dans les centres. En 2008, 5 centres ont été ouverts ARM A : Trastuzumab (H) 4 mg/kg day 1,2 mg/kg thereafter et ont permis le recrutement de 4 patientes. Quatre autres centres ont manifesté leur S intérêt pour cette étude et U Week 1 Week 2 Week 3 Week 4 Week 5 Week 6 R seront ouverts en 2009. Il n’en G reste pas moins qu’il s’agit E d’une étude difficile à mener R et à proposer aux patientes du Y fait des biopsies intératives. Un R QD important effort de recrutement ARM B : T rastuzumab (H) 4 mg/kg day 1, 2 mg/kg thereafter reste à faire pour atteindre + RAD001 (R) 10 mg/day Daily Continuous (QD) l’objectif des 120 patientes. H H H H H H H H H H H H Patients receive their last RAD001 treatment within 24 hours prior to surgery 80 RappoRt d'activité 2008 Bureau d’Études Cliniques et Thérapeutiques Groupe des Essais Précoces Inclusions 2008 par type d’établissement RADHER GEP 04 GE P Coordonnateur du Groupe Dr Véronique Diéras, Institut Curie, Paris. CLCC Nom établissement TOTAL Inclusions 2008 Centre Alexis Vautrin 0 Centre Antoine Lacassagne 1 Centre Eugène Marquis 1 Centre François Baclesse 2 Centre Georges-François Leclerc 3 Centre Léon Bérard 1 Centre Oscar Lambret 2 Centre Paul Papin 0 Centre René Gauducheau 4 Centre René Huguenin 3 Centre Val d'Aurelle - Paul Lamarque 0 Institut Claudius Regaud 4 Institut Curie 3 Institut Gustave Roussy 7 Institut Jean Godinot 0 Institut Paoli-Calmettes 2 Total 33 Hôpitaux Publics Nom établissement TOTAL Inclusions 2008 CH de Grenoble 1 CHD Les Oudaries - La Roche sur Yon 0 CHR Metz Thionville - Hôpital Bon Secours 0 CHRU Brest 0 CHRU Tours 0 CHU Besançon 0 CHU Hôpitaux de Bordeaux 1 Hôpital Foch - Suresnes 2 Total 4 ASSISTANCE PUBLIQUE Nom établissement TOTAL Inclusions 2008 AP-HM Hôpital la Timone 0 AP-HP Hôpital Européen Georges Pompidou 5 AP-HP Hôpital Saint Michel 0 Total 5 RappoRt d'activité 2008 81 Bureau d’Études Cliniques et Thérapeutiques P GE Pharmacovigilance Pharmacovigilance Etudes Cliniques : Recueil et Déclaration des évènements indésirables graves En 2008, la pharmacovigilance du BECT a recueilli 1720 notifications d’événements indésirables graves (EIG) contre 1150 notifications en 2007 et 1348 notifications en 2006 ; ce qui montre le volume important et croissant de l’activité de l’unité. Outre cette évolution croissante d’enregistrement et de traitement des EIG, la charge de travail a été augmentée du fait de la nécessité de se conformer aux nouvelles exigences réglementaires (rédaction de rapports de sécurité et déclaration des EIG inattendus dans les délais impartis) mais également par le caractère international des études et par l’exigence accrue des partenaires industriels quant à la qualité et la précision des informations demandées. L a cellule de Pharmacovigilance du BECT est chargée de : - centraliser les Evénements Indésirables Graves (EIG) notifiés par les investigateurs et les déclarer à l'AFSSAPS, - transmettre chaque mois une mise à jour de ces EIG aux chefs de projets des Groupes tumeurs en charge de l’étude ainsi qu'aux laboratoires pharmaceutiques, - déclarer à l’EMEA, les EIG inattendus dans les délais impartis et en informer les investigateurs, - gérer une base de données de l'ensemble des EIG survenus dans les études dont le BECT est promoteur. Ces éléments ont conduit à la réorganisation complète de l’unité de pharmacovigilance courant 2008, en renforçant le personnel dédié à cette tâche afin de prendre en charge, à la fois, l’augmentation du volume de travail et la mise en conformité à la nouvelle réglementation. Deux nouvelles personnes ont ainsi été recrutées en tant que chargées de pharmacovigilance, dans le but d’assumer cette charge de travail supplémentaire. Des tableaux de synthèse des EIG déclarés par étude sont maintenant fournis aux équipes projets sur une base mensuelle, depuis octobre 2008. Des informations ou des analyses complémentaires, nécessaires à la rédaction d’abstracts ou de publications (réconciliation des EIG du BECT avec la base de données de l’essai), peuvent être également réalisées à la demande des chefs de projets. Effet Indésirable Grave Inattendu : définition et modalités de déclaration Définition Un Effet Indésirable Grave Inattendu (EIG-I), appelé en anglais SUSAR (pour Suspected Unexpected Serious Adverse Reaction), correspond à un événement : - Lié à l’administration ou à la prise d’un produit expérimental (il ne peut donc s’agir, entre autre, d’événements en relation avec la progression de la maladie ou avec des traitements non médicamenteux). 82 RappoRt d'activité 2008 Bureau d’Études Cliniques et Thérapeutiques RappoRt d'activité 2008 83 Bureau d’Études Cliniques et Thérapeutiques corma Pha ance il Vig Pharmacovigilance - Répondant à l’un des critères habituels de gravité : décès, menace vitale, hospitalisation ou prolongation d’hospitalisation, provoquant une incapacité, un handicap important ou durable, une anomalie, une malformation congénitale ou un autre cancer. Et s’agissant d’un médicament expérimental, quelle que soit la dose administrée. - Ne figurant pas comme effet indésirable connu dans les documents les plus récents décrivant les caractéristiques du produit : brochure investigateur, mise à jour pour les médicaments en cours de développement, EPAR consultable sur le site de l’EMEA (http://www.emea.europa.eu) ou libellé du Vidal pour les médicaments commercialisés. ATTENTION : Inattendu ne signifie pas que l’on ne s’y attendait pas (on s’attend rarement à un EIG) mais qu’il n’est pas connu comme évènement lié à la prise d’un médicament en évaluation. Modalités de déclaration Dès réception d’un Effet Indésirable Grave Inattendu, le promoteur doit en faire la déclaration initiale auprès de l’EMEA via le site EudraVigilance (http://eudravigilance.emea.europa.eu), envoyer un double de cette déclaration (le formulaire CIOMS, format légal européen) à l’AFSSAPS et au CPP. L’ensemble des médecins investigateurs impliqués dans les essais évaluant cette molécule (sous la responsabilité du même promoteur) est informé de l’EIG-I. Si nécessaire, un suivi de chaque EIG-I est assuré par l’unité de pharmacovigilance du promoteur afin d’obtenir des informations complémentaires et/ou de suivre l’évolution de l’effet indésirable. Ces informations ont le même circuit de déclaration que la déclaration initiale : EMEA, AFSSAPS, CPP et information aux investigateurs. En 2008, l’unité de pharmacovigilance du BECT a déclaré 6 Effets Indésirables Graves Inattendus. Pha rma Vig coilan ce 84 RappoRt d'activité 2008 Bureau d’Études Cliniques et Thérapeutiques corma Pha ance il Vig RappoRt d'activité 2008 85 Bureau d’Études Cliniques et Thérapeutiques Publications PublicationS 2008 Publications META-ANALYSE MD ANDERSON BREAST CANCER Estrogen receptor expression and efficacy of PACS 01 docetaxel-containing adjuvant chemotherapy in A 38-gene expression signature to predict metastasis patients with node-positive breast cancer: results risk in node-negative breast cancer after systemic from a pooled analysis. adjuvant chemotherapy: a genomic substudy of Andre F, Broglio K, Roche H, Martin M, Mackey JR, PACS01 clinical trial. Penault-llorca F, Hortobagyi GN, Pusztai L. Jézéquel P, Campone M, Roché H, Gouraud W, J Clin Oncol. 2008 Jun 1;26(16):2636-43. Charbonnel C, Ricolleau G, Magrangeas F, Minvielle S, Genève J, Martin AL, Bataille R, Campion L. SARCOME 06 Breast Cancer Res Treat. Published on line: 20 November 2008. Phase II Trial of Weekly Paclitaxel for Uniresectable Angiosarcoma: The ANGIOTAX Study. PEGASE 01 N. Penel, B. Nguyen Bui, J-O. Bay, D. Cupissol, I. RayThe PEGASE Group. Deterioration of quality of life of Coquard, S. Piperno-Neumann, P. Kerbrat, C. Fournier, high-risk breast cancer patients treated with high- S. Taieb, M. Jimenez, N. Isambert, F. Peyrade, dose chemotherapy: the PEGASE 01 quality of life C. Chevreau, E. Bompas, E. G.C Brain, and J-Y Blay. study. J Clin Oncol 2008: N°25 : 5269-5274. Marino P, Roché H, Biron P, Janvier M, Spaëth D, Fabbro M, Linassier C, Delozier T, Martin AL, Santin G, Moatti JP. Value Health. vol. 11, Issue 4, 2008, p.709-718. PEGASE 01 Pub lica tion s The PEGASE Group. High-dose chemotherapy for patients with high-risk breast cancer: a clinical and economic assessment using a quality-adjusted survival analysis. Marino P, Roché H, Moatti JP. Am J Clin Oncol. 2008 Apr; 31(2):117-24. PEGASE 03 III. SIOG 2008 : Montréal (CANADA) 16-18 octobre 2008 GERICO 04 poster GERICO 06 46ème Colloque de Médecine Nucléaire de Langue Française (Tunisie) 26 avril-03 mai 2008 II. Bureau d’Études Cliniques et Thérapeutiques Impact on Autonomy as Main Endpoint of Anthracyclines-Based Adjuvant Chemotherapy (CT) in Women Over 70 Year-Old (yo) with Endocrine Non Responsive Breast Carcinoma (BC): a French Geriatric Oncology Group (GERICO) Phase II Multicentre Program. E. G. Brain, C. Mertens, F. Rousseau, V. Girre, E. Blot, S. Abadie, E. Fourme, S. Luneau, F. Gouttenoire, M. Debled. Annals of Oncology 19, Supplement 8, 2008, Page viii208viii210, Abstract n°653 P. poster I. Pacs 01 pegase 01 86 RappoRt d'activité 2008 A FNCLCC French SARCOMA Group : GETO multicenter randomized phase II study of Gemcitabine (G) versus Gemcitabine and Docetaxel (G+D) in patients with metastatic or relapsed leimyosarcoma (LMS). F. Duffaud, B. Bui, N. Penel, A. Cioffi, N. Isambert, J.Y. Blay, D. Cupissol, M. Jimenez, A. Rey, P. Pautier ; Abstract n° 10511 http://www.asco.org/ASCOv2/Meetings/Abstracts COMMUNICATIONS ORALES ET POSTERS Etude FLT 01/0505 Prediction of metastatic relapse in node-positive breast cancer: establishment of a clinicogenomic model after FEC100 adjuvant regimen. Campone M, Campion L, Roché H, Gouraud W, Charbonnel C, Magrangeas F, Minvielle S, Genève J, Martin AL, Bataille R, Jézéquel P. Breast Cancer Res Treat. 2008 Jun ; 109(3): 491-501. Epub 2007 Jul 21. GERICO 06 communication orale Biweekly Docetaxel as first – line chemiotherapy (CT) regimen in elderly metastatic breast cancer (MBC) patients with impact on autonomy as main endpoint: a FNCLCC Gerico Group Phase II multicentre trial. V. Girre, F. Rousseau, E. Blot, S. Gourgou-Bourgade, F. Gouttenoire, J. Geneve, S. Delaloge Critical Reviews in Oncology/Hematology, Vol. 68, Supplement 2, October 2008, page S 45. A prospective randomized phase III trial of FEC with or without high-dose thiotepa, cyclophosphamide and autologous stem cell transplantation in first-line treatment of metastatic breast cancer. Biron P, Durand M, Roché H, Delozier T, Battista C, Fargeot P, Spaëth D, Bachelot T, Poiget E, Monnot F, Tanguy ML, Curé H. Bone Marrow Transplant 2008 Mar; 41(6):555-62. Epub 2007 Nov 26. publication commune SARCOME 07 poster Excrétion biliaire de conjugués glucoronides de la 3’-Desoxy-3’-[18F]Fluoro-Thymidine (FLT) avant leur élimination urinaire. COUTURIER O. Médecine nucléaire, Vol. 32, Issue 4, April 2008, pages 193-264. ASCO 2008 : Chicago (USA) 1-5 Juin 2008 ACCORD 12/0405 PRODIGE 2 poster Randomized multicenter phase III trial comparing neodjuvant RT45-Cap and RT50-Capox In patients with locally advanced rectal cancer. Preliminary safety results of the ACCORD 12/0405 – PRODIGE 2. J.P. Gérard, D. Azria, S. Gourgou-Bourgade, L. MartelLafay, C. Hennequin, P. Etienne, G. De Laroche, L. Mineur, V. Vendrely, C. Montoto-Grillot. Abstract n°4089. http://www.asco.org/ASCOv2/Meetings/Abstracts communication orale V. ESTRO 2008 : Göteborg (Suède) 14-17 sept 2008 ACCORD 03 communication orale Induction chemotherapy (ICT) and dose intensification of the radiation boost in locally advanced anal canal carcinoma (LAACC) : definitive analysis of the intergroup ACCORD 03 trial (Fédération National des Centres de Lutte Contre le Cancer – Fondation Française de cancérologie Digestive). D. Peiffert, J.P. Gérard, M. Ducreux, C. Lemanski, E. François, M. Giovannini, F. Cvitkovic, X. Mirabel, O. Bouché, E. Luporsi. Radiotherapy & Oncology, Vol. 88, Supplement 2, September 2008, page S 20, Abstract n° 65. Doxorubin-based adjuvant chemotherapy for elderly patients with hormone receptors negative breast carcinoma: a French geriatric oncology group (GERICO) phase II multicentric program. ACCORD 12/0405 PRODIGE 2 M. Debled, V. Girre, C. Mertens, E. Blot, F. Rousseau, S. Abadie, L. Uwer, E. Bourbouloux, E. Fourme, communication orale F. Gouttenoire, E. G. Brain Preoperative chemoradiation for locally advanced Critical Reviews in Oncology/Hematology, Vol. 68, rectal cancer. Preliminary safety results of the ACCORD 12/0405 PRODIGE-2 randomized trial. Supplement 2, October 2008, page S 24-S 25. J.P. Gérard, D. Azria, S. Gourgou-Bourgade, I. MartelLaffay, C. Hennequin, P. L. Etienne, E. François, V. Vendrely, G. De Laroche, C. Montoto-Grillot. Radiotherapy & Oncology, Vol. 88, Supplement 2, ESMO 2008 : Stockholm (Suède) September 2008, page S 86, Abstract n° 270. IV. 12-16 sept 2008 GERICO 04 poster Biweekly Docetaxel as first – line chemotherapy (CT) regimen in elderly metastatic breast cancer (MBC) patients with impact on autonomy as main endpoint: a FNCLCC Gerico Group Phase II multicentre trial. V. Girre, F. Rousseau, E. Blot, S. Gourgou-Bourgade, F. Gouttenoire, J. Geneve, S. Delaloge. Annals of Oncology 19, Supplement 8, 2008, page viii208viii210, Abstract n° 654 P. RappoRt d'activité 2008 87 Bureau d’Études Cliniques et Thérapeutiques s tion lica Pub Collaborations Collaborations collaborations nationales Bilan fin 2008 12 essais Progige dont 5 promus par le Bect de la fnclcc partenariat prodige N° PRODIGE Le groupe des tumeurs digestives de la FNCLCC collabore depuis des années avec des groupes académiques tels que la FFCD, le GERCOR, la SFRO, l’EORTC etc… En juin 2006, la FFCD et le groupe des tumeurs digestives de la FNCLCC se sont rapprochés pour créer le partenariat PRODIGE. Statut FFCD En cours d’inclusion PRODIGE 2 ACCORD 12/0405 FNCLCC fermé PRODIGE 3 Œso néoadj. Marseille En cours d’inclusion PRODIGE 4 ACCORD 11/0402 FNCLCC En cours d’inclusion PRODIGE 5 ACCORD 17/0707 FNCLCC En cours d’inclusion PRODIGE 6 Œso M+ FFCD En négociation PRODIGE 7 ACCORD 15/0608 FNCLCC Démarrage PRODIGE 8 LAP07 GERCOR Ouverture en cours - d’élaborer et conduire de grandes études nationales et internationales permettant de répondre rapidement à des questions stratégiques de cancérologie digestive. - d e rendre plus visibles les actions entreprises par les deux groupes vis-à-vis des interlocuteurs institutionnels et industriels. - d e conduire des essais stratégiques de phase III nationaux et internationaux, et certains essais de phase II randomisés. - d’impliquer en amont de la conception des essais tous les spécialistes intéressés dans des groupes de travail. PRODIGE 9 Côlon SUMAV FFCD Protocole finalisé PRODIGE 10 Carcinome hépatocellulaire Phase II GONEXT CLCC Montpellier Ouverture en cours PRODIGE 11 Carcinome hépatocellulaire Pravastatine versus placebo FFCD Protocole en écriture PRODIGE 12 ACCORD 18/0308 FNCLCC Protocole en écriture FFCD 11 sous groupes et 1 Conseil scientifique commun Phases II randomisées / Phases III Les principes qui président au fonctionnement du groupe PRODIGE sont : - Des règles de publication communes et obligatoires pour toutes les études Prodige. - Des règles de fonctionnement précisées grâce à une charte de partenariat. - Une dynamique de recrutement des études randomisées très forte permettant de clore les inclusions avant la date théorique. - Une forte créativité des 11 sous-groupes : foie, colorectal métastatique, côlon adjuvant, pancréas, rectum, œsophage, estomac, voies biliaires, canal anal, tumeurs endocrines, tumeurs digestives rares. - Deux conseils scientifiques communs par an, assurant la pérennité de ce partenariat. - Un poids et une visibilité croissante auprès de l’industrie comme interlocuteur unique dans le monde de l’oncologie digestive. - De fortes relations inter-personnelles qui permettent de faire avancer et améliorer ce partenariat. FNCLCC 2 Conseils Scentifiques par an Phases II Promoteur Côlon PETACC 8 les objectifs sont : l’organisation : Coll abo ratio ns Nom étude PRODIGE 1 2 copil par an Phases II CCP : Promotion FFCD ou FNCLCC Etude de phase II faites indépendamment par les deux groupes Concurrence possible car ciblent parfois les mêmes patients 88 RappoRt d'activité 2008 Bureau d’Études Cliniques et Thérapeutiques RappoRt d'activité 2008 89 Bureau d’Études Cliniques et Thérapeutiques ns ratio abo ll o C Collaborations Collaborations Collaborations internationales Deux nouveaux essais dans le PACS SEIN vont être lancés dans un milieu international : Le PACS 07 (MINDACT) Cet essai qui a bénéficié des fonds européen du 7ème PCRD (projet Transbig) et qui est coordonné par l’EORTC avec une promotion française déléguée au BECT. Le PACS 08 (TAVIX) Cet essai qui concerne une population à risque de cancers du sein va être lancée en France puis sa réalisation va s’étendre à d’autres pays tels la Belgique, le Canada (NCI) et les Etats-Unis (groupe NCCTG dirigé par Edith Perez). Un groupe espagnol serait également intéressé par cette étude. Cette étude débutée en France en février 2005 avait été également ouverte en Suisse et Italie et devait impliquer le Royaume-Uni. Suite à la survenue de deux décès toxiques consécutifs à deux pneumopathies (l’une infectieuse - pneumocystose - et l’autre interstitielle), un Comité de surveillance a statué sur la suspension des inclusions fin août 2006. Avec le recul et les données recueillies, l’essai avait été définitivement clos aux inclusions en 2007. 27 patientes avaient été incluses par 4 centres français (Institut Paoli Calmettes, Institut Curie, Centre H. Becquerel, Institut Gustave Roussy). - Un poster a été présenté lors du Congrès de l’ESMO - Stockholm 2008 ainsi que lors du Congrès International d’Oncogériatrie de la SIOGMontréal 2008. - Les résultats seront également présentés lors d’une session Poster au prochain congrès international de Gériatrie-Gérontologie IAGG-Paris 2009. L’étude PROTEGE 01 (Lung Art) Cet étude de radiothérapie dans le cancer du poumon non à petites cellules va concerner de nombreux pays : un groupe espagnol s’est joint à cette étude ainsi que l’EORTC. D’autres essais internationaux poursuivent leur recrutement tels EuroEwing et SARCOME 08 ; ce dernier est un essai intergroupe coordonné par l’EORTC Soft Tissue and Bone Sarcoma Group (EORTC STBSG) en collaboration avec plusieurs groupes sarcomes européens incluant les groupes Italien (ISG), Espagnol (GEIS) et Français (GSF-GETO) - avec le concours de la FFCD - et au total la participation de 12 pays dans le monde. Dans l’essai de chimioprévention IBIS 2, la FNCLCC collabore étroitement avec le Queen Mary Hospital et maintient son rôle prépondérant dans les inclusions de patientes depuis l’ouverture de l’essai (3ème groupe recruteur derrière l’Allemagne et l’Angleterre). Coll abo ratio ns ns ratio abo ll o C Dans l’essai GETUG 13 de stratégie adaptée au pronostic chez des patients atteints de tumeurs germinales non séminomateuses disséminées de mauvais pronostic, la participation du MDA Anderson et du NCI de Bratislava (Slovaquie) permet un recrutement satisfaisant dans cette pathologie orpheline. GERICO 04 Cet essai international de phase II se proposait d’évaluer l’impact sur l’autonomie des activités de la vie instrumentale et quotidienne (définie selon l'indice IADL et ADL) d’une chimiothérapie par docétaxel administrée toutes les 2 semaines dans le traitement du cancer du sein métastatique chez la femme âgée de plus de 70 ans. 90 RappoRt d'activité 2008 Bureau d’Études Cliniques et Thérapeutiques RappoRt d'activité 2008 91 Bureau d’Études Cliniques et Thérapeutiques CLCC Bilan de la recherche clinique au sein des CLCC en 2008 CLCC bilan d’activité de la recherche clinique pour l’année 2008 10 356 patients au total (en moyenne 518 patients par CLCC) ont été inclus dans un essai clinique (en moyenne 121 essais étaient ouverts par les CLCC). • tableau 1 : Description générale Nombre de CLCC évaluables : 20 L es indicateurs mis en œuvre par le BECT, témoin de l’évolution de la recherche clinique au sein des CLCC, traduisent une augmentation de plus de 12 % de cette activité pour l’année 2008 avec un taux global d’inclusion des malades dans les recherches biomédicales, pour les 20 CLCC, de 11,29 % (3.17 % à 15.77 %). Patients inclus Essais ouverts Patients par essais Total 10 356 2 411 4,3 Moyenne/CLCC +/- SD 518 +/- 317 121 +/- 44 4 +/- 1 436 (63 - 1462) 114 (44 - 239) 4 (1 - 8) Médiane/ CLCC (extrêmes) Ces patients représentent en moyenne 10,77 % (+/- 3.02 %) de la file active des patients hospitalisés pour un cancer dans les CLCC. • tableau 2 : Proportion de patients inclus dans un essai clinique par rapport au nombre de patients hospitalisés pour cancer Nombre de CLCC évaluables : 20 Total Moyenne/CLCC +/- SD Médiane/ CLCC (extrêmes) File active des patients hospitalisés pour cancer % inclus dans un essai 91 764 11,29 % 4 588 +/- 2 010 10,77 % +/- 3,02 % 4 293 (1 986 - 10 152) 10,23 % (3,17 % - 15,77 %) Le détail des patients inclus dans un essai clinique par les CLCC est présenté dans le tableau 5. 72,6 % des 10 356 patients ont été inclus dans des essais dont le promoteur est académique (voir tableau 4), représentant 7524 patients. • L’activité de recherche clinique au sein des CLCC est suivie au niveau du BECT à l’aide de trois types d’indicateurs. L’évolution de ceux-ci démontre la très bonne évolution de l’année 2008. 92 RappoRt d'activité 2008 Bureau d’Études Cliniques et Thérapeutiques RappoRt d'activité 2008 93 Bureau d’Études Cliniques et Thérapeutiques CC CL CLCC CLCC Bilan de la recherche clinique au sein des CLCC en 2008 Bilan de la recherche clinique au sein des CLCC en 2008 Indicateur n° 1 Le pourcentage de patients hospitalisés inclus dans un essai clinique 11,29 % des patients hospitalisés pour un cancer ont été inclus dans un essai clinique en 2008 versus 10.2 % en 2007 et 8.5 % en 2006. • tableau 3 : Suivi des indicateurs sur 3 ans Indicateur n° 2 Nombre total de patients inclus dans un essai clinique Le pourcentage de patients inclus dans un essai institutionnel 72,6 % des patients ont été inclus dans un essai institutionnel en 2008 versus 74 % en 2007 et 70 % en 2006. Année 2006 Indicateur n° 3 Nombre total de patients inclus dans un essai institutionnel Nombre total de patients inclus dans un essai industriel 7 862 5 671 2 191 Année 2007 9 218 6 639 2 579 Année 2008 10 356 7524 2832 Le pourcentage de patients inclus dans un essai industriel 27,4 % des patients ont été inclus dans un essai clinique industriel en 2008 versus 26 % en 2007 et 30 % en 2006. • tableau 4 : Typologie par promoteur d’essais thérapeutiques réalisés dans les CLCC Les réunions biannuelles des responsables d’unité de recherche clinique des CLCC : En 2008, les thèmes abordés lors des deux réunions de l’année (le 15 janvier 2008 et le 07 juillet 2008), rassemblant les vingt responsables des Unités de Recherche Clinique, ont été les suivants : • Un point concernant la réglementation des collections d’échantillons biologiques par Maître Thomas Roche. • Les nouvelles réglementations pour les recherches biomédicales – 1ère partie : portant sur les médicaments à usage humain – 2nde partie : portant sur les dispositifs médicaux et pour les recherches ne portant par sur des produits de santé par Mme Elisabeth Hulier (BECT/FNCLCC). • Les indicateurs MERRI de la recherche clinique par Mme Sandrine Boucher (FNCLCC) et par le Dr Catherine Grenier (FNCLCC). • Les conflits d’intérêts par le Pr François Eisinger (Institut Paoli-Calmettes) • Le logiciel SIGREC par M. Emmanuel Reyrat (FNCLCC) • Les actualités : Les inclusions des CLCC en 2007, Le Comité de Patients. CL CC Nombre CLCC évaluables (20) TOTAL Promoteur académique nbre patients inclus nbre essais ouverts Promoteur industriel % patients inclus dans un essai clinique institutionnel nbre patients inclus nbre essais ouverts 7 524 1 569 2 832 842 MOYENNE/CLCC +/- SD 376 +/- 205 78 +/- 25 73,5 % +/- 12 % 142 +/- 135 42 +/- 22 MEDIANE/CLCC (extrêmes) 306 76 75 % 102 36 CC CL 94 RappoRt d'activité 2008 Bureau d’Études Cliniques et Thérapeutiques RappoRt d'activité 2008 95 Bureau d’Études Cliniques et Thérapeutiques CLCC CLCC Bilan de la recherche clinique au sein des CLCC en 2008 Bilan de la recherche clinique au sein des CLCC en 2008 • patients inclus dans les essais cliniques en 2008 Centres de Lutte Contre le Cancer (CLCC) CL CC File active Total patients patients Total cancéreux inclus dans essais (source un essai PMSI) clinique ouverts % patients Promoteur Total hospitalisés académique patients/ et inclus essai dans un nbre nbre ouvert essai patients essais clinique inclus ouverts % patients inclus dans un essai clinique institutionnel Promoteur industriel nbre nbre patients essais inclus ouverts Centre Paul Papin 2 879 454 107 4,24 15,77 % 365 77 80,40 % 89 30 Institut Bergonié 4 872 759 160 4,74 15,58 % 639 101 84,19 % 120 59 Institut Gustave Roussy 10 152 1 462 239 6,12 14,40 % 826 132 56,50 % 636 107 Centre Léon Bérard 5 911 831 185 4,49 14,06 % 594 120 71,48 % 237 65 Institut Curie 8 117 1 056 131 8,06 13,01 % 744 75 70,45 % 312 56 Centre Antoine Lacassagne 3 225 417 117 3,56 12,93 % 312 87 74,82 % 105 30 Centre François Baclesse 5 680 733 134 5,47 12,90 % 606 91 82,67 % 127 43 Centre Eugène Marquis 2 703 314 71 4,42 11,62 % 251 52 79,94 % 63 19 Institut Jean Godinot 2 001 225 88 2,56 11,24 % 188 63 83,56 % 37 25 Centre G-François Leclerc 3 261 340 95 3,58 10,43 % 236 57 69,41 % 104 38 Centre Val d'Aurelle 5 586 561 130 4,32 10,04 % 444 91 79,14 % 117 39 Centre Oscar Lambret 6 298 609 147 4,14 9,67 % 459 87 75,37 % 150 60 Centre René Gauducheau 4 980 481 142 3,39 9,66 % 225 72 46,78 % 256 70 Institut Paoli Calmettes 5 497 505 169 2,99 9,19 % 405 115 80,20 % 100 54 Centre René Huguenin 3 132 287 100 2,87 9,16 % 197 75 68,64 % 90 25 Centre Alexis Vautrin 3 409 299 81 3,69 8,77 % 212 57 70,90 % 87 24 Centre Henri Becquerel 3 713 314 110 2,85 8,46 % 269 83 85,67 % 45 27 Centre Claudius Regaud 4 998 400 94 4,26 8,00 % 300 61 75,00 % 100 33 Centre Jean Perrin 3 364 246 67 3,67 7,31 % 224 47 91,06 % 22 20 Centre Paul Strauss 1 986 63 44 1,43 3,17 % 28 26 44,44 % 35 18 TOTAL 91 764 10 356 2 411 4,30 11,29 % 7 524 1 569 72,65 % 2 832 842 Moyenne/CLCC 4 588 518 121 4 10,77 % 376 78 73,53 % 142 42 +/-SD 2 010 317 44 1 3,02 % 205 25 11,91 % 135 22 Médiane 4 293 436 114 4 10,23 % 306 76 75,18 % 102 36 MIN 1 986 63 44 1 3,17 % 28 26 44,44 % 22 18 MAX 10 152 1 462 239 8 15,77 % 826 132 91,06 % 636 107 96 RappoRt d'activité 2008 Bureau d’Études Cliniques et Thérapeutiques Les programmes hospitaliers en recherche clinique (PHRC) en 2008 En 2008, 2 PHRC ont été obtenus pour des essais promus par le BECT dans le PAC Accord : Deux par le ministère de la Santé publique : - au Centre Alexis Vautrin (Pr Thierry CONROY) pour le projet ACCORD 17/0707 intitulé : « Etude de phase II-III comparant la radiochimiothérapie avec le schéma FOLFOX à la radiochimiothérapie par 5FU-cisplatine (schéma HERSKOVIC) en traitement de première ligne du cancer de l’œsophage inopérable » - au centre Eugène Marquis (Dr Eveline BOUCHER) pour le projet ACCORD 18/0803 intitulé : « Essai de phase III multicentrique randomisé, comparant l’effet d’une chimiothérapie adjuvante de 6 mois par gemcitabine-oxaliplatine à 85mg/m² (GEMOX 85) à une surveillance, chez des patients opérés d’un cancer des voies bilaires ». CC CL RappoRt d'activité 2008 97 Bureau d’Études Cliniques et Thérapeutiques Observatoire du médicament Observatoire du médicament C réé en 2004, l’Observatoire du médicament s’inscrit dans une démarche qualitative qui vise à apprécier la pertinence des prescriptions, l’objectif étant à la fois de s’assurer le bon usage des médicaments anticancéreux (hors GHS) les plus coûteux au sein des Centres de lutte contre le cancer (CLCC) et de justifier leur usage auprès des autorités de tutelle. Médicaments onéreux : le bon usage se consolide L’Observatoire du Médicament a réalisé une enquête sur les prescriptions des molécules les plus onéreuses dans les 20 CLCC. Les résultats montrent que, dans la grande majorité des cas, les prescriptions sont conformes aux recommandations et aux connaissances scientifiques. L’Observatoire du médicament réalise deux enquêtes tous les ans auprès des pharmaciens de chaque CLCC. L’analyse des résultats obtenus est effectuée par un collège d’experts réunissant des pharmaciens et des médecins oncologues. Ces résultats sont également diffusés auprès des directeurs et secrétaires généraux des centres, ainsi qu’aux présidents des comités de médicaments. Ils peuvent donc alimenter, au sein de chaque CLCC, les discussions sur le coût des molécules, leur remboursement et les bonnes pratiques médicales. Les enquêtes portent sur une période limitée de temps, une semaine, pendant laquelle les pharmaciens sont chargés de remplir des fiches décrivant la totalité des prescriptions des molécules étudiées. Ces fiches renseignent sur les indications cliniques, la posologie et les modalités d’administration. Elles comprennent également l’opinion du pharmacien sur le bon usage de chaque prescription, en fonction des référentiels mis à jour avant chaque sondage et de la grille d’analyse élaborée dans le cadre de l’Observatoire. Cette grille distingue trois catégories d’utilisation des médicaments 1- Les prescriptions en « situation scientifiquement reconnue ». Elles correspondent aux ordonnances en conformité avec les autorisations de mise sur le marché (AMM) et aux anticipations d’extension d’AMM sur la base de publications référencées. 2- Les prescriptions en « situation scientifiquement acceptables ». Celles-ci sont concordantes avec des résultats d’essais de phase III publiés ou présentés en congrès internationaux ; ou avec une indication validée par une méta-analyse ; ou ayant fait l’objet d’un consensus d’experts. 3- Les prescriptions en « situation non reconnue », qui ne répondent pas aux critères précédents. Parmi ces prescriptions, deux sous-catégories (IIIA et IIIB) sont distinguées. Cela permet de différencier celles qui sont « à justifier », aux vues des informations spécifiques du dossier médical des patients concernés, de celles qui sont « non justifiables » qui relèvent du mésusage. Chacune des fiches classées dans l’une ou l’autre de ces sous-catégories est revue par le collège d’experts qui a la possibilité, au regard des dernières connaissances scientifiques disponibles, de les reclasser dans une autre catégorie. 98 RappoRt d'activité 2008 Bureau d’Études Cliniques et Thérapeutiques RappoRt d'activité 2008 99 Bureau d’Études Cliniques et Thérapeutiques ire ato serv Ob du nt me dica é m Observatoire du médicament Observatoire du médicament L’Enquête 2008 • Figure 1 100% médiane : 89,9 % Cette enquête a porté sur six molécules : Gemzar®, Herceptin®, Taxotère®, Avastin®, Erbitux® et Alimta®. Dans les 20 centres, les pharmaciens ont colligé un nombre total de 2 392 fiches. Ceci monte à environ 15 000 le nombre de fiches collectées depuis le début de ces enquêtes , en avril 2005 (voir tableau 1) : 167 230 188 212 ELOXATINE 267 237 219 216 GEMZAR® 359 424 365 HERCEPTIN 307 483 TAXOTERE® 414 CAMPTO® ® Ob serv ato ire d mé u dica me nt ® ERBITUX ® Mai 2007 Novembre 2007 Juin 2008 356 408 383 369 589 670 602 610 631 450 505 501 552 504 525 144 133 159 145 175 222 87 83 125 216 384 AVASTIN® 43 ALIMTA ® TOTAL N=1514 N=1968 100 RappoRt d'activité 2008 Bureau d’Études Cliniques et Thérapeutiques N=2046 N=2197 N=1832 N=1888 N=2174 ire ato serv Ob du nt me dica é m 0 RappoRt d'activité 2008 101 Bureau d’Études Cliniques et Thérapeutiques Centre 20 Novembre 2006 Centre 6 Juin 2006 Centre 4 Novembre 2005 100 50% Centre 15 Avril 2005 93,6 94,5 98,7 79,6 Centre 10 Molécules étudiées 87,9 93 97,5 75,3 76,2 73,9 74,8 Centre 11 • tableau 1 : Liste des sondages et des molécules étudiées pour la fnclcc entre 2005 et 2006 87 90,2 90,9 91,1 89,1 89,5 96,1 84,1 Centre 18 Une seule enquête a été réalisée en juin 2008, durant la semaine du 9 au 14 juin 2008. Plusieurs modifications sont intervenues dans la réalisation de celles-ci. Ainsi, une nouvelle molécule a été ajoutée : le premetrexed (Alimta®). Par ailleurs, les référentiels établis par l’Inca, sur la cancérologie digestive, l’oncologie thoracique et les cancers du sein ont été utilisés par les pharmaciens pour évaluer l’usage des médicaments. Enfin les fiches produits ont été actualisées par les experts en fonction des nouvelles indications AMM et des nouvelles données de la littérature. Centre 14 - Autre organe sans étude de phase III publiée. Centre 16 - Posologie hors AMM si avis d'experts. La Figure 1 présente le pourcentage de prescriptions jugées scientifiquement reconnues ou acceptables (classement des centres sur les valeurs brutes) Les centres sont classés à partir des valeurs brutes obtenues de ces pourcentages. La ligne horizontale représente la médiane de la distribution observée parmi les 20 centres. Centre 5 - Ligne x+n : avis d'experts. Centre 19 - Autre ligne que l'indication AMM. Un premier critère de qualité concerne le pourcentage de prescriptions jugées « scientifiquement reconnues » ou « acceptables » : 87,5 % des prescriptions rentrent ainsi dans les catégories 1 et 2 du classement ce qui représente un bon chiffre global de bon usage de ces médicaments. Centre 2 - Ligne x-1 : si phase II randomisée concluante. - Indication pour laquelle une étude de phase III randomisée, publiée dans une revue internationale avec comité de lecture avec un rapport bénéfice / risque inférieur au traitement de référence. Centre 17 - Adjuvant si li médicament a l'AMM en situation métastatique. Centre 7 - Association autre que prévue dans l'AMM : phase III randomisée ou avis d'experts. - Traitement ciblé sans mise en évidence de l'expression de la cible (ex : Herceptin®). Centre 12 - Association / posologie différente non validée. Centre 1 - Au moins une étude de phase III randomisée, publiée dans une revue internationale avec comité de lecture avec un rapport bénéfice/risque non inférieur au traitement de référence. - Indication validée par une méta-analyse. - Poster présenté à un congrès international. En juin 2008, les 218 fiches concernant des prescriptions réalisées hors du cadre d’un essai thérapeutique (ce qui représente environ 9% de l’ensemble des fiches colligées) n’ont pas été retenues pour l’analyse. Sur les 2 163 fiches renseignées, 1 219 (soit 56,4%) concernent une situation scientifiquement reconnue, 672 (soit 31,1%) une situation considérée comme acceptable selon le référentiel de bon usage, et 272 fiches (soit 12,6%), des prescriptions non reconnues dont 59 (2,7%) jugées non justifiables. Pour 11 fiches, cette donnée est manquante. - Utilisation relevant d'une contre-indication ou d'une mise en garde / précaution d'emploi. Centre 3 - Anticipation d'extension d'AMM sur données motivées. - Une étude de phase II publiée. Centre 9 - AVIS FAVORABLE DE LA COMMISSION D'AMM DE L'AFASSPS SUR L'EXTENSION D'INDICATION. - Etude de phase III présentée oralement à un congrès international, avec comité scientifique de lecture (ASCO, ESMO, ASTRO, San Antonio,...). Centre 13 - AMM. III Situation non reconnue II Situation scientifiquement acceptable Centre 8 I Situation scientifiquement reconnue Observatoire du médicament Il apparaît qu’au cours de cette enquête, la médiane de l’indicateur (chiffre intermédiaire autour duquel se répartissent autant de centres au dessus qu’en dessous) est située à 89,9% (moyenne = 88,1%). Le second critère de qualité concerne les pourcentages de prescriptions III B considérées comme du « mésusage ». C’est pour bien préciser la pertinence de l’évaluation de ces cas que les fiches appartenant aux catégories III A et III B ont été revues par les experts oncologues ( soit pour cette enquête, 272 fiches ). Le tableau ci-dessous montre que seuls 3 centres dépassaient la barrière des 5 % de prescriptions jugées « non justifiables ». • tableau 2 : Prescriptions classées III A et III B (NR) Centre 1 (4) Centre 2 Centre 3 Centre 4 Centre 5 Centre 6 Centre 7 (1) Centre 8 Centre 9 (3) Centre 10 Centre 11 Centre 12 Centre 13 Centre 14 Centre 15 Centre 16 Centre 17 Centre 18 (3) Centre 19 Centre 20 TOTAL Situation à justifier Situation non justifiable Sous-total Total n n % n % n % n % 86 14 11,7 % - - 14 11,7 % 120 100 % 67 83 32 51 51 10 19 6 1 8,3 % 12,3 % 7,0 % 1,3 % 1 1 1 - 0,8 % 0,6 % 2,5 % - 11 20 1 6 1 9,1 % 13,0 % 2,5 % 7,0 % 1,3 % 121 154 40 86 78 100 % 100 % 100 % 100 % 100 % 58 8 8,3 % 2 2,1 % 10 10,4 % 96 100 % 36 81 34 44 55 16 16 24 18 11 19,0 % 11,3 % 24,7 % 16,8 % 10,0 % 4 6 9 1 4,8 % 4,3 % 8,4 % 0,9 % 20 22 24 27 12 23,8 % 15,6 % 24,7 % 25,2 % 10,9 % 84 141 97 107 110 100 % 100 % 100 % 100 % 100 % 39 14 15,1 % 5 5,4 % 19 20,4 % 93 100 % 70 76 71 69 3 3 9 12 3,3 % 2,9 % 6,4 % 7,3 % 2 1 4 2,2 % 1,0 % 2,4 % 5 4 9 16 5,5 % 3,9 % 6,4 % 9,8 % 91 103 141 164 100 % 100 % 100 % 100 % 80 16 10,3 % 19 12,2 % 40 25,6 % 156 100 % 89 47 8 - 6,5 % - 3 - 2,4 % - 11 - 8,9 % - 124 68 100 % 100 % 1219 208 9,6 % 59 2,7 % 272 12,5 % 2174 100 % Les résultats de cette enquête consolident la notion de bonne prescription des molécules onéreuses dans les Centres de lutte contre le cancer ire ato serv Ob du nt me dica é m Ob serv ato ire d mé u dica me nt 102 RappoRt d'activité 2008 Bureau d’Études Cliniques et Thérapeutiques RappoRt d'activité 2008 103 Bureau d’Études Cliniques et Thérapeutiques Recherche translationnelle Recherche translationnelle Recherche de transfert Essai ACCORD 13 Cette étude annexe avait pour objectif : • De déterminer l’influence des polymorphismes des gènes impliqués dans le métabolisme du fluorouracile (5FU), de la capécitabine et de l’irinotecan, et du gène HER-1 (EGFR) (variant R497K, polymorphisme de répétition (CA)n de l’intron 1), sur la toxicité et la réponse au traitement chez des patients traités pour un Cancer colo-rectal métastatique (CCRM) en première ligne ; L a recherche translationnelle est le deuxième grand axe de développement du BECT. Il s’agit d’une recherche de laboratoire qui permet une application rapide des techniques innovantes au lit du malade. Toutes les études promues par le BECT doivent maintenant prévoir une collecte de tumeurs et/ou de prélèvements sanguins qui permettront la mise en place de programmes de recherche translationnelle. • D’évaluer l’intérêt de la mesure, avant et au cours du premier cycle de traitement, du taux de cellules endothéliales circulantes (CEC) et du taux d’ARNm [CD146] circulant, pour la prédiction précoce de l’efficacité du traitement (taux de réponse, survie globale et survie sans progression). • De constituer une banque d’ADN, d’ARN et de cellules mononucléées circulantes ; • D’identifier de façon prospective, sur une cohorte homogène de patients atteints de CCRM non pré-traités, des biomarqueurs pharmacogénétiques et pharmacodynamiques prédictifs de l’efficacité et de la tolérance de deux schémas de biochimiothérapie modernes, associant fluoropyrimidine, irinotecan et bevacizumab. En particulier, les biomarqueurs candidats à la prédiction de la réponse pourront être évalués sur deux groupes de patients (répondeurs versus non répondeurs) escomptés équilibrés puisque le taux de réponses attendues est de l’ordre de 50 % avec les deux schémas. Dans les centres participants et chez les patients consentants, ont été réalisés : • Pour l’étude pharmacogénétique : un prélèvement de 10 ml sang veineux périphérique à J1 avant une cure de chimiothérapie. • Pour les CEC, un prélèvement de 10ml de sang veineux à J1 (avant traitement), à J8 (facultatif) et avant le début de la 2e cure (J15 [FOLFIRI] ou J22 [XELIRI]). Les CEC, identifiées par le phénotype CD45 -, CD31 +, CD146 +, 7-aminoactinomycine -, ont été quantifiées en cytométrie de flux 4 couleurs dans 1 ml de sang total, afin d'accumuler un grand nombre d'événements (jusqu'à 5 x 106 par test), selon une méthode validée antérieurement (J Immunol Methods 2008). Les résultats ont été corrélés aux caractéristiques des patients et au critère de jugement principal (tests de Wilcoxon, de Fisher et de tendance). 104 RappoRt d'activité 2008 Bureau d’Études Cliniques et Thérapeutiques RappoRt d'activité 2008 105 Bureau d’Études Cliniques et Thérapeutiques he erc n ch R e latio ns a r t le nel Recherche translationnelle Recherche translationnelle Essai ACCORD 14 • L’objectif de cette étude translationnelle est d’identifier, dans le cadre de cet essai prospectif, les facteurs prédictifs biologiques de la réponse (réponse histologique complète) et de la toxicité de la radiochimiothérapie associée à un anticorps monoclonal, le cetuximab. Cette étude des facteurs prédictifs biologiques de réponse aux traitements est optionnelle dans tous les centres investigateurs. Elle est composée de trois parties : Cette étude des caractéristiques de l’individu potentiellement prédictives de l’efficacité et de la toxicité de la radiochimiothérapie était optionnelle pour tous les centres participants. Elle a consisté en un prélèvement de 10ml de sang veineux périphérique. 311 patients ont été prélevés. L’extraction des ADN est déjà bien avancée, et le passage sur les puces pharmacogénétiques est prévu l’an prochain. • Pour chaque patient inclus dans le protocole, lors d’un prélèvement sanguin effectué pour le contrôle des paramètres biologiques standards avant l’administration d’une chimiothérapie, il sera également prélevé 10 ml de sang veineux périphérique. Pour chaque patient, lors de l’endoscopie digestive basse entrant dans le cadre du staging pré thérapeutique et/ou de la détermination du statut KRAS, il sera réalisé huit prélèvements biopsiques endoscopiques pré-thérapeutiques sur le tissu tumoral (2 pour l'inclusion en paraffine et 6 pour l’immersion en RNA later) et trois prélèvements biopsiques endoscopiques pré-thérapeutiques en muqueuse saine : • Deux des huit prélèvements sur le tissu tumoral et un des 3 prélèvements en muqueuse saine seront inclus en paraffine. • Six des huit prélèvements sur le tissu tumoral et deux des 3 prélèvements en muqueuse saine seront immergés en RNA later. Essai ACCORD 12 • L’objectif de cette étude biologique est d’identifier, dans le cadre de cet essai prospectif randomisé, les facteurs prédictifs biologiques de réponse et de toxicité de la radiothérapie et de la radiochimiothérapie. Cette étude permettra : • De sélectionner sur un grand nombre de patients les facteurs constitutionnels et tumoraux les plus discriminants pour prédire la toxicité et la réponse au traitement. • Une meilleure compréhension des mécanismes de sensibilité et de résistance à la radiochimiothérapie qui constituera une première approche vers un traitement plus individualisé. A terme, le but serait de proposer un traitement « à la carte » pour chaque patient en fonction des facteurs génétiques et épigénétiques considérés, à l’issue de cette étude, comme pertinents pour prédire l’efficacité et la toxicité de la radiochimiothérapie. Ce travail pourrait en particulier permettre de mieux orienter le choix du traitement préopératoire optimal définissant les malades à qui il faudrait proposer une radiothérapie préopératoire intensifiée par une chimiothérapie et ceux chez qui une radiothérapie seule suffirait. Re ch er tra nsl c h e ati nel onle 106 RappoRt d'activité 2008 Bureau d’Études Cliniques et Thérapeutiques he erc n ch R e latio ns a r t le nel RappoRt d'activité 2008 107 Bureau d’Études Cliniques et Thérapeutiques FCPRCC Fédération des Comités de patients en Recherche Clinique en Cancérologie (FCPRCC) Bilan de 10 ans de consultations des comités sur les protocoles d’essais • Depuis la création du premier Comité de patients, pas moins de 152 protocoles d’essais ont été relus. Au total, les membres des Comités ont émis 1149 commentaires à l’attention des investigateurs. Nombre de protocoles relus entre 2000 et 2008 I nitiative commune de la Ligue nationale contre le cancer et de la Fédération nationale des centres de lutte contre le cancer, les Comités de patients en Recherche Clinique en Cancérologie ont fêté leur dix années d’existence. 30 29 20 17 La création de la Fédération des Comités de patients en Recherche Clinique en Cancérologie en 2002 a élargi la portée de ce mouvement à la quasi-totalité des CLCC ainsi qu’à des partenaires industriels qui ont voulu se lancer dans cette démarche. Bureau d’Études Cliniques et Thérapeutiques 5 2000 2001 janvier 2008 - n° 12 [ Les résultats de l’enquête SATIS 04 ] Les femmes ayant participé à un essai tendent à être globalement plus satisfaites de leur prise en charge médicale, notamment dans la communication avec leur médecin. Tel est le principal résultat d’une importante enquête sur la perception des patientes visà-vis des essais thérapeutiques, enquête réalisée avec le concours de la Fédération des Comités de patients et du BECT. Q La lettre d'information aux patients Conception-Rédaction : Franck FONTENAY, RCP Communication Comité Editorial : Sylvia ACHIN, Nicole ALBET, Corinne DENONFOUX, Jean-Pierre ESCANDE, Dr Jean GENEVE, Marta JIMENEZ, Dr Françoise MAY-LEVIN, Impression : IDEM 41 uelles sont les raisons qui conduisent à accepter de participer à un essai thérapeutique ? Quel est l’impact de cette participation sur la satisfaction des patients vis-à-vis de leur prise en charge ? Telles sont les deux principales questions explorées par l’enquête SATIS 04 qui a été réalisée par l’unité UMR 379 de l’Inserm (Institut Paoli Calmette, Marseille), en partenariat avec le Comité de Patients de la Fédération Nationale des Centres de Lutte Contre le Cancer (FNCLCC) et de la Ligue Nationale Contre le Cancer. Les résultats de cette enquête ont été récemment publiés dans deux importantes revues médicales (1, 2). SATIS 04 a été conduite entre février 2002 et août 2004 auprès de 455 femmes suivies pour un cancer du sein et qui recevaient toutes la même chimiothérapie (le protocole FEC100). Ces femmes étaient prises en charge dans seize Centres de Lutte Contre le Cancer et ont été réparties en trois groupes : • Un groupe “essai”, comprenant 201 patientes ayant accepté de participer à l’essai PACS 04 ou PACS 05 (3), essais mis en œuvre par le BECT (Bureau d’Etudes Cliniques et Thérapeutiques) ; • Un groupe “témoin”, réunissant 188 femmes auxquelles leur médecin n’avait pas proposé d’entrer dans un essai ; • Un groupe “refus”, regroupant 66 patientes qui n’avaient pas accepté d’entrer dans un des essais PACS 04 ou PACS 05. Les femmes qui ont participé à l’enquête SATIS 04 étaient âgées en moyenne de 50 ans. 80 % d’entre elles vivaient en couple et 74 % exerçaient une activité professionnelle. Les informations ont été recueillies à l’aide d’auto-questionnaires adressés à trois reprises au domicile des patientes : au cours du mois suivant la première cure de chimiothérapie, au septième mois de leur traitement, enfin un an après le début de la chimiothérapie. Les questionnaires portaient essentiellement sur l’état psychologique, le soutien social et familial, l’attitude vis-à-vis des essais cliniques et la satisfaction à l’égard des modalités de la prise en charge médicale. Une communication de meilleure qualité Le premier volet de l’enquête a porté sur la satisfaction des femmes vis-à-vis de leur prise en charge, selon qu’elles participaient ou non à un essai. Les patientes ont dans un premier temps été interrogées au début de leur traitement. Il ressort que celles auxquelles un essai a été proposé (qu’elles aient ensuite Trait d'union, n° 12, janvier 2008. Côté Patients L’actUaLité des coMités de Patients PoUr La recherche cLiniqUe en c ancéroLoGie 19 octobre 2008 2002 2003 2004 2005 2006 2007 2008 24 protocoles de recherche ont été relus par les membres de la Fédération des Comités de patients en Recherche Clinique en cancérologie pour l’année 2008. 5 essais promus par le BECT de la FNCLCC (cancer du sein - inflammatoire et avec métastases cérébrales, cancer de la prostate, cancer anal et sarcome). 17 protocoles ont été soumis par les CLCC (Institut Curie, Institut Paoli-Calmettes, Institut G. Roussy, Centre L. Bérard, Institut Bergonié, Centre V. D’Aurelle, Centre. GF Leclerc). 2 essais industriels (ROCHE) ont également été relus : 1 essai dans le cancer du sein inflammatoire (Beverly2), et 1 étude dans le cancer du sein localement avancé ou métastatique (HAX). Ceci conforte l’intérêt de l’industrie dans la collaboration avec le Comité de patients dans son rôle d’expertise pour la relecture des protocoles. Le temps moyen de relecture est d’environ 12 jours sur l’ensemble des protocoles, ce qui reste conforme au circuit de relecture prévue dans la procédure de fonctionnement du comité. • anniversaire Les 10 ans des Comités de Patients. • interview A l’origine du premier Comité, le Dr Françoise May-Levin explique le sens de sa démarche. • ProtocoLes Bilan de 10 ans de consultations des Comités sur les protocoles d’essais. • téMoiGnaGes Des membres de Comités expliquent pourquoi ils se sont engagés et quel bilan ils tirent de leur expérience. Les dix ans des Comités de Patients Une aventure en marche Initiative commune de la Ligue Nationale Contre le Cancer et de la Fédération Nationale des Centres de Lutte Contre le Cancer, les Comités de Patients ont dix ans cette année. C’est l’occasion de revenir sur le travail accompli par les membres de ces comités en faveur des patients participant à des essais thérapeutiques. C’est en 1998 que le premier Comité de Patients pour la recherche clinique en cancérologie a vu le jour. Avec pour objectif général de favoriser l’implication des patients dans la recherche clinique sur les cancers et de faire en sorte qu’ils soient de véritables partenaires des médecins. Pour cela, les membres du Comité ont estimé que l’information délivrée aux patients était un élément crucial dans la relation d’un malade avec un médecin lui proposant de participer à un essai. Le Comité a donc mis en place une procédure de relecture des protocoles d’essais qui s’attache notamment à améliorer la note d’information remise aux patients avant toute entrée dans un essai. Grâce à ce travail d’échange avec les promoteurs et les investigateurs d’essais, l’information des patients a connu une amélioration sensible. De plus, cet échange a contribué à davantage sensibiliser le corps médical aux problématiques propres aux patients. côté patients, octobre 2008. 108 RappoRt d'activité 2008 5 Les bénéfices associés à la participation à un essai thérapeutique sommaire Grâce à ce travail d’échange entre les promoteurs et les investigateurs d’essais, l’information des patients a connu une amélioration sensible. De plus, cet échange a contribué à davantage sensibiliser le corps médical aux problématiques propres aux patients. 0 La lettre d'information aux patients 19 14 10 C’est en effet en 1998 que le premier Comité de patients pour la Recherche Clinique en Cancérologie a vu le jour, avec pour objectif général de favoriser l’implication des patients dans la recherche clinique sur les cancers et de faire en sorte qu’ils soient de véritables partenaires des médecins. Pour cela, les membres du Comité ont estimé que l’information délivrée aux patients était un élément crucial dans la relation d’un malade avec un médecin lui proposant de participer à un essai. Le Comité a donc mis en place une procédure de relecture des protocoles d’essais qui s’attache notamment à améliorer la note d’information remise aux patients avant toute entrée dans un essai. 24 22 Documents publiés en 2008 : • Deux nouveaux Trait d’Union ont été édités : - N° 12 : présentation des résultats de l’enquête de satisfaction patients SATIS 04 - N°13 : cancer du sein, présentation des résultats de l’essai PACS 04 Des réunions plénières biannuelles ont permis notamment de rappeler aux patients les nouvelles réglementations relatives au prélèvement, à la collection et à l’utilisation d’échantillons tissulaires au cours des études cliniques. • Ainsi que deux numéros de Côté Patients - Mai 2008 - Octobre 2008 RappoRt d'activité 2008 109 Bureau d’Études Cliniques et Thérapeutiques é mit Co e d nts tie pa Organigramme Organigramme EQUIPE DIRECTION SCIENTIFIQUE - BECT Dr Jocelyne Bérille Directrice Scientifique tél. 01 44 23 04 19 [email protected] tél. 01 44 23 55 52 [email protected] Corinne GAMET Assistante de Direction tél. 01 44 23 55 62 [email protected] Narges BEN YOUNES Assistante au BECT tél. 01 76 64 78 03 [email protected] Dr Jean GENEVE Directeur du BECT EQUIPE DIRECTION SCIENTIFIQUE - BECT Groupe tumeurs Groupe tumeurs Groupe tumeurs Groupe tumeurs Groupe tumeurs ACCORD Digestif FEDEGYN GETUG Urologie SARCOME SEIN Christine MONTOTO-GRILLOT Christine REGNAULT Assistante Chef de Projets tél. 01 44 23 55 67 [email protected] tél. 01 44 23 04 68 [email protected] GERICO Oncogériatrie poUmon Muriel HABIBIAN Chef de Projets tél. 01 76 64 78 07 [email protected] Fabienne GOUTTENOIRE Chef de Projets Anne Chantal LE GALL Assistante de Projets tél. 01 44 23 55 77 [email protected] tél. 01 44 23 04 13 [email protected] Affaires Réglementaires et Assurance Qualité Michèle TORRES-MACQUE ARC ACCORD tél. 01 44 23 04 68 [email protected] tél. 01 44 23 55 68 [email protected] Laurent DELLUC ARC Elisabeth HULIER Responsable Affaires Réglementaires et Assurance Qualité tél. 01 44 23 55 53 [email protected] tél. 01 44 23 55 72 [email protected] Carole DELAVAULT Chargée de la Pharmacovigilance du BECT tél. 01 44 23 04 16 [email protected] Elisabete MENDES Assistante Affaires Réglementaires et Assurance Qualité tél. 01 44 23 04 62 [email protected] Rida ATMI Technicien Affaires Réglementaires tél. 01 44 23 04 79 [email protected] org anig ram me Karine KOUAKOU Assistante Pharmacovigilance Laurence OLIVIER Assistante Pharmacovigilance tél. 01 44 23 55 86 [email protected] tél. 01 44 23 55 63 [email protected] 110 RappoRt d'activité 2008 Bureau d’Études Cliniques et Thérapeutiques Didier VENIGER Opérateur de saisie Pharmacovigilance tél. 01 44 23 04 73 [email protected] Anne-Laure MARTIN Marta JIMENEZ Chef de Projets tél. 01 44 23 55 58 [email protected] Rachida ZANFONGNON ARC tél. 01 44 23 55 50 [email protected] Chef de Projets tél. 01 44 23 55 56 [email protected] Christine PHILIPPE Assistante de Projets Cécile LOUVET Assistante de Projets tél. 01 44 23 55 73 [email protected] Christine REGNAULT Assistante de Projets GEP Patricia NEZAN Assistante de Projets tél. 01 44 23 04 15 [email protected] Céline MAHIER-AIT OUKHATAR ARC Coordonnateur tél. 01 44 23 55 84 [email protected] Bochra HACHANI ARC tél. 01 44 23 04 14 [email protected] tél. 01 44 23 04 72 [email protected] Sara GARCIA Assistante de Projets tél. 01 44 23 04 65 [email protected] Christel MESLEARD ARC Coordonnateur tél. 01 44 23 55 51 [email protected] Sylvie MIJONNET ARC tél. 01 44 23 04 75 [email protected] RappoRt d'activité 2008 111 Bureau d’Études Cliniques et Thérapeutiques me ram anig g r O Nous remercions celles et ceux qui, par leur contribution et leur investissement, ont permis de mener à bien la réalisation du rapport d’activité du BECT. La Direction de la Communication de la FNCLCC. Responsable de la publication Dr Jocelyne Bérille Conception graphique Pour les photographies documentaires (droits réservés). Interviews réalisées par Franck Fontenay. Imprimé en France sur du papier recyclé. © FNCLCC - Juin 2009 FNCLCC Fédération nationale des Centres de lutte contre le cancer 101, rue de Tolbiac 75654 Paris Cedex 13 Tél : 01 44 23 04 04 / Fax : 01 45 84 66 82 [email protected] www.fnclcc.fr