monographie de produit

25 août, 2014
Page 1 de 48
MONOGRAPHIE DE PRODUIT
Pr KIVEXA®
Comprimés de sulfate d’abacavir et de lamivudine
Comprimés d’abacavir et de lamivudine, 600 mg / 300 mg
(sous forme de sulfate d’abacavir)
Agent antirétroviral
ViiV Soins de santé ULC
245 boulevard Armand-Frappier
Laval (Québec)
H7V 4A7
No de contrôle : 175410
Date de révision :
25 août, 2014
©2014 ViiV Soins de santé ULC. Tous droits réservés.
®KIVEXA est une marque déposée, utilisée sous licence par ViiV Soins de santé ULC.
*ViiV Soins de santé et le logo ViiV Healthcare sont des marques de commerce utilisées sous licence par ViiV Soins
de santé ULC.

25 août, 2014
Page 2 de 48
Table des matières
PARTIE I : RENSEIGNEMENTS POUR LE PROFESSIONNEL DE LA SANTÉ . 3
RENSEIGNEMENTS SOMMAIRES SUR LE PRODUIT ................................... 3
INDICATIONS ET UTILISATION CLINIQUE ................................................... 3
CONTRE-INDICATIONS ..................................................................................... 4
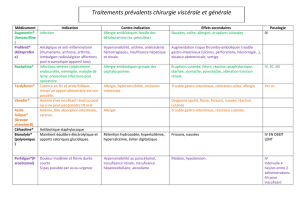
MISES EN GARDE ET PRÉCAUTIONS ............................................................. 5
EFFETS INDÉSIRABLES ................................................................................... 14
INTERACTIONS MÉDICAMENTEUSES ......................................................... 17
POSOLOGIE ET ADMINISTRATION ............................................................... 19
SURDOSAGE....................................................................................................... 20
MODE D’ACTION ET PHARMACOLOGIE CLINIQUE ................................. 21
ENTREPOSAGE ET STABILITÉ ....................................................................... 24
PRÉSENTATION, COMPOSITION ET CONDITIONNEMENT ...................... 24
PARTIE II : RENSEIGNEMENTS SCIENTIFIQUES .............................................. 25
RENSEIGNEMENTS PHARMACEUTIQUES .................................................. 25
ESSAIS CLINIQUES ........................................................................................... 27
MICROBIOLOGIE............................................................................................... 27
TOXICOLOGIE ................................................................................................... 31
RÉFÉRENCES ..................................................................................................... 37
PARTIE III : RENSEIGNEMENTS POUR LE CONSOMMATEUR ..................... 41

25 août, 2014
Page 3 de 48
PrKIVEXA®
Comprimés de sulfate d’abacavir et de lamivudine
Association à dose fixe
PARTIE I : RENSEIGNEMENTS POUR LE PROFESSIONNEL DE LA SANTÉ
RENSEIGNEMENTS SOMMAIRES SUR LE PRODUIT
Voie
d’administration Présentation et concentration Ingrédients non médicinaux
cliniquement importants
Orale
Comprimés
600 mg d’abacavir (sous forme de
sulfate d’abacavir) et 300 mg de
lamivudine
Aucun
Pour obtenir une liste complète, veuillez consulter la section PRÉSENTATION,
COMPOSITION ET CONDITIONNEMENT.
INDICATIONS ET UTILISATION CLINIQUE
KIVEXA® (sulfate d’abacavir-lamivudine) est indiqué pour le traitement antirétroviral
d’association de l’infection par le virus de l’immunodéficience humaine (VIH) chez les
adultes.
KIVEXA® est l’un de plusieurs produits contenant de l’abacavir. Avant d’amorcer un
traitement par KIVEXA®, on doit examiner les antécédents médicaux du patient pour
savoir s’il a déjà été exposé à un produit contenant de l’abacavir afin d’éviter de
l’administrer à un patient ayant une hypersensibilité à l’abacavir (voir la section MISES
EN GARDE et PRÉCAUTIONS).
Dans le cadre d’une trithérapie, les comprimés KIVEXA® sont recommandés en
association avec des agents antirétroviraux de diverses classes pharmacologiques mais
pas avec d’autres inhibiteurs nucléosidiques (ou nucléotidiques) de la transcriptase
inverse.
Enfants (< 18 ans)
L’innocuité et l’efficacité de KIVEXA® n’ont pas été établies chez des patients de moins
de 18 ans.

25 août, 2014
Page 4 de 48
Personnes âgées (> 65 ans)
En raison du nombre insuffisant de sujets âgés de 65 ans ou plus ayant participé aux
études cliniques sur KIVEXA®, il est impossible de déterminer s’ils répondent
différemment des sujets plus jeunes. En général, on doit faire preuve de prudence
lorsqu’on administre KIVEXA® à des patients âgés, car l’altération de la fonction
hépatique, rénale ou cardiaque et les affections ou les médications concomitantes sont
plus fréquentes dans cette population.
CONTRE-INDICATIONS
KIVEXA® (sulfate d’abacavir-lamivudine) est contre-indiqué :
• chez les patients qui présentent une hypersensibilité à ce médicament ou à l’un des
composants du produit ou du contenant. Pour obtenir une liste complète, veuillez
consulter la section PRÉSENTATION, COMPOSITION ET
CONDITIONNEMENT de la monographie du produit;
• chez les patients ayant une hypersensibilité connue à l’abacavir ou à des produits
renfermant de l’abacavir, sans égard au fait s’ils sont porteurs ou non de l’allèle
HLA-B*5701. Des réactions d’hypersensibilité fatales ont été associées à la reprise
du traitement par l’abacavir (voir la section MISES EN GARDE ET
PRÉCAUTIONS).
• chez les patients présentant une atteinte hépatique, étant donné que KIVEXA® est
une association à dose fixe et que la posologie de chaque composant ne peut être
modifiée (voir la section POSOLOGIE ET ADMINISTRATION).

25 août, 2014
Page 5 de 48
MISES EN GARDE ET PRÉCAUTIONS
Mises en garde et précautions importantes
• Réactions d’hypersensibilité fatales à l’abacavir
Des réactions d'hypersensibilité graves et parfois fatales ont été associées au traitement par le
sulfate d’abacavir et d’autres produits contenant de l’abacavir.
Le traitement par KIVEXA® (sulfate d’abacavir-lamivudine) doit être cessé chez les patients
qui présentent des signes ou des symptômes d’hypersensibilité dans au moins 2 des groupes
suivants : 1) fièvre, 2) éruption cutanée, 3) symptômes gastro-intestinaux (tels que nausées,
vomissements, diarrhée ou douleurs abdominales), 4) symptômes constitutionnels (par
exemple, malaise général, fatigue ou douleur continue), 5) symptômes respiratoires (par
exemple, pharyngite, dyspnée, toux et résultats anormaux de la radiographie pulmonaire
[principalement des infiltrats pouvant être localisés]) (voir la section MISES EN GARDE
ET PRÉCAUTIONS, Réactions d’hypersensibilité à l’abacavir, Signes et symptômes
d’hypersensibilité). Le traitement par KIVEXA® doit être cessé dès qu’une réaction
d’hypersensibilité est soupçonnée.
Les patients porteurs de l’allèle HLA-B*5701 sont très susceptibles de présenter une réaction
d’hypersensibilité associée à l’abacavir. Avant d’instaurer un traitement par l’abacavir, il est
recommandé d’effectuer le dépistage de l’allèle HLA-B*5701; cette intervention a permis de
réduire le risque de présenter une réaction d’hypersensibilité. Le dépistage est également
recommandé avant la reprise du traitement par l’abacavir chez les patients que l’on ne sait
pas s’ils sont porteurs de l’allèle HLA-B*5701 et qui ont déjà toléré l’abacavir. Les patients
qui ne sont pas porteurs de l’allèle HLA-B*5701 peuvent développer une réaction
d’hypersensibilité cliniquement soupçonnée à l’abacavir, toutefois cela survient beaucoup
moins fréquemment que chez les patients porteurs de l’allèle HLA-B*5701. Que le patient
soit porteur de l’allèle HLA-B*5701 ou non, on doit mettre fin au traitement par KIVEXA®
si l’on ne peut écarter l’existence d’une réaction d’hypersensibilité et ce, même si d’autres
diagnostics sont possibles.
Il ne faut jamais reprendre le traitement par KIVEXA® ou quelque autre produit
médicinal contenant de l'abacavir (p. ex., ZIAGEN®, TRIZIVIR®) après une réaction
d’hypersensibilité, car des symptômes plus sévères pourraient se manifester dans les
heures qui suivent, pouvant comprendre une hypotension menaçant le pronostic vital
ou la mort. La reprise du traitement par KIVEXA® ou tout autre produit contenant de
l’abacavir, même chez des patients qui n’ont aucun antécédent confirmé de réaction
d’hypersensibilité ou symptômes d’hypersensibilité non reconnus, peut donner lieu à des
réactions d’hypersensibilité graves ou fatales. De telles réactions peuvent survenir en
quelques heures (voir la section MISES EN GARDE ET PRÉCAUTIONS, Réactions
d’hypersensibilité à l’abacavir, Prise en charge clinique de l’hypersensibilité).
• Acidose lactique et hépatomégalie sévère avec stéatose
On a signalé des cas, dont certains mortels, d'acidose lactique et d'hépatomégalie sévère
accompagnée de stéatose pendant l'administration d'analogues nucléosidiques, seuls ou en
association, y compris KIVEXA® et d’autres antirétroviraux (voir la section MISES EN
GARDE ET PRÉCAUTIONS, Hépatique/biliaire/pancréatique).
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
1
/
48
100%