Livret des communications - Canceropole Nord

2
0
1
5
2
0
1
5
1
0
,
1
1
e
t
1
2
j
u
i
n
1
0
,
1
1
e
t
1
2
j
u
i
n
JUIN 2015
Du mer 10 juin, 14h au vend 12 juin, 13h
Centre International de Deauville
www.canceropole-nordouest.org
88
èmesè
mes
Journées
Journées
Scientifiques
Scientifi ques

8èmes Journées Scientifi ques
10 au 12 juin 2015 – Deauville
2
SOMMAIRE
SOMMAIRE p2
LISTE ALPHABÉTIQUE DES COMMUNICATIONS JEUNES CHERCHEURS p3
EDITORIAL DU PRÉSIDENT p4
PROGRAMME DES 8ÈMES JOURNÉES SCIENTIFIQUES 2015 p 5 - 9
COMMUNICATIONS DES ORATEURS ET CONFÉRENCES DE PRESTIGE p 10 - 15
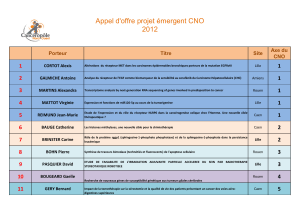
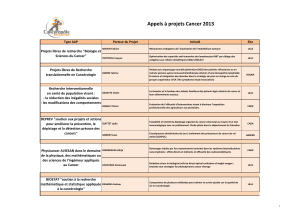
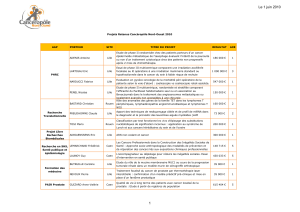
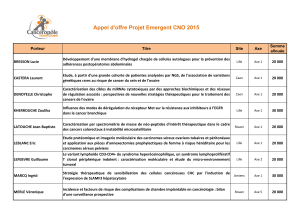
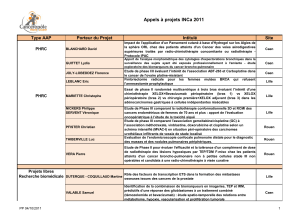
AAP EMERGENT 2014 CNO : PRÉSENTATION DES RÉSULTATS DE RECHERCHE p 16 - 23
SESSION JEUNES CHERCHEURS p 24 - 87
Résumés des 12 communications orales sélectionnées
Résumés des communications affi chées
p
p
25 - 36
37 - 87
- Axe 1 : Du développement et la validation de biomarqueurs pronos-
tiques et prédictifs à l’innovation thérapeutique p 38 - 68
- Axe 2 : Aspects cliniques et biologiques des hémopathies malignes B p 69 - 76
- Axe 3 : Imagerie moléculaire et adaptation thérapeutique p 77 - 80
- Axe 4 : Cancer et neurosciences p 81 - 84
- Axe 5 : Cancers, individu et société p 85 - 87
PRÉSENTATION DE MATWIN p88
PRÉSENTATION DU SIRIC ONCOLILLE p89
PRÉSENTATION DES DIFFÉRENTES PLATEFORMES AU SEIN DU CNO
- Le centre de traitements des données p 91
- Les plateformes de génomique Lille / Rouen / Caen p 92 - 93
- Les tumorothèques dans le Cancéropôle Nord-Ouest p 94
- La plateforme nationale méthodologique pour la recherche sur les
inégalités sociales en cancérologie p95
- La plateforme nationale qualité de vie p 96
- La plateforme Cancer et Cognition du Cancéropôle Nord-Ouest p 97
LES CINQ AXES DE RECHERCHE DU CANCÉROPÔLE NORD-OUEST p98
LISTE ALPHABÉTIQUE DES COMMUNICATIONS JEUNES CHERCHEURS p99

8èmes Journées Scientifi ques
10 au 12 juin 2015 – Deauville
3
Les communications par ordre alphabétique
NOM n° de poster
ou com.
orale
n°
page NOM / Prénom n° de poster
ou com.
orale
n°
page
AL BAGAMI Mohamed 28 65 GONZALES Fanny 33 70
AL BAGAMI Mohamed 32 69 GUICHET Pierre-Olivier Com Orale 10 34
ANFRAY Clément Com Orale 9 33 GUILBERT Matthieu 18 55
AURY-LANDAS Juliette 9 46 HASNA Jessy 19 56
BADAOUI Mehdi 20 57 HOUESSINON Aline Com Orale 4 28
BAILLEUL Justine Com Orale 7 31 KASPER Edwige 23 60
BENHABILES Hana 6 43 KELLER Maureen 13 50
BOCHEREAU Flora 27 64 LAMBERT Mélanie 35 72
BOUGEARD Gaëlle 24 61 LANGE Marie 46 83
BOUZELFEN Abdelilah 37 74 LAPOTRE-LEDOUX Bénédicte 48 85
BRAY Fabrice 8 45 LAURENT Carine 42 79
BROSSEAU Solenn 15 52 Le BOURHIS-ZAIMI Maggie 50 87
BUSTANY Sophie 39 76 LHUISSIER Eva 40 77
CAMUS Vincent 43 80 LORETTI Aurore Com Orale 12 36
CARTON-LATRECHE Céline 36 73 LUCAS Mélodie 49 86
CHEVALIER Elodie 14 51 MARESCHAL Sylvain 38 75
COLY Pierre-Michaël 47 84 MEKKI Meriem Sarah 1 38
CORVAISIER Matthieu Com Orale 3 27 MODZELEWSKI Romain Com Orale 8 32
COUTURE Alexandre 4 41 MRIZAK Dhafer 11 48
DELLIAUX Carine 29 66 MULLER Etienne Com Orale 2 26
DUBOIS Fatéméh 12 49 MUSTAPHA Rami 5 42
DUBOIS Martine 44 81 PERRIERE Marianne 21 58
DUBOIS Martine 45 82 QUILLET Aurélien 30 67
DUBOIS Sydney Com Orale 6 30 RENAUD Sarah 10 47
DUBUISSEZ Marion 3 40 ROUSSEL Lise-Marie Com Orale 11 35
DUMORTIER Mandy 17 54 SEFRIOUI David 22 59
DUPLOYEZ Nicolas 34 71 SFAXI Samah 26 63
DUPRET Barbara 7 44 SIMONNEAU Claire 2 39
FERRET Yann Com Orale 5 29 TIAN Lu Com Orale 1 25
GAUDELOT Kelly 31 68 VASSEUR Romain 25 62
GIRARD Nicolas 41 78 VENNIN Constance 16 53

8èmes Journées Scientifi ques
10 au 12 juin 2015 – Deauville
4
Ces 8èmes journées sont les premières depuis la reconduction du Cancéropôle
Nord-Ouest dans le cadre du 3ème plan cancer.
Elles seront l’occasion de vous présenter notre stratégie pour les 3 ans de
ce nouveau plan et de sa déclinaison au sein de nos cinq axes thématiques
et de nos plates-formes.
Le programme de ces journées fera également une très large place aux
jeunes chercheurs et au bilan des projets soutenus dans le cadre de notre
appel à projets émergent. L’accompagnement des chercheurs et le soutien
à l’émergence font en effet partie de nos missions essentielles, ainsi que
le souligne le nouveau contrat d’objectifs et de performances qui lie les
cancéropôles et l’INCa.
Un point sera fait sur le développement de la recherche clinique, une mission
nouvelle des cancéropôles, mais dans laquelle le cancéropôle Nord-Ouest
s’investit depuis des années et est considéré comme pionnier par l’INCa.
Associer chercheurs et acteurs de la société civile est une des recom-
mandations fortes du plan cancer. Vous aurez l’occasion de découvrir la
démarche très originale développée dans ce domaine par l’association
« Les Seintinelles ».
Dans le domaine de l’innovation technologique, le projet de recherche et
développement en hadronthérapie Archade et les perspectives qu’il offre à
la recherche en radiobiologie seront également présentés.
Nos journées seront aussi comme chaque année l’occasion d’entendre des
conférenciers invités de haut niveau. Elles commenceront avec une session
dédiée au ciblage thérapeutique en oncologie, avec les meilleurs experts du
domaine, et se termineront par une conférence de prestige sur l’oncogène
Met, un sujet cher à plusieurs équipes du cancéropôle Nord-Ouest.
Comme vous le voyez, ce programme est très riche !
Excellentes journées à toutes et à tous !
Pierre Formstecher
Président du Cancéropôle Nord-Ouest
Editorial du Président

8èmes Journées Scientifi ques
10 au 12 juin 2015 – Deauville
5
Programme
Mercredi 10 juin
2015 - A.Midi
13h00 - 14h00 Café d’accueil
Enregistrement des participants
14h00 - 14h30 Stratégie du Cancéropôle Nord-Ouest
Véronique Pancré
14h30 - 17h15 SESSION « CIBLAGE THÉRAPEUTIQUE EN ONCOLOGIE »
14h30 - 15h15 Evaluation des altérations moléculaires tumorales en routine :
Comment ? Pourquoi ? L’exemple des cancers bronchiques
Fabrice Barlesi (Assistance Publique-Hôpitaux de Marseille)
15h15 - 16h00 Médecine personnalisée : les questions actuelles
Jean-Yves Blay (Centre Léon Bérard, Lyon)
16h00 - 16h45 Recours aux thérapies ciblées en oncologie :
Comment sauvegarder un principe d’universalité des soins ?
Grégoire Moutel (Ecole des Hautes Etudes en Santé
Publique EHESP Rennes-Paris Descartes)
16h45 - 17h15 Table ronde
17h15 - 17h45 Pause
17h45 - 18h00 Associer chercheurs et société civile : Les Seintinelles
Fabien Reyal
18h00 - 18h30 Favoriser le transfert vers l’industrie : le dispositif MATWIN
Lucia Robert, Nadira Delhem
18h30 - 19h45 Visite des posters
19h45 - 21h30 Cocktail dînatoire autour de l’espace poster
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
1
/
100
100%