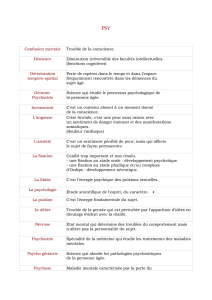
Fixation des tissus: notions et rappels Jean

1
Fixation des tissus: notions et rappels
Jean-Pierre Brion
Laboratoire d’Histologie et de Neuropathologie
Université libre de Bruxelles
B-1070 Bruxelles, Belgique
Emmanuel Gilissen
Musée Royal de l’Afrique Centrale
Département de Zoologie Africaine
Gestion des collections et des données biologiques
Leuvensesteenweg 13
B-3080 Tervuren, Belgique
Email: [email protected]

2
Avant-propos
Les notes qui suivent ont été rédigées afin d’accompagner une présentation réalisée par Jean-Pierre
Brion dans le cadre des séminaires du Laboratoire d’Histologie et de Neuropathologie de l’ Université
libre de Bruxelles, ces notes reprennent et commentent l’ensemble des diapositives de cette
présentation.
Des annexes ont été ajoutées au fil de ces notes. Elles n’ont d’autre prétention que de fournir le
background nécessaire à une compréhension complète de la partie de l’exposé qui les suit, sans
prérequis supposés. La matière de ces annexes fait partie de la culture « biologique » générale et a été
glanée dans diverses sources.
Seule l’annexe concernant la technique immunocytochimique (ou immunohistochimique) consiste en
diapositives reprises du cours d’histologie dispensé en seconde année de sciences de la santé (médecins,
dentistes et bioingénieurs) à l’Université libre de Bruxelles.
La thématique de la fixation des tissus s’adresse autant aux conservateurs de collections biologiques
qu’à ceux qui désirent utiliser les diverses techniques histologiques. Même si le lecteur de ces notes ne
compte pas réaliser de travaux histologiques dans l’immédiat, les différents aspects de ce qu’est une
fixation s’appréhendent au niveau cellulaire. Il sera donc beaucoup fait appel dans ces notes à des
observations réalisées lors de travaux d’histologie.

3
Dia 1 : titre
Dia 2 : Fixation: définition
Il s’agit d’un processus physique ou d’une réaction chimique qui produit les effets suivants :
• Insolubilisation des composants cellulaires
• Préservation de leur localisation spatiale
La fixation produit donc une image « instantanée » d’un tissu biologique (« tissu » dans la suite de ces
notes) ou d’une cellule, et ce du point de vue structural.
Dès lors, si un tissu ou des cellules, dans le cas de cellules en culture, sont plongés dans un fixateur, que
se passe-t-il ?
Dia 3 : Constituants de la cellule en terme de macromolécules responsables de la « structure » des
tissus :
• Lipoprotéines (membranes cellulaires...)
• Lipides et hydrates de carbone (cytoplasme, organelles)
• Acides nucléiques (noyau)
• Protéines fibrillaires du cystosquelette
La matrice extracellulaire est constituée de
• Protéines fibrillaires extracellulaires
• Glycosaminoglycanes extracellulaires

4
Annexe: la structure générale des protéines
Un polypeptide est une chaîne d'acides aminés reliés par des liaisons peptidiques. On parle de
polypeptide lorsque la chaîne contient entre 10 et 100 acides aminés. Au-dessus de 100 acides aminés
on parle généralement de protéine. La structure primaire, ou séquence, d'une protéine correspond à la
succession linéaire des acides aminés la constituant sans référence à une configuration spatiale.
La structure secondaire décrit le repliement local de la chaîne principale d'une protéine. L'hélice ou
chaîne alpha est une des deux grandes structures secondaires (avec les feuillets bêta). Elle est formée
par l'enroulement régulier d'une chaîne polypeptidique sur elle-même.

5
Les feuillets bêta ou feuillets bêta plissés sont des structures secondaires qui s'observent dans des
portions de protéines. Ils se matérialisent sous forme d'un pli successif avec différentes ondulations de
la chaîne polypeptidique (comme un accordéon). C'est une structure plus lâche et plus plane que l'hélice
alpha. Un feuillet bêta donnera lieu à des interactions d'acides aminés d'une même chaîne
polypeptidique qui sera repliée sur elle-même. Les groupements CO et NH forment des liaisons
hydrogènes (liaison plus lâche que dans les hélices alpha).
La structure tertiaire d'une protéine correspond au repliement de la chaîne polypeptidique dans
l'espace. On parle plus couramment de structure tridimensionnelle (3D). Les liaisons hydrogènes
interviennent également dans la mise en place de la structure tertiaire. La structure tridimensionnelle
d'une protéine est intimement liée à sa fonction: lorsque cette structure est cassée par l'emploi d'agents
dénaturants, la protéine perd sa fonction: elle est dénaturée.
La figure ci-dessous représente la structure 3D de la myoglobine, les hélices alpha forment une structure
3D complexe. Cette protéine fut la première dont la structure a été identifiée par cristallographie aux
rayons X en1958. Cette protéine est le transporteur intracellulaire principal de l'oxygène dans les tissus
musculaires et stocke l'oxygène dans les muscles.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
1
/
37
100%