II-1-2 - Rôle mécanique des filaments du

7
Partie A : Les modèles du comportement mécanique de la cellule
adhérente dans son microenvironnement – Etat de l’art
Ce chapitre bibliographique se présente en deux grandes parties :
La première décrit la cellule nucléée, adhérente en conditions in vivo à une matrice
extracellulaire avec laquelle elle interagit chimiquement et mécaniquement. Un accent particulier
est mis sur la description du cytosquelette (CSQ) dont l’organisation structurale et multi
compartimentée fournit à la cellule adhérente une charpente tridimensionnelle, impliquée dans la
forme et la stabilisation cellulaires, la structure cytosquelettique jouant un rôle fondamental dans
la réponse mécanique de la cellule.
La seconde partie de ce chapitre présente de manière non exhaustive une revue des
propriétés viscoélastiques de cellules vivantes en culture testées d’une part expérimentalement par
différentes techniques de micromanipulation (paragraphe II-1) et interprétées, d’autre part, à
l’aide de différents modèles théoriques (paragraphe II-2). Ces modèles, développés pour la
quantification et l’analyse de la réponse mécanique cellulaire, se répartissent en deux grandes
catégories : les premiers modèles, qui datent du milieu du siècle dernier et issus de la mécanique
des milieux continus puis, plus récemment, sont apparus les modèles structuraux dont
notamment les modèles de tenségrité (partie II-2-3) pour décrire le comportement mécanique des
cellules vivantes en interaction avec leur microenvironnement.

8
I – Description de la cellule adhérente dans son microenvironnement
La cellule est la plus petite portion biologique capable de se reproduire et représente ainsi
une entité unitaire à travers laquelle s’organise la vie. Véritable brique constituant l’édifice de tout
être vivant, elle existe sous deux principales formes dans le règne animal : nucléée ou sans
véritable noyau. La cellule nucléée (eucaryote) est hautement structurée et en son sein se trouve un
noyau bien défini, délimité par une membrane nucléaire et contenant le message génétique porté par
les chromosomes. C’est le cas de la plupart des types cellulaires du corps humain, comme les cellules
épithéliales, endothéliales, gliales, les neurones, etc. Pour sa part, la cellule sans noyau défini
(procaryote), dont les bactéries sont le prototype, n’a pas de réelle structure interne. Le champ
d’application de la présente étude est centré sur la cellule nucléée qui présente une organisation
interne structurée et qui adhère, en conditions in vivo, à une matrice extracellulaire ainsi qu’aux
cellules voisines composant son microenvironnement immédiat, avec lequel elle interagit
mécaniquement.
I-1 – Organisation globale de la cellule adhérente
Au cours de sa vie, la cellule suit un cycle qui se décompose en plusieurs phases, en
particulier des phases de préparation à la division cellulaire et la division elle-même (phases de
prolifération) ainsi qu’une phase d’apparente « latence » au cours de laquelle la cellule a une
activité métabolique en apparence « faible » et atteint une organisation interne « stable » au regard
des autres stades du cycle (phase de différentiation cellulaire) [Cau et coll. 2001]. Cette dernière
phase est, de toutes, la plus longue dans le temps et constitue le champ d’application de la
présente étude. En effet, l’organisation interne à la cellule diffère complètement entre les diverses
phases : au cours des phases de division, certains filaments cytoplasmiques (les microtubules)
rayonnent depuis deux centrosomes, formant les deux faisceaux mitotiques permettant de séparer

9
les chromosomes après la duplication de l’ADN, tandis que d’autres protéines cytoplasmiques (en
particulier l’actine) s’organisent très rapidement de façon à ramener la membrane cytoplasmique
vers le milieu de la cellule « mère » puis à scinder la membrane pour permettre la division en deux
cellules « filles ». A l’opposé, au cours de la phase de différentiation, le cytoplasme atteint une
autre organisation dont la stabilité structurale permet à la cellule de remplir la plupart des
fonctions biologiques pour lesquelles elle est génétiquement programmée (expression de certains
gènes, synthèse protéique, migration, etc.) [Cau et coll. 2001].
La cellule adhérente est constituée d’une membrane cytoplasmique (ou plasmique) délimitant le
milieu extracellulaire du milieu intracellulaire, d’un cytoplasme situé entre le noyau et la membrane
plasmique ainsi que du noyau séparé du milieu intracellulaire par la membrane nucléaire. Au
niveau de la membrane cytoplasmique se trouvent des complexes moléculaires composés de
molécules transmembranaires (intégrines, cadhérines, VCAM, ICAM, etc.) qui représentent un
nombre fini de liens physiques directs entre le cytoplasme et le milieu extracellulaire ; ce sont les
points d’ancrage de la cellule adhérente à son voisinage immédiat, appelés point focaux d’adhérence
ou plaques d’adhésion. En effet, la cellule n’adhère pas de façon continue sur l’ensemble de sa
surface en contact avec la matrice extracellulaire et/ou les cellules environnantes mais de façon
discrète, spécifiquement en ces points focaux d’adhérence.
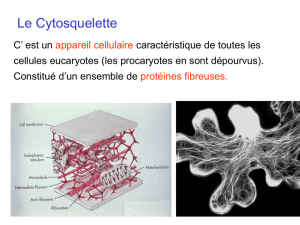
Le cytoplasme est composé d’un fluide visqueux appelé cytosol dans lequel baignent divers
organites, parmi lesquels on retrouve les mitochondries, le réticulum endoplasmique, l’appareil de Golgi
ainsi que le cytosquelette (CSQ). Ce dernier représente une véritable charpente pour la cellule
adhérente et constitue un continuum physique entre les points focaux d’adhérence et le noyau. Le
CSQ se présente sous la forme d’une structure tridimensionnelle complexe, assurant un lien
physique entre le noyau et les récepteurs membranaires, et principalement formée de trois types

10
de filaments, véritables biopolymères issus de l’assemblage de macro-protéines, interagissant entre
eux [Maniotis et coll. 1997 ; Janmey 1998] :
- les filaments d’actine (actine-F) ou microfilaments, polymères d’un diamètre moyen de 5 nm et
d’une longueur moyenne de l’ordre du micromètre. Polarisés, ils montrent une dynamique
biologique au sens où ils sont engagés dans un double processus de polymérisation à une
extrémité du filament et de dépolymérisation à l’autre extrémité. Les microfilaments s’organisent
en sous-réseaux qui diffèrent structurellement en fonction de leur localisation dans la cellule
[Cheng et coll. 2000 ; Katoh et coll. 2001].
- les microtubules, fibres creuses polymériques constituées de monomères de tubuline, de
diamètres extérieur de 30 nm et intérieur de 18 nm, d’une longueur variant entre 2,5 et 10 µm
dans le cas des cellules endothéliales et musculaires, et pouvant atteindre 20 µm dans le cas des
cellules nerveuses. De même que pour les filaments d’actine, les microtubules se polymérisent et
se dépolymérisent continuellement, et montrent une plus grande « instabilité » biochimique au
regard des autres types de filaments cytosquelettiques. Il a, en effet, été observé que les
microtubules peuvent facilement se désagréger en fonction de l’état d’adhésion de la cellule, bien
que les points focaux d’adhérence semblent participer à leur stabilisation [Kaverina et coll. 1998].
- les filaments intermédiaires, polymères d’un diamètre de 11 µm, dimension « intermédiaire »
entre celle des microfilaments et celle des microtubules. Il n’est pas totalement établi qu’un
processus de polymérisation/dépolymérisation existe réellement dans ces filaments qui semblent
ainsi biochimiquement plus « stables » que les deux autres principaux composants du CSQ
[Coulombe et coll. 2000].
Ces trois sous-réseaux filamenteux s’organisent en interagissant entre eux et en générant
une tension interne au cytosquelette [Harris et coll. 1980 ; Heidemann et coll. 1990]. En effet,
Harris a cultivé des fibroblastes sur un substrat déformable (silicone) et a observé que celui-ci se
plissait au niveau des zones d’adhésion des cellules, indiquant l’existence d’une tension interne

11
aux cellules qui s’exerce sur le substrat [Harris et coll. 1980]. Pour sa part, Ingber a mis en
évidence le lien intime entre la structure du CSQ et la forme globale de la cellule ainsi que
l’importance du réarrangement spatial des filaments du CSQ en cours de déformation globale
cellulaire [Ingber et coll. 1985]. Ainsi, les filaments du CSQ se réorganisent et génèrent des forces
de tension en divers endroits du cytoplasme, permettant la migration de la cellule sur son
substrat. Plus globalement, le cytosquelette possède une organisation spécifique multi
compartimentée dont chaque compartiment possède une composition et un rôle mécanique qui
lui est propre. Cette organisation structurale et la forme globale de la cellule revêtent une
importance fondamentale dans les grandes fonctions cellulaires [Cau et coll. 2001].
I-2 – Organisation structurale du cytosquelette
De nombreux auteurs ont montré que le comportement mécanique de la cellule
adhérente est essentiellement dominé par les propriétés rhéologiques et structurales de son CSQ
[Ingber 1993 ; Wang et coll. 1993 ; Janmey 1998]. En particulier, il semble exister un lien étroit
entre l’organisation architecturale des filaments du CSQ et la réponse mécanique cellulaire. Par
exemple, les courts filaments d’actine couplés à des molécules comme la tropomyosine et la
myosine II, constituant un fin réseau sous-membranaire (le cortex cellulaire), fournissent à la cellule
une tension corticale et lui permettent de s’adapter très rapidement, en particulier dans les
mouvements cellulaires ainsi que dans des processus locaux impliquant des réactions brèves
comme l’endocytose [Albrecht-Buehler 1987 ; Hartwig et coll. 1986 ; Bennett 1985 ; Bretscher
1991 ; Fox et coll. 1988 ; Cheng et coll. 2000]. A l’opposé, les longs filaments hautement
polymérisés, constituant la partie plus interne du cytosquelette, permettent de garantir une
stabilité globale de la cellule, condition essentielle pour qu’elle puisse remplir pleinement son rôle
biologique en interaction avec son milieu environnant [Maniotis et coll. 1997 ; Ingber 1985]. Par
ailleurs, lorsqu’une cellule eucaryote n’adhère pas à un substrat, elle prend une forme arrondie et
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
1
/
38
100%