02/02/15 GILLOT Diane D1 CR : MACIOW Benjamin

!"!#$%!#&%"'
!"#$%
&'()*++
(,
!"!#$%!#&%"'
"$ -$((" .%/( "$ ,"( "$ !$ /(0$1%+$
#" % , ! %, 0$ 1 ' ! , ( % 1 .$"$( !12(%
!12(' &&&
Introduction
34567489:5:4;89:5<:=>;8>?5@:A5BC=?:A5D>65;84@>6A:4C5E5F=5G89H=C6845@I>45;J>9K5@L8M5FL6H?89C=4;:5@:5FLBC>@:5@:A
H8@NF:A5=46H=>OP5
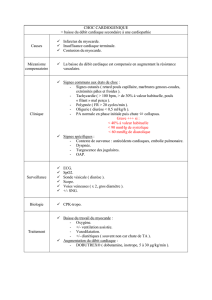
!++' "!%$2("$ '$! % !",'( '"
–"!%# '. '"%! ""()%%", /"$ %' ( !" %
$"$"$)!$$%
–# '. '( +"%% #!&
– "!% ("" -. !" " ! (%$ (%$ $%'/ % !" $ , !$
!'#%"(( ( '/( %%$ (""$('! ','' "!$"$ !$%"
($%"$( " $2% ',' Q ' ("$ % ) )R&
–, "$%%2"($%#'' $%'%! ' %"$+"($%.%S
%12' $ &
–T+"',%$"!%$ /%"$ $$$%$&
"$$2""$%"!%)"%",0$!$ !""/%+" !$U$
# .%&)-%+ Q!""!%$ R"%0$V). Q# $%/" %%R&
%"!%$ %"$ .$"$((%$(0$)-%1)"" "$#$("(SV
). & ($ ' ! "$ ,'0$/#%! ! ,/ '% $ % !%,,
,''0$/ '% $%(" %%!$!'#%"((&
Plan
A. Les principales étapes du développement cardiaque
!
!
" #
" $
"!
B. L'épicarde et la formation des coronaires
C. L'endocarde et la formation des valves cardiaques
D. Le développement du cœur : nouveaux concepts

!"!#$%!#&%"'
A. Les principales étapes du développement cardiaque
'#%!"(#$)!!%&"%""*!$"%+,%-.,
#"#%% /#%("%(!"!"%#&%0",#'*
W:A5?9:H6:9A5BFBH:4CA5@:5F=5H89?X87:4NA:5;=9@6=D>:5?:>Y:4C5A:5Y8695@:A5F:5Z[NH:5"$ &
'#&(!%$#*
\]/"#"(( ^ !^%",$+ S)#%Q#.%$ %#$!" %R0$#" , "$( /
S( !-" !%#!%_#^ %U$ &
T"$( # !%"$)'!%'"! %' %!#'( "0$
(%)0$&1!( (%)0$0$!' #%U$ &'"! (%)0$ ( ")
!%1!"! & ',"#!" !( '$ $ !%%$% !0$, S!,$2&
#"1!)"""%/"`Vaa]&%!$$!$'"! %' %
(%)0$"$%('+"!( ",'$ !0$/%%%$%'"! 0$2( %" !
+$ %'!$!'#%"(( !0$&
b=9=FFNF:H:4C5@L=>C9:A5G=;C:>9A5D>65?98Y6:44:4C5@>5C><:54:>9=F5Y84C5=Y8695>4:5=;C68454B7=C6Y:5A>95F:5HBA8@:9H:
A8H6C6D>:5?8>95:H?c;X:95F:5?9879=HH:57B4BC6D>:5@:5F=5;=9@687B4NA:5@:5A:5H:CC9:5:45?F=;:5@=4A5;:CC:5?=9C6:5@>
HBA8@:9H:P5

!"!#$%!#&%"'
!
234 5 63778734 5 9:;<=>?@:?634 5 6A:B?AC834 5 D;:E3>@ 5 BFAG;:B 5 73 5##"% * H# "
""%/"I##"%"%")/"J&"%&%"%#%"
"%$KI)!!"%!!L#B38M59A:@?3457A@=:A7345B357F3EG:N;>5C8?54FA66;73>@59;8:
&%!%&*
Q%$. %'S%( !" %!%1. "( %(' !!" %R
T2(' )-%"$ /%%%$%!$'"! ""%" '.%$&$ (%!dS"$$
!%1. "/!$2 ',"$!'( "(("'#"!" $+" !$.%$. !0$&
!/%$. !0$+" '! ""$)%" !S%12' $ /%1!" !S%1' $ /%
,%' !0$ %!$2Q"%$""("'! 2 %%$% 0$'( %!$2"$)/
(" ! '(!$!'#%"((R&
e

!"!#$%!#&%"'
!
R'(
–$!%""%"$)"!O)"1%"!O%$&
–H#%"$#%""&1"!&"I # %%# !##"%" !%
# #!" !"% # &&$"%#L#* """P% # '
!%&I)#&&$"%#L#J%%#%)"%#KI"&&$"%$""Q
%"*
" %%#"! , # %( !" %$S%1+%2"!$"$
," # ("$ 0$"%"$ ()!1." !# %,$)("$ !" %/( "$!
%' %"!'( %12! "f,$)!$" (&0$1%!"%!%' %""($
#" !"%!$("" !0$&
.Rg'' "2Q$#(%!" ,R
`$$ # !!' ,%&
"$# (%$$ '," !1)'' "2& !,$ !"/ %" 1% " $ "$ (%$$
" ,
–#%#")###%#%%#I%#"%"")#"!,%#"#"%"#R"S
!!!%("#T%%"Q%$($## " %!R
–#%##I%#"%"")#"!%Q ^! "$.%%"" ," 'R
–!2 " !/ !$%$%# "!%("!$U$ Q" %" 'S,$)R
–"' /%" ,"!("'' 0$!+h"" %
(""" %((%'$"%$&
"#/")#"%%I"/!#!,!%*
H"%"#/")#"!%"!)#%#*
V

!"!#$%!#&%"'
` $($%",''0$"($!$ $$# $)-%"$ &1$$!$(%"!
%1" %%! ""!$S!()"%",#%!&
""'( !$"!%!'0$(%0$'!%+" "!$%&
`!%, $%"/)-%"$ ")-%1)"%$ ',"((%'%"'U"#"/S
%12 ''!%%,%'/!%0$%% "$#$!%%$%%'!"%%"$ "$"$
!%_/( %%"%"!( "'Q( "'"!%R ''( %%$%!1$
$%i'Q,$)R!%1. "&( "'"!%Q!%+%%!afR#"% S%$ '($ /
$!! '"Q( "'%+'%++$ !( "'"!%R."$S
%1#"!$,`jf&/0$#! %1!',$)!%1. "&
,"H%1V"%)"%"#"%O$"$%/#$%%QL*
T2(' " # %12( " ! 0$$ "%'$% ( "."& !'% $ #$
,''0$$ ',"( $% !$,`2)-%"$ /( 2(%%12"V#"( ""$ `&
".$"$ kk2"V/0$"!$%1#%!"!`2&
%" $!$(%"%$("!!$2" %%!(" %%! "&
T(" %`22( '$#$!$"$ ,$)&
lF5m5=5@84;5>4:5=<A:4;:5@L6@:4C6CB5@986C:n7=>;X:5@=4A5F:5;J>95A65b6COo5:AC5=<A:4CP
345?:>C5=>AA65Y8695;X:p5;:A5HcH:A5H>C=4CA5>4:564Y:9A6845@:5F=5;844:O6845@:A5798A5Y=6AA:=>Oq5C9=4A?8A6C684
!, "#$2Q%1" !#%1 ($%" ! R
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
1
/
20
100%