CH 12 (13) réaction chimique par échange de proton

CH 12 (13) réaction chimique par échange de proton
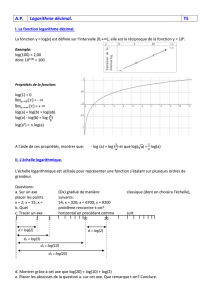
1. Définition et mesure du pH
Pour des solutions suffisamment diluées, le pH est défini
par:
Cette grandeur, sans unité, est introduite car les
grandeurs des concentrations en ion oxonium sont
souvent d’ordre de grandeur trop différentes pour être
placées sur un axe linéaire.
Comment mesure-t-on le pH d’une solution?
Pour mesurer le pH d’une solution on utilise un pHmètre,
étalonné au préalable.
Quelles sont les bornes du pH?
Le pH est compris entre 0 et 14. (solution neutre pH=7)

Donner l’expression de la concentration des ions
oxonium en fonction du pH.
Inversement, la concentration en ions oxonium
peut être exprimée par:
Comment varie la concentration en ions oxonium,
en fonction du pH?
La concentration en ions oxonium diminue quand le
pH augmente.

2. Equilibre chimique
Réaliser TP Activités mesure de pH de solution p 324
Conclusion:
Lors qu’on mélange des réactifs, ils réagissent pour
donner des produits, mais cette réaction en sens
direct est limitée par la réaction inverse. Lorsque ces
deux réactions ont lieu avec la même vitesse, alors le
système chimique a atteint un équilibre chimique
(équilibre microscopique dynamique). Il faut donc
écrire la réaction avec une double flèche:

3. Acide et base selon Brönsted
3.1. Définition
Un acide est une espèce chimique capable de céder
un proton (ions hydrogène ).
Une base est une espèce chimique capable de capter
un proton.

3.2. Couple acide/base
Lors d’un transfert de proton dans une demi-équation
acido-basique, intervient toujours un couple
acide/base:
Exemples:
(Couples de l’eau): ou
ou
L’eau est un ampholyte
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
1
/
13
100%